miRNA let7对小鼠脑组织基因表达谱的影响研究
伊力亚斯·艾萨,卡哈尔江·艾力,阿布力米提·麦提图荪,付 瑾
(新疆维吾尔医学专科学校药学系,新疆 和田 848000)
miRNA是一类在所有生命体中高度保守、长度为18~22个核苷酸的非编码RNA[1]。miRNA通过与mRNA的3′ UTR区域互补结合来沉默或者下调靶基因表达水平,以行使其对靶基因的转录后调控作用[2]。相关研究已证实,miRNA参与多种细胞生物学过程,如增殖、分化、凋亡等[3]。因此,miRNA的异常将会导致许多疾病的发生、发展。人类基因组可编码超过1 917个miRNA,约30%的mRNA可作为miRNA的靶基因,且一种miRNA可以对应调节多种靶基因表达[4-5]。因此,miRNA可作为重要的调控因子,参与并调节许多生理生化过程。
let7是最初在线虫中发现的一类由13个成员组成的miRNA家族,由于其序列的高度保守性及家族成员之间序列的相似性,let7在包括线虫、人类及其他物种中作为重要的调节因子调控细胞的许多生物学过程[6- 7]。一系列体内、外研究已证实,let7可通过调控癌基因、抑癌基因的表达水平来影响肿瘤的发生、发展[8-9]。同时,let7本身的表达水平也受到某些肿瘤相关基因的调控,如p53突变体、Twist、MYC等[10-11]。因此,在肿瘤患者的诊断及其预后评价中,let7水平可以作为临床诊断治疗的生物标志物。关于let7对肿瘤及其他疾病影响的分子机制仍不明确,许多问题有待进一步研究。
有研究报道,let7在脑组织中诱导细胞发生自噬,以清除有害蛋白聚集体,如α-核突触蛋白及损伤老化的线粒体,从而减轻帕金森病、阿尔茨海默病患者的症状[12]。众所周知,自噬受mTOR信号通路调节,该通路是代谢信息整合的焦点,mTORC1在平衡生物合成和分解代谢中具有核心作用。在mTORC1的各种输入中,氨基酸感应途径最为有效。在此前的研究中,基于对营养缺乏神经元的转录组(GSE60848)分析,确定let7是一种能够促进神经元自噬的miRNA。let7通过下调氨基酸感应途径来激活自噬,从而阻止mTORC1激活。let7在脑内诱导自噬,并在多聚谷氨酰胺病的慢病毒模型中大大减少蛋白质聚集。因此,let7在高等生物的营养稳态和蛋白质稳态调节中起着核心作用。let7除在脑组织诱导自噬外,研究人员也在脂肪组织、骨骼肌等其他组织中观察到自噬水平的升高,推测let7除了具有调控中枢神经系统的自噬水平外,在调控整个机体能量和蛋白质代谢也发挥了中心作用。为从分子水平研究let7的作用机制,本研究利用生物信息学研究方法分析了let7敲低的小鼠脑组织mRNA表达谱数据,并初步构建let7-mRNA调控网络,以探索let7发挥生物学功能的分子调控机制。
1 材料与方法
1.1材料 从GEO公共数据库检索并下载GSE60848数据集,该数据集包含了2对let7敲低的小鼠脑组织样本和2对正常脑组织样本。本项研究中所有样本均利用GPL1261平台进行检测,并利用GEO2R在线分析工具进行基因的表达分析,以获得基因表达矩阵。将统计值P<0.05及差异表达倍数值log2|FC|>1作为差异表达基因筛选阈值,进行差异表达基因的筛选,并绘制相应的火山图。
1.2方法
1.2.1差异表达基因的功能注释和信号通路富集分析 首先,利用DAVID在线生物数据库对差异表达基因进行基因名转换,将所有差异表达基因的基因名称(Gene Symbol)转换成基因标识符(Entrze ID)。其次,进一步将转换得到的差异表达基因标识符输入DAVID数据库,对其进行基因功能注释和KEGG信号通路富集分析。最后,对分析得到的结果进行筛选,将校正后的统计值P<0.05作为筛选条件,筛选出满足条件的条目,并利用R软件包对筛选结果进行可视化。
1.2.2确定关键基因并构建let7-mRNA调控网络 利用STRING数据库对差异表达基因进行蛋白质互作网络分析,评价并筛选分析结果,将综合评分大于0.4的相互作用节点导入Cytoscape 3.7软件,构建差异基因的蛋白-蛋白互作网络。进一步应用Cytoscape软件的MCODE插件分析蛋白-蛋白互作网络中具有密切相互作用的子网络,并进一步利用CytoHubba插件确定关键基因。设置MCODE插件参数如下:Degree Cutoff=12,其余默认。
2 结 果
2.1差异表达基因的筛选 利用GEO2R在线分析工具对GSE60848数据集进行处理分析,发现一共分析处理了45 101个基因。通过对其分析结果的筛选发现,表达上调的基因69个,表达下调的基因8个(图1)。
2.2差异表达基因的功能注释与通路富集分析 利用DAVID在线数据库对筛选出的77个差异表达的基因进行GO功能注释分析与KEGG信号通路富集分析。以校正后的统计值P进行筛选并排列,最后利用R软件对其结果进行可视化处理。GO功能富集分析结果显示,差异表达的基因主要与免疫应答、抗原递呈、GTP酶活性、GTP连接等生物学过程密切相关。KEGG信号通路富集分析结果显示,差异表达的基因主要富集在糖代谢、细胞黏附、抗原加工提呈、吞噬小体等信号通路(结果见表1、表2)。
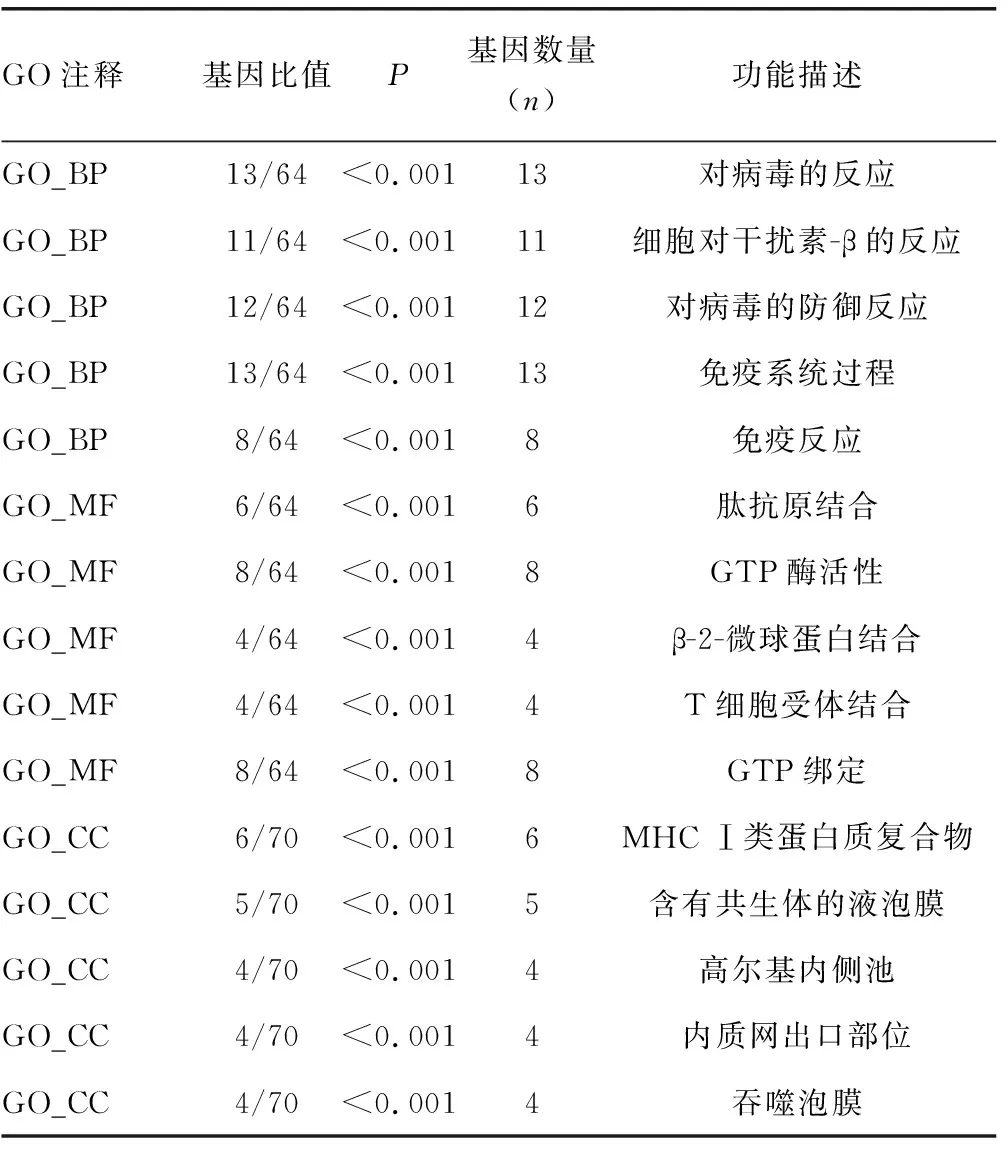
表1 差异表达基因的功能富集分析结果

表2 差异表达基因的功能富集分析结果
2.3蛋白质互作网络分析 通过STRING在线分析工具,对筛选出的77个差异表达基因进行蛋白质相互作用网络分析,排除其中互作评分小于0.4的蛋白,并将分析结果导入Cytoscape软件中进行可视化处理。为进一步确定其中的关键基因,本研究中利用MCODE插件对PPI互作网络进行分析,筛选了评分最高的子网络,并利用cytoHubba插件子网络进行分析,计算节点得分,共筛选排名前10的关键基因,分别为TRIM30A、GBP3、PARP14、IFIT2、RTP4、IFI44、OASL2、IFIT1、IFIT3、IRF7,见图2。
3 讨 论
随着对非编码RNA领域的深入了解,越来越多的研究表明,miRNA在真核生物体内参与调解几乎所有的生理病理过程。一种miRNA通过调控多种靶基因的表达,在生物体内组成了非常复杂的调控网络。计算机科学、生物信息科学的蓬勃发展,以及高通量测序技术的愈加成熟,都为研究复杂基因调控网络提供了强有力的技术支撑。本研究正是利用在线GEO公共数据库,并借助生物信息学研究方法,从分子水平系统地阐释了let7对机体发挥作用的可能机制。let7是目前为止研究最为广泛的miRNA之一,由于其在疾病发生、发展过程中的表达量会发生改变,导致其下游转录因子、mRNA和功能蛋白质组成的复杂调控网络也发生改变,最终引起整个机体生命状态的异常。因此,深入挖掘let7的分子调控功能机制将为疾病的早期预警、靶向治疗和预后分析提供理论基础。
越来越多的证据已经揭示了let7在癌症中的作用。在肺癌患者中,let7表达下调与肺癌组织RAS基因表达升高相一致。随后,这种let7依赖性RAS表达升高在非小细胞肺癌(NSCLC)中得到进一步证实,提示let7通过抑制RAS而阻断肿瘤的发生[13]。除了靶向RAS外,let7还调节高迁移率族蛋白A2(HMGA2)的表达。HMGA2是一个早期胚胎癌基因,其在干细胞中过度表达并与干细胞自我更新密切相关[14]。干细胞中let7低表达与HMGA2的高表达相一致,这种表达模式可维持干细胞处于未分化状态。当干细胞分化时,let7表达水平明显升高,并通过识别HMGA2基因3,UTR上的多个结合位点,下调HMGA2的表达。最近的一项研究表明,let7的异位表达通过下调RAS和HMGA2的表达,抑制乳腺癌小鼠模型的细胞生长和乳房球形成[15]。此外,研究发现let7通过抑制细胞周期调节因子,如细胞周期蛋白A、D1、D3和CDK4,来抑制肿瘤细胞的非锚定依赖性生长和细胞周期进展[16-17]。
在许多生物学过程中,已经发现了miRNA表达谱的改变。miRNA在许多病理生理过程中受转录后机制的调控,因为初级miRNA的水平常常与其成熟形式的水平不一致。let7转录后调控的证据来自对小鼠胚胎的研究,成熟的let7a、let7c和let7e只能在中枢神经系统发育的早期被检测到,而其前体的水平在神经发育过程中保持稳定[18]。let7在发育过程中的时间表达模式受到多种蛋白质因子的复杂调控。研究人员已经鉴定出数种与let7成熟有关的RNA结合蛋白,这些蛋白识别let7的前体并影响其生物发生。
let7是一个关键的调节因子,同时参与了正常发展和癌症。了解let7的功能及其调控途径对当前药物研究具有重要意义。let7调控基因的研究已经大大提高了人们对miRNA基因转录、剪接和成熟的认识。因此,对let7的整体调控及其发生机制的研究将为let7的调控提供关键信息,并具有巨大潜力。本研究基于GEO2R在线分析工具,分析筛选了let7缺失的小鼠脑组织中差异表达的mRNA,结果显示,共有77个差异表达的基因,其中上调的有69个,下调的有8个。let7敲除后筛选出的这些上调基因很好地阐释了miRNA所起到的调节功能,即miRNA通过与靶基因特定保守区域互补结合,从而抑制或沉默其表达水平。然而,本研究中出现少量下调的基因,其可能受到let7的间接调控,从而导致其表达水平降低。为进一步整体分析let7的分子功能,本研究对所有差异表达的基因进行GO功能注释分析和KEGG信号通路富集分析,发现let7缺失导致差异表达的基因主要参与免疫应答、抗原递呈、GTP酶活性与GTP连接活性等生物学过程,表明let7的功能可能与免疫、细胞骨架、代谢等过程密切相关。有研究证明,let7能够在癌症疾病中影响基因表达变化,如前列腺癌[19-20]、肺癌[21]、甲状腺癌[22]等。此外,miR-let7家族已被证实在心血管疾病、糖尿病、血管平滑肌炎性反应、增殖和凋亡中都发挥了至关重要的作用[23-24]。结合目前关于let7家族的相关研究及本研究结果可知,let7家族作为一种关键的信号分子,参与调控细胞内一系列复杂的基因表达调控,最终影响疾病的发生、发展。KEGG信号通路富集分析结果表明,let7主要参与糖代谢、细胞黏附、抗原加工提呈、吞噬小体等信号通路。这些相关信号通路对let7发挥生物学功能高度敏感且有效。如抗原提呈加工信号通路作为免疫反应的起始阶段,对发动整个免疫应答过程必不可少,而细胞黏附相关信号通路又是免疫应答、炎症发生、凝血、肿瘤转移及创伤愈合等一系列重要病理生理过程的共同分子基础。在一项自身免疫性脑脊髓炎动物模型研究中,研究人员已经证明let7通过负调控致病性辅助性T细胞17(Th17)向中枢神经系统增殖、分化和趋化因子介导的迁移,从而发挥保护作用[25]。除此之外,另有研究表明,let7家族通过PI3K/AKT信号通路[26]、Wnt/β-Catenin信号通路[8]、MAPK信号通路[27]和Lin28/let7等信号通路[28]参与免疫应答、生长、代谢、增殖、凋亡等重要的生物学过程。目前,let7家族可作为一种生物标志物,用于合理、精确的临床诊断,从而提高患者的生存率[29]。
差异表达基因的蛋白互作网络被用于进一步推测let7在生理状态下影响生物信号及生物功能的反应机制,其结果显示,TRIM30A、GBP3、PARP14、IFIT2、RTP4、IFI44、OASL2、IFIT1、IFIT3、IRF7等10个关键基因与let7组成核心调控网络,参与调控基因表达过程。这提示let7可能直接或间接地通过靶向调控上述核心基因的表达,对整个生物系统生长、发育、分化及其他生物学功能实现影响。另外,通过对这些核心基因的文献回顾与调查发现,截至目前,这些基因已被证实主要参与DNA损伤修复、炎症、免疫、代谢等过程,这一方面提示本项研究结果的可靠性;另一方面对let7的基础研究提供了新的研究思路和方向,也为探索发现let7家族新的作用靶点及其密切相关疾病的诊断、治疗、预后提供宝贵的研究基础。

