镉胁迫下丛枝菌根真菌对小麦生理特性和根际土壤酶活性的影响
郭 晖,周 慧,庄静静,王晓冰
(1. 新乡学院 生命科学与基础医学学院,河南 新乡 453003;2. 新乡学院 土木工程与建筑学院,河南 新乡 453003 )
镉(Cd)是毒性较强的重金属之一,在环境中稳定、易累积、不易清除。2021年《中国生态环境状况公报》显示,影响我国农用地土壤环境质量的主要污染物是重金属,其中Cd为首要污染物[1]。Cd进入植物体内可破坏植物的光合结构、降低叶绿素含量、抑制碳代谢酶活性,从而降低植物的光合速率[2-3]。在较低浓度Cd胁迫下,植物体内的过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)等抗氧化酶活性升高,有效增强植物对Cd胁迫的抵抗能力[4],但是植物对Cd 胁迫的抵抗能力有限,Cd在植物体内积累到一定浓度后会对植株造成不可逆的损伤。
丛枝菌根真菌(Arbuscular mycorrhiza fungi,AMF)能够与陆地上绝大多数植物根系形成菌根共生体,进而对宿主植物产生多种积极效应,其最基本的效应就是缓解逆境胁迫,增强植物的抗逆能力,包括重金属、盐碱、干旱、病害、涝害和寒害等[5]。AMF 在重金属污染条件下可通过螯合作用与重金属形成螯合体,或通过菌丝固持作用将部分重金属阻滞于根部,降低植株地上部重金属浓度,有效缓解植株的重金属胁迫[6-7]。另有研究表明,AMF 可通过提高根际土壤酶活性、促进宿主植物对矿质元素的吸收、扩大植物的根系面积、改变根际理化性状、提高宿主植物体内抗氧化酶活性以及改变重金属化学形态等来缓解重金属对宿主植物的毒害[8-9]。
河南是我国小麦大省,小麦种植面积占全国近1/4,但是部分地区农田面临严重的Cd 污染,严重影响小麦产量和粮食安全。研究发现,AMF 可以减轻Cd 对农作物的毒害作用[9-11]。另有研究发现,在Cd胁迫下,接种AMF 会对作物生长发育产生负面作用,但能减少体内Cd 积累[12],说明Cd 胁迫下接种AMF 对植物的影响可能跟宿主种类有关。在小麦上的研究发现,接种AMF可以显著提高小麦的株高和生物量[13]。但目前尚未见接种AMF 对Cd 胁迫下小麦毒害缓解作用的报道。为此,设置不同AMF接种处理,研究Cd 胁迫下AMF 对小麦光合生理特性、抗氧化酶活性和根际土壤酶活性的影响,探讨AMF-小麦共生体系对Cd胁迫的响应,为农田Cd污染钝化修复提供理论依据。
1 材料和方法
1.1 试验材料
供试小麦品种为矮抗58,由西北农林科技大学农学院提供。
AMF 为 根 内 根 孢 囊 霉(Rhizophagus intraradices,Ri)和 摩 西 斗 管 囊 霉(Funneliformis mosseae,Fm),均购置于长江大学根系生物学研究所。将无菌土壤、无菌沙子、无菌蛭石按照体积比2∶5∶3混合作为培养基,以白三叶草为宿主植物,进行AMF盆栽扩繁培养。
1.2 试验设计
采用土培试验,所用土壤经自然风干后磨碎,于高压灭菌锅中经蒸汽灭菌后装入盆钵中。盆钵口部直径23 cm、底部直径17 cm、深27 cm,每盆装土10 kg。分别取1 L 0、50、100、200 mg/L的CdCl2溶液加入各盆,即得Cd 含量为0、5、10、20 mg/kg 的Cd污染土壤,记作Cd0、Cd5、Cd10、Cd20,平衡3个月后备用。在以上Cd 处理下,分别设置不接种AMF(CK)、接种根内根孢囊霉(Ri)、接种摩西斗管囊霉(Fm)、2种AMF 1∶1混合接种(RF)4个处理,每盆接种菌剂100 g,每个处理5个重复。
选取籽粒饱满的小麦种子于5% H2O2中消毒20 min,用蒸馏水洗净后播种到每个盆中,出苗后控制每盆9 株幼苗,盆随机放置。待小麦长出3 片真叶后,定期补充1/4 Hoagland 营养液以保证营养充足,采用称质量-浇水法维持土壤水分,同时防治病虫害。于2021 年10 月上旬播种,2022 年4 月下旬旗叶完全抽出后采样,并进行各类指标的测定。
1.3 测定项目及方法
1.3.1 光合特性 每盆选择一株长势良好的小麦,测定旗叶的比叶重、叶绿素含量和净光合速率(Net photosynthetic rate,Pn)。比叶重采用打孔称质量法测定。叶绿素含量采用95%乙醇提取,使用分光光度计测定。Pn 使用Li-6400XT 便携式光合作用测定系统测定,测定时间为9:00—11:00。
1.3.2 抗氧化特性 使用试剂盒测定旗叶的抗氧化特性[14]。丙二醛(Malondialdehyde,MDA)含量采用硫代巴比妥酸法测定(Solarbio,BC0025),POD 和CAT 活性采用H2O2还原法测定(Solarbio,BC0095 和BC0205),SOD 活性采用氮蓝四唑法测定(Solarbio,BC0175)。
1.3.3 根际土壤酶活性 选择一株长势良好的小麦,小心将根系挖出后采用“抖根法”收集根际土壤,使用试剂盒测定根际土壤酶活性[15]。其中,土壤蔗糖酶(Sucrase,SC)活性采用3,5-二硝基水杨酸法测定(Solarbio,BC0245),土壤CAT 活性采用H2O2还原法测定(Solarbio,BC0105),土壤脲酶(Urease,UE)活性采用靛酚蓝比色法测定(Solarbio,BC0125),土壤脱氢酶(Dehydrogenase,DHA)活性采用2,3,5-氯化三苯基四氮唑还原法测定(Solarbio,BC0395)。
1.4 数据处理
试验数据采用Excel 2016 进行整理和绘图,采用R 4.1.3软件进行方差分析和多重比较。
2 结果与分析
2.1 Cd胁迫下接种AMF对小麦光合特性的影响
由表1 可知,无论是否接种AMF,小麦比叶重、叶绿素a、叶绿素b 含量及Pn 均随着土壤中Cd 含量的增加呈减小趋势,Cd0 和Cd5 处理间差异不显著。但二者比叶重均显著高于Cd10 和Cd20 处理;叶绿素a、叶绿素b含量及Pn在Cd10和Cd20处理间差异也均不显著,但总体上均显著低于Cd0和Cd5处理。其中,Cd20-CK、Cd20-Ri、Cd20-Fm、Cd20-RF 处理的比叶重、叶绿素a含量、叶绿素b含量和Pn分别较Cd0-CK、Cd0-Ri、Cd0-Fm、Cd0-RF 降低24.40%、19.10%、21.30%、16.59%,23.08%、19.26%、18.09%、12.47%,24.00%、25.19%、22.06%、16.28% 和27.07%、19.45%、19.92%、14.74%。
在相同Cd 含量胁迫条件下,接种AMF 处理比叶重均高于CK,表现为RF>Fm>Ri>CK(表1)。在Cd0 和Cd5 条件下,4 个处理间差异均不显著。在Cd10 和Cd20 条件下,RF、Fm 与CK 差异显著,其中Cd10-RF、Cd20-RF 处理比叶重分别比Cd10-CK、Cd20-CK 提 高12.75%、14.56%;Cd10-Ri 处 理 与Cd10-RF 处理间差异显著。在相同Cd 含量胁迫条件下,接种AMF 处理叶绿素a、叶绿素b 含量及Pn总体上均高于CK,仅Cd10-RF 处理叶绿素b 含量、Pn 差异显著,分别较CK 提高20.41%、17.07%;不同接种AMF 处理间差异均不显著。综上,接种AMF可以改善小麦光合特性,减缓Cd 胁迫对小麦的伤害,以RF处理效果最好。

表1 Cd胁迫下接种AMF对小麦光合特性的影响Tab.1 Effect of AMF on photosynthetic characteristics of wheat under Cd stress
2.2 Cd胁迫下接种AMF对小麦抗氧化特性的影响
由表2 可知,无论是否接种AMF,小麦叶片MDA 含量及CAT、SOD、POD 活性均随着土壤中Cd含量的增加而增加,总体上MDA 含量和CAT 活性表现为不同Cd 处理间差异显著,SOD、POD 活性表现为Cd20 和Cd10 处理显著高于Cd5 和Cd0 处理。其中,Cd20-CK、Cd20-Ri、Cd20-Fm、Cd20-RF 处理小麦叶片MDA 含量、CAT 活性、SOD 活性和POD 活性分别较Cd0-CK、Cd0-Ri、Cd0-Fm、Cd0-RF 处理提高103.81%、65.59%、70.77%、60.63%,66.37%、122.42%、118.75%、120.98%,105.23%、153.46%、145.84%、155.84%和114.49%、141.34%、143.18%、140.21%。
由表2可知,在Cd0条件下,接种AMF处理小麦叶片MDA 含量与CK 差异不显著,且不同接种AMF处理间差异也不显著;在Cd5、Cd10、Cd20 条件下,不同接种AMF 处理间小麦叶片MDA 含量差异不显著,但均显著低于CK,其中Cd20-Ri、Cd20-Fm、Cd20-RF 处理分别较Cd20-CK 降低14.22%、14.54%、17.30%。在Cd0、Cd5 条件下,接种AMF 处理小麦叶片CAT、SOD、POD 活性与CK 差异均不显著,且不同接种AMF 处理间差异也均不显著。在Cd10 条件下,Ri、Fm 处理间小麦叶片CAT、SOD、POD 活性差异不显著,但均显著高于CK。在Cd20条件下,不同接种AMF 处理间小麦叶片CAT、SOD和POD活性差异不显著,但均显著高于CK,Ri、Fm、RF 处理分别较CK 提高33.69%、32.08%、33.42%,22.14%、17.82%、24.54% 和 14.93%、14.48%、14.99%。综上,接种AMF 可以提高小麦抗氧化能力,减缓Cd胁迫对小麦的伤害。
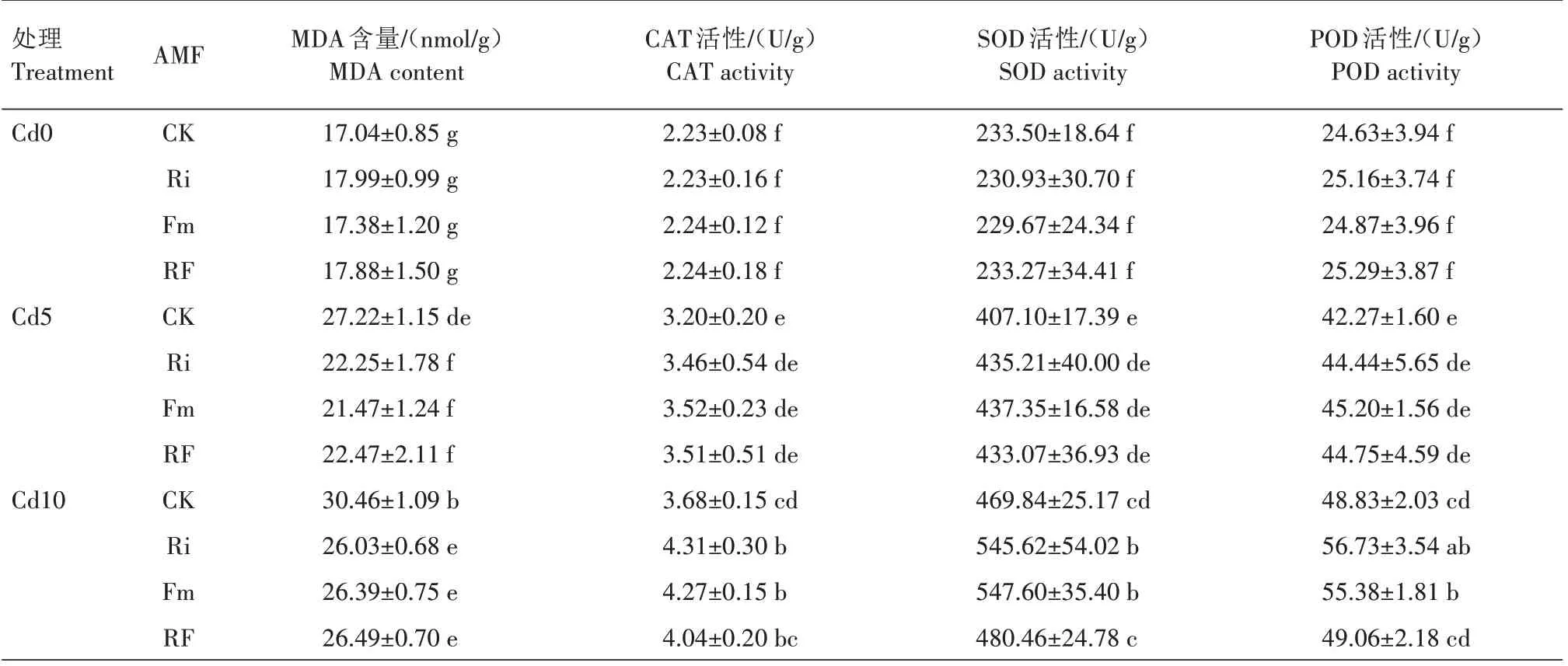
表2 Cd胁迫下接种AMF对小麦抗氧化特性的影响Tab.2 Effect of AMF on antioxidant properties of wheat under Cd stress

续表2 Cd胁迫下接种AMF对小麦抗氧化特性的影响Tab.2(Continued) Effect of AMF on antioxidant properties of wheat under Cd stress
2.3 Cd胁迫下接种AMF对小麦根际土壤酶活性的影响
由表3 可知,小麦根际土壤SC、CAT、UE、DHA活性均随着土壤中Cd 含量的增加而降低。对于CK,Cd0、Cd5、Cd10 处理间SC、CAT 活性差异均不显著,Cd0、Cd5 处理显著高于Cd20 处理;对于接种AMF 处理,Cd0、Cd5 处理间和Cd10、Cd20 处理间SC、CAT 活性差异均不显著,但Cd10、Cd20 处理显著低于Cd0、Cd5 处理。对于CK,Cd5 与Cd10 及Cd10 与Cd20 处理间UE 活性差异不显著,Cd0、Cd5处理显著高于Cd20处理;对于接种AMF处理,Cd0、Cd5、Cd10、Cd20 处理间UE 活性差异显著。对于CK,Cd0、Cd5 处理间DHA 活性差异不显著,Cd10、Cd20 处理间差异也不显著;对于接种AMF 处理,总体上Cd0 处理DHA 活性显著高于Cd5 处理,且两者均显著高于Cd10、Cd20 处理。Cd20-CK、Cd20-Ri、Cd20-Fm、Cd20-RF 处理小麦根际SC、CAT、UE 和DHA 活性分别较Cd0-CK、Cd0-Ri、Cd0-Fm、Cd0-RF 处 理 降 低57.29%、53.96%、55.30%、53.89%,48.74%、49.13%、48.57%、50.73%,57.34%、59.78%、59.13%、60.14% 和 54.55%、44.23%、40.43%、42.00%。

表3 Cd胁迫下接种AMF对小麦根际土壤酶活性的影响Tab.3 Effect of AMF on rhizosphere soil enzyme activities of wheat under Cd stress U/g
由表3 可知,在相同Cd 含量胁迫条件下,接种AMF 处理小麦根际SC、CAT、UE、DHA 活性均高于CK,不同接种AMF 处理间差异不显著。对于SC 活性,Cd0 条 件 下Ri、Fm、RF 处 理 较CK 分 别 提 高168.91%、177.67%、166.28%,Cd5 条件下分别提高192.61%、200.54%、197.84%,Cd10 条件下分别提高193.09%、187.51%、188.63%,Cd20 条件下分别提高189.84%、190.56%、187.48%。对于CAT 活性,Cd0条件下Ri、Fm、RF 处理较CK 分别提高187.81%、176.79%、191.68%,Cd5 条件下分别提高192.99%、179.18%、182.89%,Cd10 条件下分别提高196.57%、202.90%、190.77%,Cd20 条件下分别提高185.66%、177.74%、180.38%。对于UE 活性,Cd0 条件下Ri、Fm、RF 处理较CK 分别提高211.19%、190.91%、210.49%,Cd5 条件下分别提高190.38%、179.81%、191.35%,Cd10 条件下分别提高192.50%、201.25%、193.75%,Cd20 条件下分别提高193.44%、178.69%、190.16%。对于DHA活性,Cd0条件下Ri、Fm、RF处理较CK 分别提高136.36%、113.64%、127.27%,Cd5条件下分别提高152.94%、141.18%、147.06%,Cd10条件下分别提高161.54%、146.15%、161.54%,Cd20条件下分别提高190.00%、180.00%、190.00%。
3 结论与讨论
植物进行光合作用是一个高度自我调节的过程。植物叶片所积累的有机物的量在一定程度上可反映植物光合作用合成同化物的能力。比叶重和叶绿素含量反映了叶片的结构和生理特性,且在一定程度上可以作为环境胁迫下植物光合能力强弱的重要指标[16-17]。研究发现,较高浓度的Cd 污染会造成叶片叶绿素含量降低、叶绿体膨胀和变形、线粒体基粒片层松散、叶鞘细胞叶绿体类囊体解体,从而影响线粒体的电子传递及光合作用[3,18-19]。本研究发现,随着土壤Cd 含量增加,小麦叶片比叶重、叶绿素含量和Pn 等光合指标均明显下降,接种AMF 可以有效缓解下降程度。这可能是由于接种AMF 影响叶片结构,使叶片细胞排列更加紧密,植物叶片厚度、栅栏组织厚度均增加[20]。但在低Cd含量(Cd5)胁迫下,小麦叶片比叶重、叶绿素含量和Pn等光合指标与Cd0 处理差异不显著,说明小麦自身对Cd 具有一定耐受性,此Cd 含量胁迫尚未对小麦光合系统造成影响。另有研究发现,在重金属胁迫下,接种AMF 可显著提高叶片叶绿素含量、增加气孔导度和水分利用效率,进而提高光合能力[21],本研究结果与其部分结果一致。
细胞膜是Cd 毒害植物的重要位点,在Cd 胁迫下,植物器官会产生过多的活性氧,导致植物体内膜脂过氧化作用进程加快,对植物产生毒害[22]。MDA 是膜脂过氧化作用的重要产物,其含量常作为衡量植物受损伤程度的标志。本研究发现,无论是否接种AMF,小麦叶片MDA 含量均随土壤中Cd 含量的增加而增加,但是接种AMF 能显著降低Cd 胁迫下MDA 含量,这与前人[23]研究结果一致,说明在Cd 胁迫下,接种AMF 可以有效缓解Cd 对植物细胞的毒害。
Cd 等重金属进入植物体内会促进活性氧的产生,抗氧化酶能够清除多余的活性氧,恢复细胞稳态[24]。CAT、SOD 和POD 是植物体内重要的抗氧化酶,其活性可以反映植物对逆境的耐受能力。研究发现,接种AMF 可显著提高植物体内抗氧化酶活性,增强植物对重金属的耐受性[25]。本研究发现,小麦叶片CAT、SOD 和POD 活性均随着土壤中Cd 含量的增加而提高,在Cd0 和Cd5 条件下,接种AMF处理小麦叶片CAT、SOD 和POD 活性与CK 差异不显著;在Cd20 条件下,接种AMF 处理小麦叶片CAT、SOD 和POD 活性显著高于CK,这与前人[25]研究结果相似。表明接种AMF 可有效提高小麦在Cd胁迫条件下的抗氧化能力,且在Cd含量较高时作用更显著。
土壤酶活性是评价土壤质量和肥力的重要辅助指标[26],对于遭受重金属污染的土壤,土壤酶活性可反映土壤的健康状况。AMF 可以通过提高根际土壤酶活性,促进植物根系对养分的吸收,进而增强植物对重金属的耐受性[27]。亓琳等[28]研究发现,接种AMF 可显著提高锶污染土壤中磷酸酶和转化酶活性。付晓峰等[29]研究发现,接种AMF 可改善植物根际土壤环境,提高土壤微生物数量和土壤酶活性。本研究发现,小麦根际土壤SC、CAT、UE、DHA活性均随着土壤中Cd 含量的增加而降低,接种AMF 可显著提高土壤SC、CAT、UE、DHA 活性,与前人[28-29]研究结果相似。综上,在重金属胁迫下,AMF可以通过多种机制改善植物根际土壤环境,并缓解重金属对土壤酶活性的抑制作用,从而降低重金属对土壤环境和植物的危害。
本研究所用AMF 均为常见菌种,同一Cd 胁迫下接种不同的AMF,小麦光合能力、膜脂过氧化程度、抗氧化特性和根际土壤酶活性总体上均未出现显著差异,说明所选AMF 真菌缓解Cd 污染的能力相近。但是否存在对重金属污染有特异作用的AMF有待进一步研究和筛选。

