花花柴蜡质合成相关基因KcFAD2的克隆及转基因烟草耐高温性鉴定
曲航飞,许疆维,王彦芹
(塔里木大学生命科学与技术学院,新疆 阿拉尔 843300)
植物表皮蜡质是植物与外界环境直接相接触的一层疏水保护层,在不同的物种之间,植物表皮蜡质的结构和组成均有很大差异,但都具有类似的蜡质合成途径,前人对该途径的研究已经取得了显著的成果。植物表皮蜡质不仅能够调节植物体内的水分应对干旱、高温等非生物胁迫,而且在限制非气孔水分流失方面也一直起着至关重要的作用,其作为植物与病原菌的第一个接触部位,是植物的物理屏障,不仅能够限制病原菌的入侵,而且在植物抗细菌、真菌和昆虫病害中发挥了多重作用,因此植物表皮蜡质对植物的生长和发育起着重要的作用。
脂肪酸去饱和酶(FAD)是一种能够催化脂肪酸链特定位置使其形成双键,以此来产生不饱和脂肪酸的酶类[1]。不饱和脂肪酸根据双键个数的不同分为单不饱和脂肪酸和多不饱和脂肪酸[2]。根据双键的位置及其功能的不同,又可以将多不饱和脂肪酸分为ω-6系列和ω-3系列[3]。不饱和脂肪酸是植物膜脂的主要结构成分,在大多数植物中其含量可达到75%以上[4]。从橄榄(Olea europaea cv.)中分离到3个编码微粒体油酸脱氢酶FAD2的cDNA序列,序列分析和相应cDNA在酵母中的功能表达证实它们编码微粒体油酸脱饱和酶。基因表达和脂类分析表明,OeFAD2基因家族成员在亚油酸生物合成方面具有特殊的生理作用,既存在于构成橄榄油的贮藏脂质中,也存在于参与响应非生物胁迫的膜脂中[5]。FAD2基因在植物的不同组织中表达不同,FAD2的过表达修饰了生理和营养特性。由于FAD2的活性导致二烯脂肪酸的含量增加,二烯脂肪酸含量的增加可以提高植物抗寒冷和盐胁迫的能力,所以针对FAD2基因的研究对于提高植物抗逆性具有重要意义。
花花柴(Karelinia caspia),是菊科花花柴属多年生草本植物,在国内外分布广泛,多生于干旱、半干旱地区的河谷冲积平原及沙质草甸盐土地[6]。花花柴作为重要的防风固沙植物,具有耐盐碱、耐干旱、耐高温以及耐沙埋等生理特性,是一种改善荒漠地区生态平衡的重要植物[7]。
本试验通过对常温-高温处理下的花花柴叶片进行转录组分析及测序,从而挖掘花花柴耐高温相关基因及生物学路径,从基因转录水平揭示花花柴响应高温胁迫的分子机制[8],为耐高温分子育种提供基因资源理论和参考依据。并通过将花花柴外源基因KcFAD2转入烟草,对转基因材料进行生理指标等测定,以进行其抗逆性的相关验证。
1 材料和方法
1.1 试验材料
新鲜花花柴采自于塔里木大学校园内人工绿地(40°36′N,80°57′E),烟草种子‘K326’、大肠杆菌TOP10、根癌农杆菌GV3101、超表达载体pK2GW 7.0以及用于亚细胞定位实验的载体pGWB406、辅助质粒p19和核、膜Marker菌液等均由华中农业大学作物遗传改良国家重点实验室赠送。
1.2 花花柴蜡质合成相关基因的筛选
通过实验室前期常温-高温比较转录组测序,得到有注释的差异表达基因13 593个(差异表达倍数>2),通过选取与花花柴耐高温能力关系密切的角质、软木脂和蜡质生物合成路径的差异表达基因Kc-FAD2,Oleoyl-CoA在KcFAD2的催化下参与生成Linoleoyl-CoA。
1.3 花花柴蜡质合成相关基因KcFAD2的亚细胞定位实验
KcFAD2的引物序列如表1所示,将PCR产物通过BP-LR反应连接到pGWB406载体上,该载体在35S启动子后N端含有EGFP蛋白。电转得到含有目的基因的农杆菌GV3101菌液,然后按照基因菌液∶Marker∶P19为2∶1∶1的比例混合,注射进1月龄的本氏烟草叶片背面,不同样品各做3次重复,暗培养24 h后见光培养48 h,使用FV1200激光共聚焦显微镜(Heidelberg公司)进行观察。

表1 KcFAD2引物序列
1.4 植物表达载体构建及烟草遗传转化
设计BPLR反应引物,用TA克隆质粒作为模板进行PCR反应并做胶回收。利用BP反应试剂盒根据同源重组的原理将KcFAD2构建到中间载体Pdoner221上,通过转化大肠杆菌TOP10,筛选阳性菌落并提取重组质粒。将上述BP反应的重组质粒利用LR反应试剂盒通过同源重组的原理构建到植物表达载体pK2GW7上,并转化至大肠杆菌TOP10中,筛选阳性菌落后,提取质粒pK2GW7-KcFAD2。利用电转化法将质粒pK2GW7-KcFAD2转化至农杆菌GV3101中,筛选阳性菌落后扩大培养,用于后续进行农杆菌介导的烟草遗传转化实验[9-10]。
1.5 转基因烟草鉴定
使用CTAB法提取转基因烟草的基因组DNA,以基因组DNA作为模板进行花花柴KcFAD2基因的阳性检测PCR,以野生型烟草K326基因组DNA作为阴性对照,将含有GV3101-KcFAD2质粒的农杆菌作为阳性对照,用琼脂糖凝胶电脉法进行检测。T0代具体的检测方法参考陈骆等[11]研究方法。
1.6 转基因烟草表达量检测
按照天根公司试剂盒说明书(RNA Easy Fast,TIANGEN公司)提取转基因烟草幼嫩叶片的RNA,按试剂盒(cDNA反转录试剂盒,Novoprotein公司)说明书配置体系放入反转录仪中,得到烟草cDNA,以提取出的转基因烟草样品的cDNA为模板,稀释100倍用作Real-Time模板,烟草HSC70-1为内参基因[12],设计KcFAD2的 Real-Time PCR 引物(表1),所有处理4次重复,配置20 μL体系,用实时荧光定量PCR仪(Applied Biosystems公司)进行扩增,检测基因的表达量。将结果导入Microsft Office Excel 2016软件中,用POWER函数对CT值进行数据分析,函数为:POWER(number,power),其中参数number表示底数;参数power表示指数,计算公式使用2-△△Ct法,得到转基因烟草表达量数据。
1.7 转基因植株高温胁迫及脯氨酸和可溶性糖含量测定
将9周龄的转基因烟草和阴性对照在42℃的培养箱中进行高温胁迫处理,做5次生物学重复,期间保持湿度。10 h后取样拍照,植物可溶性糖用试剂盒(Plant Soluble Sugar Content Assay Kit,boxbio公司)提取。脯氨酸含量用试剂盒(Proline Content Assay Kit,Boxbio公司)提取,分别将提取后的溶液点于酶标板,置于多功能酶标仪(Enspire公司)上检测,记录数据,得到转基因植株脯氨酸和可溶性糖含量数据图。
1.8 转基因植株高温胁迫后蜡质含量的测定
将9周龄的转基因烟草裁剪成1 g的叶片,先用天平称出质量,再用20 mL三氯甲烷溶液漂洗20 s,将所得溶液过滤到已知质量的培养皿中,可得到蜡质质量与叶片质量的比值即为蜡质含量,重复3次取平均值,同样的方式得到高温处理后叶片的蜡质含量[13]。
1.9 数据分析
使用 Microsoft Office Excel 2016、Microsoft Office Word、IBM SPSS Statistics 23及 Adobe Photoshop 2021软件进行图片制作与数据处理。
2 结果与分析
2.1 KcFAD2基因的克隆与序列分析
通过RT-PCR技术克隆花花柴KcFAD2基因的CDS全长序列,分析结果表明其编码384个氨基酸,与NCBI数据库中多种植物的FAD2均具有较高的同源性,与向日葵(Helianthusannuus)的相似性最高,达90.86%,同时因为花花柴简称为Kc,因此命名为Kc-FAD2,基因的登录号为MW528401。
2.2 KcFAD2基因的亚细胞定位结果
如图1所示,通过亚细胞定位结果分析可知,绿色荧光主要存在于细胞膜上,其他部位并未出现绿色荧光,且能够与膜Marker(CBL1:RFP)的红色荧光发生共定位,表明该基因的表达产物定位在细胞膜上,为膜定位蛋白。

图1 KcFAD2的亚细胞定位分析
2.3 KcFAD2转基因烟草的转化及鉴定
通过遗传转化试验共获得KcFAD2阳性转基因烟草10株,基因组DNA阳检结果显示如图2A。Kc-FAD2基因在阳性转基因烟草中的表达量如图2B所示,转基因烟草的遗传转化过程如图2C所示,选取表达量较高的阳性植株进行后续抗性鉴定。

图2 KcFAD2转基因烟草的转化及鉴定
2.4 KcFAD2转基因烟草耐高温性鉴定
由于KcFAD2基因是从花花柴高温胁迫后的转录组中筛选出的上调表达基因,故本研究对该基因的耐高温性进行了研究。42℃高温处理前转基因烟草如图3A所示,42℃高温处理10 h后转基因烟草如图3B所示,WT烟草处理后呈明显萎蔫状态,而转入KcFAD2基因的烟草无明显改变,恢复正常温度后长势良好。

图3 KcFAD2转基因烟草和WT转基因烟草高温处理前后对比
图4是对高温胁迫下的野生型和KcFAD2转基因烟草的脯氨酸含量、可溶性糖含量等生化指标测定。分析可知,在42℃高温处理10 h后,转基因烟草 K6-5、K6-6、K6-8、K6-10、K6-12脯氨酸含量显著高K6-WT烟草(图4A);转基因烟草K6-5、K6-6、K6-8、K6-10、K6-12可溶性糖含量显著高于K6-WT烟草(图4B)。结果表明,转KcFAD2基因烟草在高温胁迫后,能积累更多的可溶性糖和更多的脯氨酸。

图4 转基因烟草42℃处理10 h后脯氨酸含量和可溶性糖含量变化分析
2.5 KcFAD2转基因烟草高温处理前后蜡质含量测定结果
如图5所示,在42℃高温处理10 h后,KcFAD2转基因烟草的蜡质含量均有提升,其中K6-5、K6-6、K6-8、K6-10、K6-12在高温处理后蜡质含量显著上升,这可能与高温促进了蜡质合成相关基因KcFAD2编码蛋白合成有关,进而提高了烟草叶片的蜡质含量。
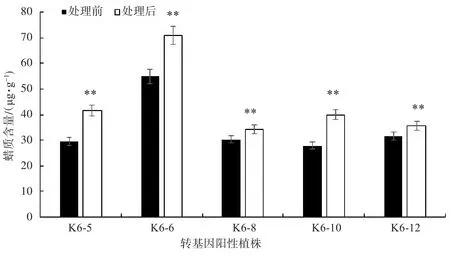
图5 转基因烟草在42℃处理10 h后蜡质含量的变化
3 讨论
全球气候变暖会加剧气候事件的严重程度,高温作为非生物胁迫严重影响我国作物生产[14],因此提高作物的耐高温性显得尤为重要。花花柴作为荒漠植物,具有良好的耐高温、抗干旱的优点,其中表皮蜡质发挥了重要的作用,表皮蜡质不仅具有防止外力损伤的作用,还可以抵抗外界胁迫。蜡质在植物抗细菌、真菌和昆虫病害中也发挥了多重作用[15]。因此本试验以克隆花花柴蜡质合成相关基因作为外源基因,构建超表达载体利用农杆菌介导法转入植物体内进行遗传转化,以期改善作物应对逆境胁迫的能力。
FAD2基因在植物的不同组织中表达不同,FAD2的过表达不仅修饰了生理和营养特性,其活性也导致二烯脂肪酸的含量增加,因此增加了抗寒冷和盐胁迫的能力[16],所以针对FAD2的研究对于提高植物抗逆性有重要意义。由于本研究的基因KcFAD2是从花花柴常温-高温对比的RNA-seq数据中筛选出的差异表达基因,故选取的处理方式是高温胁迫处理,42℃高温胁迫处理10 h后的KcFAD2转基因烟草在植株外在表观、可溶性糖含量、脯氨酸含量的表现均优于阴性对照WT烟草。综合来看,糖类物质是构成植物体重要组成成分之一,不仅是新陈代谢的主要原料和贮存物质,也可作为转移介质、功能分子和调节因子等调控植物的生长和发育[17],结果表明Kc-FAD2基因上调表达可以促进可溶性糖含量的提升;脯氨酸在稳定生物大分子结构、降低细胞酸性、解除氨毒、调节细胞氧化还原势以及提高植物的抗逆性等方面起重要作用[18],从测得的数据分析可知Kc-FAD2转基因表达量高的植株脯氨酸含量也高。在KcFAD2转基因材料中,发现表达量最高的株系K6-6的脯氨酸含量以及可溶性糖含量均高于其他阳性植株,因此推测KcFAD2转基因材料面对高温胁迫能力的提升与脯氨酸含量提高和可溶性糖含量上升有关。同时在李铭杨等[19]研究大豆GmGolS1基因转化烟草的试验中也存在表达量高的植株抗逆表现高于表达量低的植株的现象,因此推测转基因烟草对高温胁迫能力与KcFAD2基因的表达量呈正相关的趋势。蜡质在植物非生物和生物胁迫耐受中起着重要作用,并且与过度紫外线辐射、高温、细菌和真菌病原体、昆虫、高盐度和低温的防御机制有关[20]。本试验也对高温处理前后的转基因烟草进行了蜡质含量的检测,发现蜡质含量在处理后普遍上升,由于在花花柴高温表达谱中KcFAD2基因一直为上调表达,推测高温促进了蜡质合成相关基因KcFAD2编码蛋白的合成,进而导致叶片蜡质含量的上升。
4 结论
本研究结果表明,KcFAD2可以提高烟草抵抗高温胁迫的能力,并且抵抗高温胁迫的能力与基因的表达量为正相关,表达量越高,抵抗高温胁迫的能力越强,同时可以促进叶片蜡质含量的升高。但由于转基因植株在抗逆鉴定中表现出来的抗逆性仅为初步的研究结果,所以还需要在后代中做进一步的抗逆鉴定。

