纳米锰暴露对大鼠神经毒性及脉络丛相关基因转录水平的影响
许明颜,孟睿,郝卓璐,2,马心怡,吴静雯,崔梦祥,孟春燕,*,韩铁生,#
1.华北理工大学公共卫生学院,唐山 063210
2.南京医科大学公共卫生学院,南京 211166
纳米二氧化锰(nano-MnO2)不仅具有良好的电化学性能和氧化还原性,还拥有纳米级结构,其作为药物载体的应用更是被人们广泛关注[1]。实际生活中钢铸件和干电池行业是工人接触nano-MnO2的两大行业[2],此外焊接烟雾通常含有锰金属和氧化锰颗粒,焊工暴露风险较高[3]。随着纳米技术的发展,人们与纳米物质接触的机会增多,接触环境中的纳米材料可能会导致严重的毒性效应。纳米材料体积小、表面积大,可通过不同的途径进入人体,跨越生物膜进入细胞,对相应的器官和组织产生靶效应。潘洋和张鑫源研究发现,纳米颗粒可进入大脑产生神经毒性作用[4]。
脉络丛是构成血脑脊液屏障的组织基础,不仅能分泌脑脊液,还可将血液中过量的有毒物质蓄积在组织内,从而保护大脑[5]。但脉络丛的蓄积能力有一定限度,当进入机体的有毒物质蓄积过量时,会导致脉络丛的结构变化,进而破坏血脑脊液的屏障功能[6]。为探讨nano-MnO2对脉络丛的损伤机制,本实验通过建立nano-MnO2暴露动物模型,观察大鼠神经行为学变化,检测大鼠神经损伤及脉络丛损伤情况,研究暴露前后大鼠脉络丛相关基因表达的变化,为nano-MnO2的安全评价提供参考依据。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 实验动物
18只雄性SD大鼠(无特定病原体级),体质量为180~220 g,订购并饲养于华北理工大学实验动物中心。
1.1.2 实验试剂与仪器
nano-MnO2,纯度高达99.9%,平均粒径50 nm,比表面积30 m2·g-1,暗棕色,球形,体积密度0.35 g·cm-3,购自北京德科岛金科技有限公司(图1)。使用时配制nano-MnO2悬浊液,前期用无菌生理盐水配制成80 mg·mL-1的浓度,后期随着大鼠体质量增加,配制100 mg·mL-1浓度。使用时超声混匀,按具体体质量确定灌注体积。4%多聚甲醛溶液和10%水合氯醛均购自索莱宝公司。YLS-6B智能热板仪购自北京众实迪创科技发展有限责任公司,BX41-32H02光学显微镜购自日本OLYMPUS公司。

图1 纳米二氧化锰(nano-MnO2)SEM图Fig. 1 The SEM photographs of manganese dioxide nanomaterial (nano-MnO2)
1.2 实验方法
1.2.1 染毒方法
SD大鼠共18只,随机分成3组,构成对照组、低剂量染毒组和高剂量染毒组。实验采用无创伤气管内注入法进行染毒。异氟烷麻醉大鼠后,提上颚,使大鼠身体僵直,轻轻夹出鼠舌固定,在大鼠口腔中放入窥耳镜,暴露声门,插入钝头灌注器进行注入。低剂量组染毒剂量为200 mg·kg-1(以体质量计),高剂量组为400 mg·kg-1,对照组每只灌注等量生理盐水。每周染毒1次,连续染毒12周。
1.2.2 神经行为检测
染毒结束分别将各组大鼠进行神经行为测试,即大鼠旷场实验和热板仪实验。将具有25个箱底方格的无顶木箱(100 cm×100 cm×30 cm)作为旷场,将大鼠置于中央方格内,观察并记录大鼠5 min内在中央格的停留时间、跨越方格的次数和站立次数。观察时尽量保持周围环境安静,每只大鼠记录结束后清理旷场箱底部。热板仪预热并恒定在55 ℃,将3组大鼠依次放于板上,每只重复3次且间隔30 min以上,观察并记录每次每只大鼠从进入至第一次舔后足的时间,根据热痛反应时间的变化判断大鼠的感觉神经功能。
1.2.3 样品的制备和形态学观察
参考马海阳[7]的方法,首先选用10%水合氯醛对大鼠进行麻醉,用4%多聚甲醛溶液进行灌注,待大鼠身体开始僵硬时将其断头,立即分离SD大鼠脉络丛及各部分脑组织。用4%多聚甲醛溶液对大鼠脉络丛组织固定,制片后HE染色观察病理学变化;取脑组织固定于为2.5%的戊二醛中,进行电镜样品制备和观察。
1.2.4 转录组分析
根据样品保存情况,共收集3组动物8个样本送检,其中对照组2个样本,低、高剂量组各3各样本。采用illumina Hiseq测序平台对样本进行高通量测序,利用Fast QC软件对预处理数据进行质量控制,统计Q30的碱基比例。
1.2.5 统计学分析
2 结果(Results)
2.1 大鼠行为学测试结果
旷场实验结果显示,低剂量、高剂量染毒组大鼠与对照组相比,中央格停留时间延长(P<0.05);与对照组相比,高剂量组的大鼠跨格次数减少(P<0.05),低剂量组和高剂量组站立次数显著增多(P<0.05),其余各组间比较差异无统计学意义(P>0.05)。热板仪实验结果显示,与对照组相比,低剂量组、高剂量组热痛反应时间变长,其中高剂量组与对照组比较差异有统计学意义(P<0.05),染毒浓度越高,大鼠热痛反应时间越长(表1)。
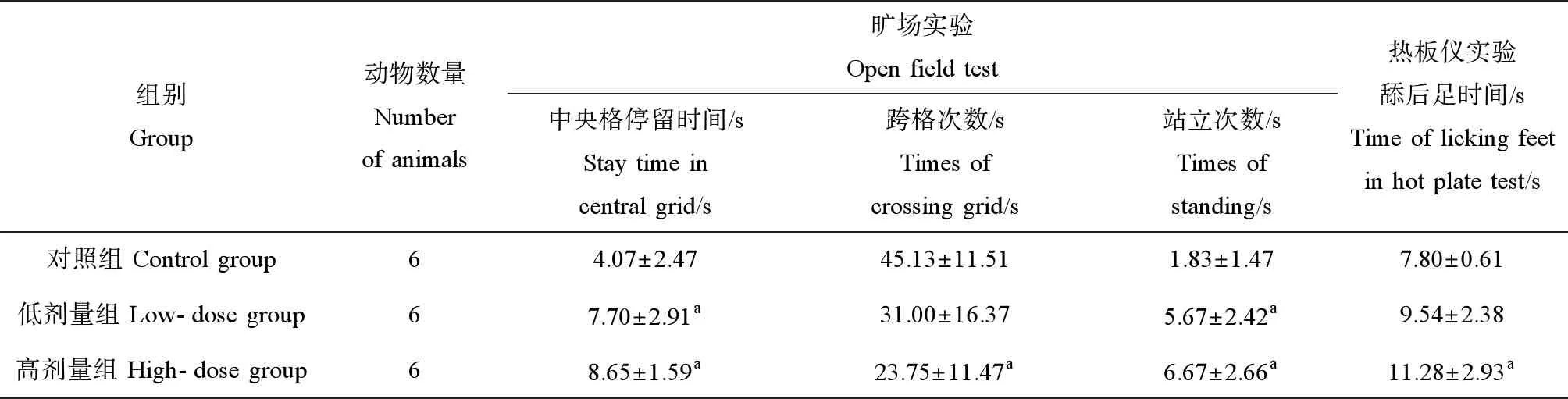
表1 nano-MnO2暴露后大鼠神经行为学测试结果Table 1 Results of neurobehavioral test in rats treated with nano-MnO2
2.2 脉络丛HE染色结果
正常大鼠的脉络丛上皮细胞排列紧密整齐,细胞核大而圆,位于细胞基底部,如图2(a)所示。经nano-MnO2染毒后,低剂量组大鼠部分脉络丛上皮细胞出现细胞质染色变浅,细胞边缘不清晰,细胞之间界限开始变得模糊,有空泡出现,如图2(b)所示。高剂量组大鼠脉络丛上皮细胞排列紊乱,细胞出现不同程度的变形且空泡化现象明显,多数细胞以及细胞核出现严重萎缩及溶解,如图2(c)所示。随着染毒浓度升高,细胞轮廓模糊且变形加重,细胞连接间隙变宽,细胞内空泡明显增多。
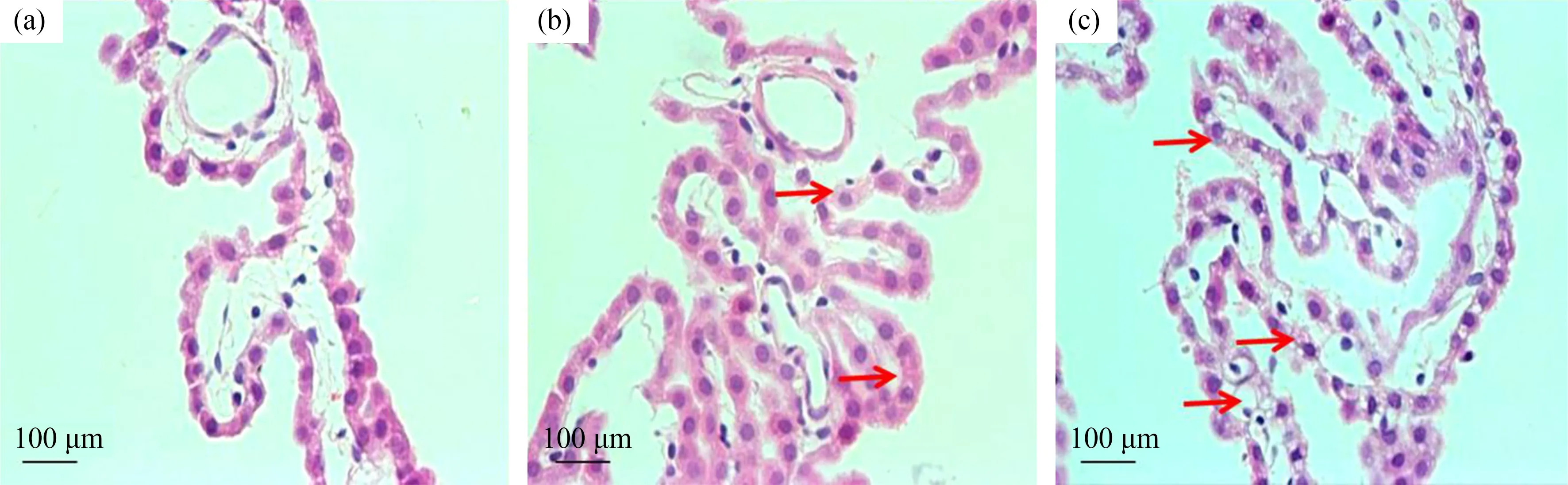
图2 脉络丛上皮细胞HE染色结果(HE染色,400×)注:(a) 对照组;(b) 低剂量组;(c) 高剂量组。Fig.2 HE staining results of choroid plexus epithelial cells (HE staining,400×)Note:(a) Control group;(b) Low-dose group;(c) High-dose group.
2.3 脑皮质电镜观察结果
电镜结果显示,经nano-MnO2染毒后大鼠脑皮质中线粒体形态异常,线粒体肿胀,且有大量空泡出现(图3(c));正常髓鞘结构完整,处理组髓鞘有较大面积的染色变浅,出现分层,染色质边集(图3(b)和3(c))。
2.4 高通量测序分析结果
取对照组、低剂量组和高剂量组共8个样本进行高通量测序。8个cDNA文库共产生8.67亿个原始序列数,进行质量控制后(表2),从原始读数中获得8.53亿个过滤后序列,Q30平均碱基质量为95.04%,说明测序数据质量较高。
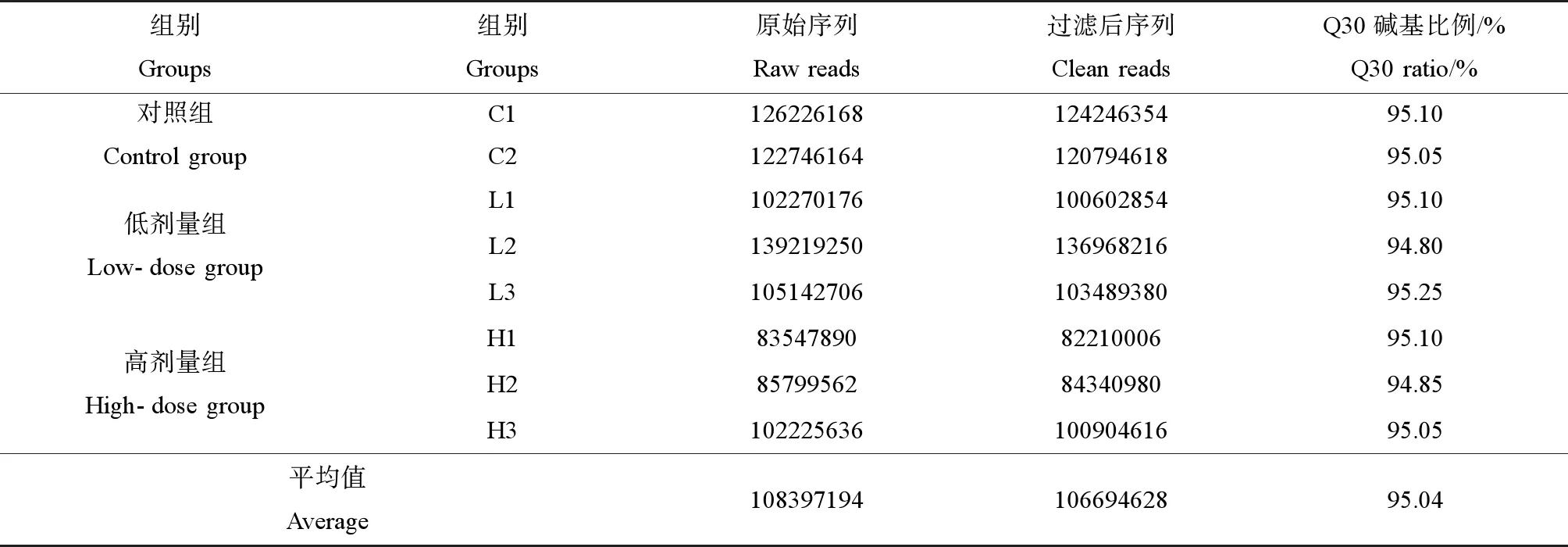
表2 原始序列和预处理序列的统计结果Table 2 Statistical results of original sequence and preprocessed sequence
2.4.1 差异基因筛选
如图4(a)所示,主成分分析图显示一个高剂量组与其他组基因存在差异。针对样本组间筛选的差异表达基因进行聚类,图4(b)中颜色的深浅表示不同样本基因的表达量高低,可以明显看出高剂量组与其他组别相比差异性较大。为此,选取对照组和高剂量组进行分析。

图4 差异表达基因筛选情况注:(a) 主成分分析图;(b) 差异基因表达聚类。Fig.4 Screening of differentially expressed genesNote:(a) Principal component analysis diagram;(b) Differential gene expression clustering.
2.4.2 GO功能富集
对照组与高剂量组筛选到差异表达基因4 056个。差异表达的基因在生物过程、细胞组分以及分子功能3个大功能类均有富集,在生物过程功能类中,差异基因主要富集到的低层级GO Term为神经系统过程调节相关基因;分子功能中的差异基因主要富集在转运活性类别中,富集到的低层级GO Term为离子门控通道活性(148,上调141)、离子通道活性(180,上调169)和金属离子跨膜转运活性(165,上调147);细胞组分中差异基因富集最多的GO功能是突触。
分子功能类别中,显著表达的基因如表3所示,有关金属离子跨膜转运的钙、钾电压门控通道等相关基因显著上调表达,提示可能影响膜通道活性进而破坏细胞。显著表达的差异基因Slc17a7属于溶质转运蛋白(solute carrier,SLC)家族中的囊泡膜谷氨酸转运蛋白家族,与突触囊泡膜和谷氨酸转运功能有关[8]。

表3 分子功能类别低层级GO Term显著表达基因Table 3 Significant expression genes of low-level GO Term in molecular functional categories
2.4.3 KEGG Pathway富集分析
差异基因共富集到64条主要代谢通路上,其中信号传导和神经系统2个功能分类富集差异基因最多。信号传导途径差异基因富集情况如表4所示。
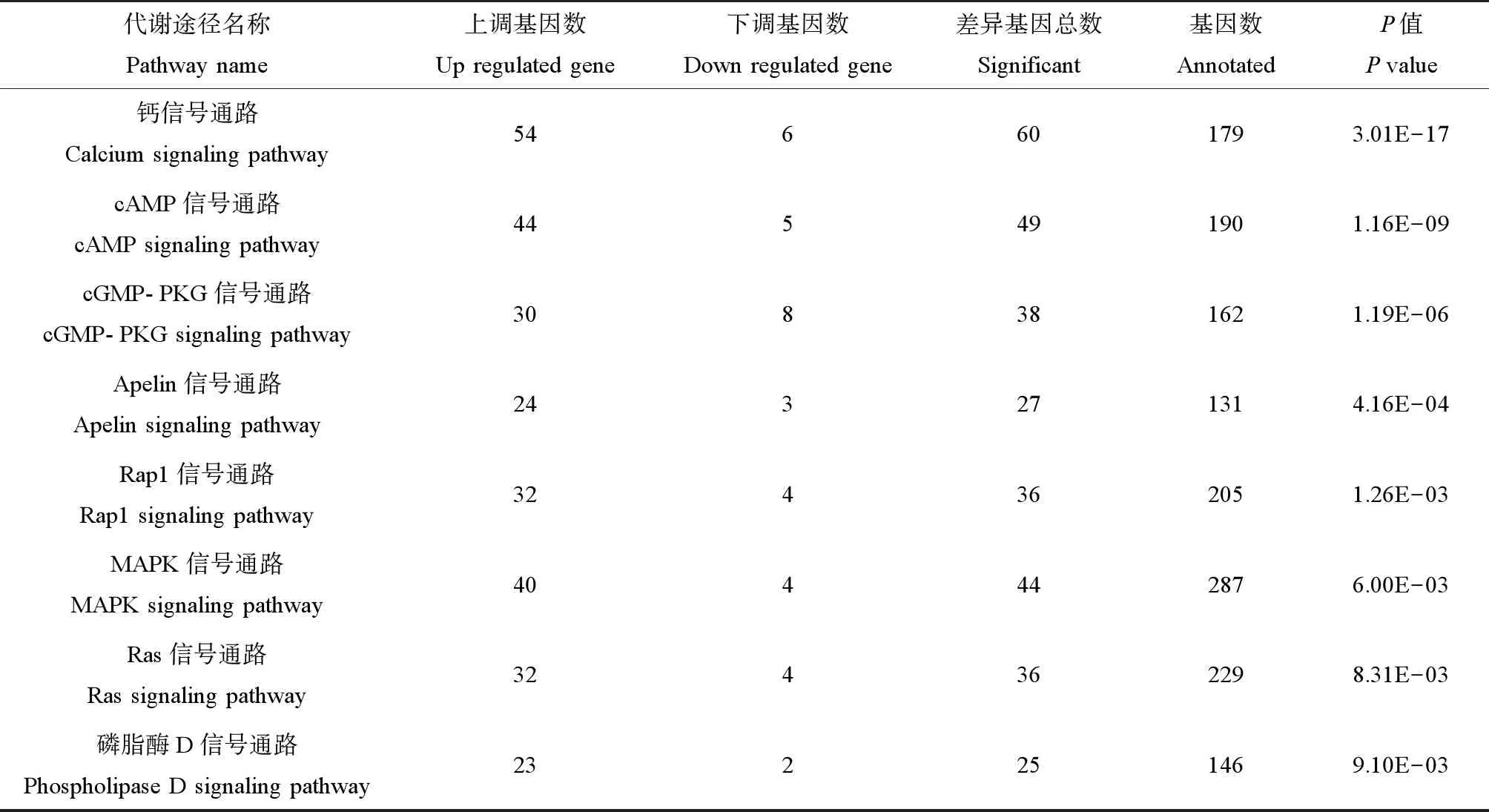
表4 信号传导途径差异基因富集分析Table 4 Differential gene enrichment analysis of signal transduction pathway
按显著性排名前五的Pathway如表5所示,分别是神经活动配体-受体相互作用、吗啡成瘾、谷氨酸能突触、钙信号通路和胆碱能突触。在差异上调基因中编码代谢型谷氨酸受体的Grm系列基因显著表达。
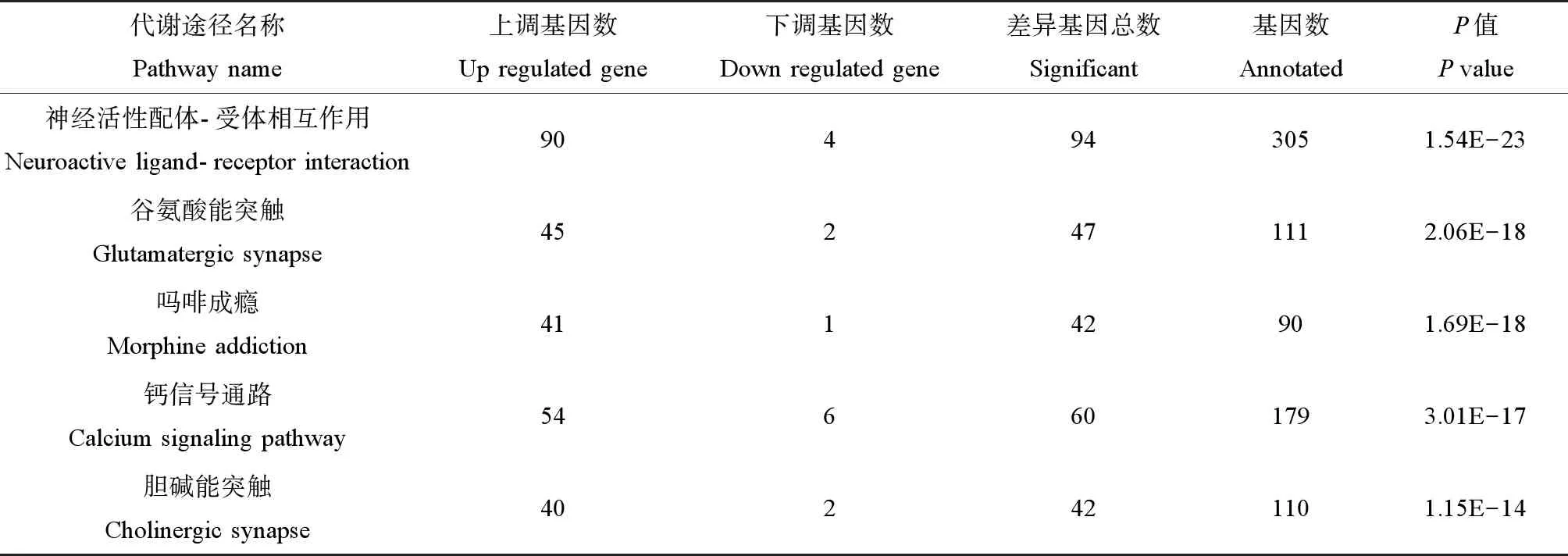
表5 差异基因KEGG代谢途径富集分析Table 5 Enrichment analysis of differential gene KEGG metabolic pathway
3 讨论(Discussion)
诸多体内外实验证实nano-MnO2具有细胞毒性[9-10],然而也有研究显示纳米锰的氧化物具有一定的细胞保护作用[11],且不同剂量显示出的作用也不尽相同[12-14]。有研究应用5.26 mg·kg-1(以体质量计)的nano-MnO2气管滴注可看到大鼠神经损伤[12],500 mg·kg-1和1 000 mg·kg-1(以体质量计)经口毒性实验可观察到大鼠多器官损伤、DNA损伤等[13],另一项研究则认为35 mg·kg-1的nano-MnO2静脉注射对小鼠并没有明显毒性作用[14]。以往的研究在nano-MnO2染毒浓度和染毒方式方面存在很大差异,为观察到明显的毒性作用,本研究选择的高浓度为400 mg·kg-1,低剂量为200 mg·kg-1,本研究结果显示低剂量组对大鼠的损伤作用不如高剂量组明显。
以往的研究显示nano-MnO2可以穿过血脑屏障并在脑内蓄积[12,15],而关于纳米锰进入大脑的确切机制目前尚无定论。腹腔注射MnCl2后,锰可以穿过血脑脊液屏障,对大鼠空间学习记忆功能产生影响[16]。有研究显示纳米材料可以直接进入细胞内,并在溶酶体中聚集[17]。而锰离子可以从纳米材料表面溶解,不溶性的纳米粒子作为离子载体,使锰离子能够进入细胞[18],细胞内的酸性环境更促进了溶解过程[19]。热板仪实验显示染毒后大鼠热痛反应时间延长,表明大鼠感觉神经功能损伤。大鼠疼痛调节功能的改变与中枢神经系统中锰水平的变化对多巴胺能系统的影响有关[20]。旷场实验反映大鼠的焦虑样行为减少,空间识别能力降低,兴奋性相对减弱。同样,大脑皮质线粒体形态异常,髓鞘发生变化,提示锰对大鼠脑组织产生了损伤作用。脉络丛可调节血液和脑脊液之间各种物质的交换,包括重金属、小分子物质以及多种肽类[21],其参与大脑的解毒过程、神经免疫作用,以及调节神经体液等。脉络丛的调节功能可保护大脑免受各种潜在的毒理学风险,同时也在维护血-脑脊液之间各种物质生理和药理学分布方面起重要作用。因此,脉络丛对周围异常信号反应灵敏,以维持其物质转运及各种调节功能的稳态[22]。形态学结果显示脉络丛上皮细胞结构异常,且随着nano-MnO2浓度增加,细胞受损情况加重,出现细胞胞膜和核仁不清晰,胞核浓缩、溶解,细胞内出现空泡,线粒体结构破坏,细胞紧密连接部分出现断裂(图2),这与纳米硫化铅对脉络丛的损伤作用类似[23],提示锰可以直接损害脉络丛的结构基础。
王璨[24]的研究表明,锰可以使脑中的谷氨酸(Glu)代谢紊乱,Glu作为一种兴奋性神经递质,其增多会引起兴奋性毒作用。徐斌[25]的研究显示锰含量增加,Glu的含量随之增加。本研究显示,高剂量nano-MnO2染毒后,编码代谢型谷氨酸受体的Grm系列基因表达显著上调,关于Glu转运的蛋白表达显著上调(表3),锰很可能破坏了Glu的代谢平衡,Glu含量增多后,持续地激活Glu受体,胞浆中Ca2+浓度增高,细胞外K+增加,引起神经元过度兴奋,影响其正常功能,引起大量H2O和Na+进入细胞使其肿胀,引起离子渗透压改变,造成渗透性损伤[26],这可能是脉络丛上皮细胞出现空泡化的原因之一。GO功能分子功能类别中有关金属离子跨膜转运的钙、钾电压门控通道等相关基因显著表达,提示锰可能影响了脉络丛对微量元素转运功能,有些金属离子如铅暴露可以导致脉络丛上皮细胞对微量元素转运功能的紊乱[27]。
本研究表明nano-MnO2高剂量暴露下,大鼠的神经行为学出现异常改变,空间探究能力下降、感觉功能受损,提示纳米锰产生了神经毒性。锰可使编码代谢型谷氨酸受体的Grm系列基因表达上调,并影响脉络丛的转运活性。纳米锰可经脉络丛进入大脑,引起脉络丛上皮细胞受损,使细胞肿胀,破坏脉络丛上皮细胞的正常功能,从而使锰更容易进入脑内造成进一步的损伤。

