双酚芴对斑马鱼神经行为的影响及毒性作用机制
张鹏宇,王宝堃,刘可春,靳梦,*
1.齐鲁工业大学(山东省科学院)生物研究所山东省科学院药物筛选技术重点实验室,济南 250103
2.华北理工大学心理与精神卫生学院,唐山 063200
双酚芴(9,9-bis(4-hydroxyphenyl)fluorine,BHPF)是双酚A(BPA)的替代物之一,现已广泛用于塑料产品的生产。因为BHPF能够较好地替代BPA,所以常用在与食物接触的材料或容器中,包括饮水瓶、奶瓶和婴儿水瓶等[1-2]。2018年加拿大联邦水质指南将BPA水中安全浓度规定为3 500 ng·L-1[3]。研究发现,加拿大淡水样本的BPA浓度范围为3.05~1 888.51 ng·L-1,五大湖流域中BPA含量最高的3个流域中,其浓度分别为309.4、217.6和184.2 ng·L-1。另有研究发现[4],慢性低剂量BPA(50 ng·L-1和500 ng·L-1)暴露能够影响斑马鱼对复杂环境的适应能力。考虑到BHPF在食品容器加工中的广泛应用,特别是儿童用品,因此人们格外关注其对环境和健康的潜在影响。在长期使用BHPF饮料瓶的饮水人群血清中检测到了BHPF,说明BHPF可以从塑料瓶释放到饮用水中从而进入人和动物体内。此外,Zhang等[5]研究发现,即使在BPA无毒剂量下,BHPF仍可以干扰内分泌,在小鼠体内产生抗雌激素效应。以上研究表明,BHPF可以进入动物和人体内,对生物体健康产生潜在影响,并且BHPF可能具有强于BPA的毒性效应。Jiao等[1]研究发现,BHPF能够抑制小鼠和猪卵母细胞减数分裂进程,造成卵母细胞内纺锤体组装异常、微丝构建紊乱、线粒体功能异常、能量水平下降、过氧化物水平升高和早期凋亡发生等。另外还发现BHPF可以通过改变卵母细胞内组蛋白修饰水平和皮质颗粒分布影响卵母细胞质量。
近些年,随着我国经济的不断发展,水环境污染问题日趋严重。环境中各种污染物在水体中的积累不仅会对水生生物的生存构成威胁,同时也会对人类的健康造成直接或间接的影响[6]。诸多研究表明[7],环境污染物可以对生物体的行为以及神经系统造成不同程度的影响。斑马鱼因其体型小、繁殖快、胚胎透明和对水环境的变化十分敏感等特点,被广泛用于水体环境中污染物毒性的检测。还因其具有与人类神经系统高度相似的中枢神经系统功能[8],而被广泛应用于神经发育和神经毒性研究。在神经发育方面,斑马鱼发育至第5天就能够自主运动,便于对其行为活动进行实时监测,这一优势是其他脊椎动物不能替代的。值得注意的是,斑马鱼对于毒性的敏感性在一定程度上高于哺乳动物,表明斑马鱼对于检测一些低毒或者毒性表现不明显的物质具有重要意义[9]。本课题组前期基于斑马鱼模型的研究发现[10],BHPF对下丘脑-垂体-甲状腺轴产生毒物兴奋效应,破坏髓鞘形成。在此基础上,本论文以斑马鱼成鱼为模型,开展黑白箱测试、新型水槽测试和T迷宫测试并对神经发育、自噬和凋亡相关基因进行检测,探究BHPF的神经毒性和作用机制。
1 材料与方法(Materials and methods)
1.1 材料
1.1.1 试剂
RNA试剂盒(RN2802,北京艾德莱生物科技有限公司);反转录试剂盒(近岸蛋白质科技有限公司);荧光定量PCR试剂盒(RR036A、RR091A TaKaRa公司)。
1.1.2 仪器
斑马鱼养殖系统(Z-A-S5,上海海圣公司);Zebrabox斑马鱼行为分析仪(Viewpoint公司);实时荧光定量PCR仪器(13720,罗氏诊断产品有限公司);C1000 Touch梯度PCR仪(伯乐生命医学产品有限公司);超微量分光光度计(NDoneC,基因有限公司)。
1.1.3 动物
野生型成年斑马鱼AB由山东省科学院生物研究所提供,将斑马鱼养殖在水温28℃的系统中进行培养,每天给予14 h照明∶10 h黑暗的光照交替,早晚定点喂食。
1.2 实验方法
1.2.1 实验分组及处理
将野生型成年斑马鱼AB随机分为3组:空白对照组、0.1 μg·L-1BHPF组、1 μg·L-1BHPF组。设置3个平行组,每组4条,连续给药3周,每隔24 h换一次药,给药后将斑马鱼放置于恒温28 ℃,14 h光照∶10 h黑暗的鱼房进行培养。
1.2.2 行为学检测
1.2.2.1 黑白箱测试
黑白箱是一个长22 cm宽14 cm高14 cm的长方体水箱。水箱一侧用黑色塑料袋在外围包裹起来,使缸内呈现黑暗状态,另一侧用白纸包裹起来,使缸内呈现较明亮状态,之后将水箱放置在LED灯箱上,抽出水箱中间的挡板,将斑马鱼放入水箱中,每次一条。斑马鱼放入水箱中先静置10 min使其适应环境,当斑马鱼游至黑白分界线时开始计时,记录时间为3 min,观察和分析成年斑马鱼在黑、白箱中游动的距离和时间。
1.2.2.2 新型水槽测试
新型水槽实验在一个长22 cm宽14 cm高14 cm的长方体透明水槽中进行,并将其放置在LED灯箱前面。在水箱外壁画一条中线,将水箱分成上下2个相等的部分,中线以上为上部区域,中线以下为下部区域。将斑马鱼放入水槽中,每次一条,斑马鱼在水槽中静置10 min使其适应环境,之后当斑马鱼游至水槽中线时开始记录,记录时间为3 min,观察和分析斑马鱼在上、下区域游动的时间和距离。
1.2.2.3 T迷宫测试
T迷宫检测装置的起始臂21 cm,长臂20 cm,短臂11 cm,同时有4个6 cm3的深水区,深水区比其他手臂深4 cm,都是由不透明的塑料板组成,深水区是一个不透明的黑色区域,健康斑马鱼更偏好于黑暗深水环境。将T迷宫放置于LED灯箱上,先对每只斑马鱼进行训练,待斑马鱼游到深水区时,将其捞出换下一条继续训练,所有斑马鱼训练结束后,开始观察和分析斑马鱼在起始臂、长臂、短臂和进入深水区的距离和时间,每条斑马鱼的实验时间为5 min。
1.2.3 荧光定量PCR(quantitative real-time PCR,qRT-PCR)
在行为学检测后,将每组成年斑马鱼取脑,鱼脑按组别放置EP管中,每组取2个鱼脑用PBS冲洗2~3次,加入裂解液,在破碎机中充分研磨,使其完全裂解,然后将研磨后的裂解物放入离心机中离心,取上清液。RNA提取后,利用超微量分光光度计检测不同组别RNA的浓度,检测得到的结果A260/A280应在2.0~2.5之间;之后立即使用C1000 Touch梯度PCR仪将RNA进行反转,将反转得到的cDNA进行稀释,然后加入相应的引物用实时荧光定量PCR仪对各个基因进行扩增,以rpl13a为内参基因(表1)。Real-time PCR扩增结束后,用2-ΔΔCt相对定量法计算各组基因的相对表达量。

表1 Real-time PCR所需引物序列信息Table 1 Primer sequence for real-time PCR
1.2.4 统计学分析
利用Graphpad prism 7.0软件对实验结果进行One-way ANOVA检验,以Correct for multiple comparisons using statistical hypothesis testing.(Bonferroni)进行组间比较,并以Mean±SEM表示。
2 结果(Results)
2.1 黑白箱测试结果提示BHPF造成斑马鱼运动能力异常
黑白箱测试结果显示健康成年斑马鱼更偏好在黑暗区域中运动,且运动能力正常。0.1 μg·L-1BHPF处理后的斑马鱼运动能力下降,而1 μg·L-1BHPF组斑马鱼运动能力有所提高,提示低浓度BHPF可能对斑马鱼运动能力产生更加显著的影响。与空白对照组相比,0.1 μg·L-1BHPF组和1 μg·L-1BHPF组斑马鱼在黑暗区域的运动距离/总距离、黑暗区域的运动时间/总时间的比值虽有下降趋势,但不具有统计学意义(图1)。该实验结果提示,BHPF能够导致斑马鱼运动能力异常,但对认知能力无显著影响。
2.2 新型水槽测试结果提示BHPF引起斑马鱼探索行为异常
新型水槽实验发现,经BHPF处理后的斑马鱼运动轨迹出现了明显变化,与空白对照组相比,1 μg·L-1BHPF组斑马鱼在水缸上部区域运动轨迹显著增加,斑马鱼表现出行为异常(图2(a))。经过数据统计发现,1 μg·L-1BHPF组斑马鱼在上部区域的运动距离/总距离、上部区域的运动时间/总时间的比值均显著增加,具有统计学意义(图2(b)和(c))。0.1 μg·L-1BHPF组斑马鱼在上部区域的运动距离/总距离的比值和上部区域的运动时间/总时间的比值虽都有变化,但均不具有统计学意义。综上所述,在新型水槽实验中,BHPF引起斑马鱼探索行为异常。
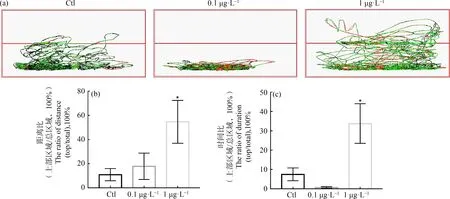
图2 BHPF造成斑马鱼探索行为异常注:(a) 新型水槽测试中斑马鱼的运动轨迹;红线表示快速运动(v>5 cm·s-1),绿线表示中速运动(2 cm·s-1≤v≤5 cm·s-1),黑线表示慢速运动(v<2 cm·s-1);(b) 不同组斑马鱼在水槽上部区域运动距离与在整个水槽内运动总距离的比值;(c) 不同组斑马鱼在水槽上部区域运动时间与在整个水槽内运动总时间的比值;*表示与空白对照组相比差异显著(P<0.05)。Fig.2 BHPF induced abnormal exploration behavior of zebrafishNote:(a) Zebrafish swimming path in novel tank diving tests;red line indicates fast movement (v>5 cm·s-1),green line indicates medium speed movement (2 cm·s-1≤v≤5 cm·s-1),and black line indicates slow speed movement (v<2 cm·s-1);(b) The ratio of distance (top/total) of zebrafish in novel tank diving tests;(c) The ratio of duration (top/total) of zebrafish in novel tank diving tests;*P<0.05 indicates significant difference compared with blank control group.
2.3 T迷宫测试结果提示BHPF造成斑马鱼学习记忆能力损伤
通过T迷宫测试,探究BHPF对斑马鱼学习记忆能力的影响。与空白对照组相比,0.1 μg·L-1BHPF组斑马鱼在T迷宫中运动轨迹明显减少,抑制了斑马鱼的运动能力;1 μg·L-1BHPF组斑马鱼运动轨迹显著增加,出现运动过度活跃现象并且在错误臂出现的次数增多(图3(a))。通过数据统计发现,0.1 μg·L-1BHPF组斑马鱼在错误臂的运动距离/总距离、错误臂运动时间/总时间的比值均增加,但不具有统计学意义;而1 μg·L-1BHPF组斑马鱼在错误臂的运动距离/总距离、错误臂的运动时间/总时间的比值均显著增加,具有统计学意义(图3(b)和(c))。以上实验结果提示,BHPF对斑马鱼学习记忆能力造成了损伤。
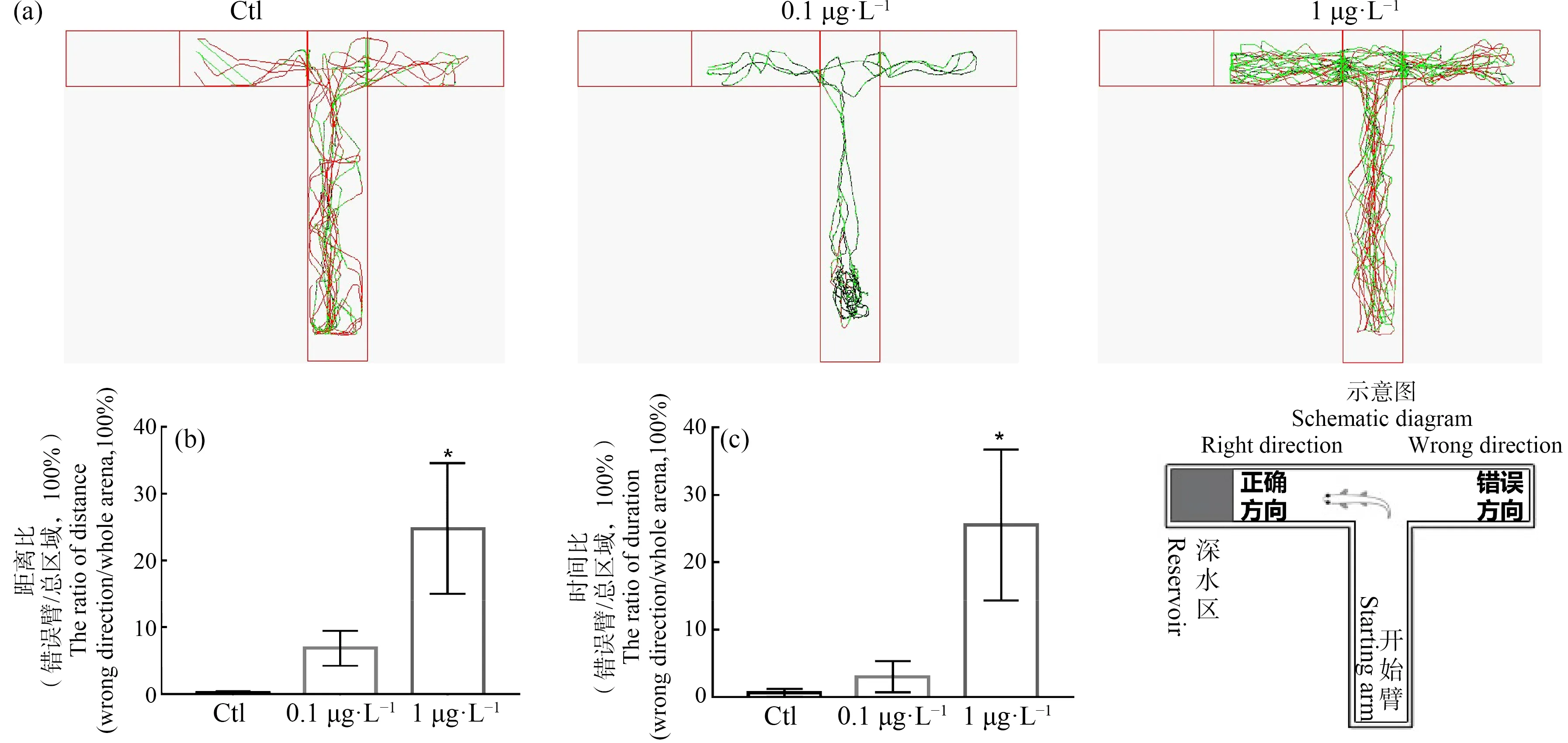
图3 BHPF影响斑马鱼学习记忆能力注:(a) T迷宫测试中斑马鱼的运动轨迹;红线表示快速运动(v>5 cm·s-1),绿线表示中速运动(2 cm·s-1≤v≤5 cm·s-1),黑线表示慢速运动(v<2 cm·s-1);(b) 不同组斑马鱼在T迷宫错误臂运动距离与在整个水槽内运动总距离的比值;(c) 不同组斑马鱼在T迷宫错误臂运动时间与在整个水槽内运动总时间的比值;*表示与空白对照组相比差异显著(P<0.05)。Fig.3 BHPF had adverse effects on learning and memory ability of zebrafishNote:(a) Zebrafish swimming path in T-maze tests;red line indicates fast movement (v>5 cm·s-1),green line indicates moderate movement (2 cm·s-1≤v≤5 cm·s-1),and black line indicates slow movement (v<2 cm·s-1);(b) The ratio of distance (wrong direction/whole arena) of zebrafish in T-maze tests;(c) The ratio of duration (wrong direction/whole arena) of zebrafish in T-maze tests;*P<0.05 indicates significant difference compared with blank control group.
2.4 BHPF影响神经发育相关基因的表达
为进一步探究BHPF造成斑马鱼行为异常的神经毒性作用机制,本研究利用qRT-PCR从神经发育、自噬和凋亡3个方面对斑马鱼脑内相关基因进行检测。与空白对照组相比,低、高浓度BHPF处理组c-fos(c-proto-oncogene protein)、syn2a(synchronous2a)、tuba1b(tubulin alpha-1b chain)、mbp(myelin basic protein)和gfap(glial fibrillary acidic protein)的表达显著上调,且具有浓度依赖性(图4)。研究结果提示,BHPF影响斑马鱼脑内神经发育相关基因表达。

图4 BHPF对神经发育相关基因表达的影响注:与空白对照组相比差异显著,*P<0.05,**P<0.01,***P<0.001。Fig.4 Effects of BHPF on the expression of neurodevelopment-related genesNote:Compared with blank control group,there is significant difference,*P<0.05,**P<0.01,***P<0.001.
2.5 BHPF影响凋亡相关基因的表达
为探究BHPF引起的神经毒性是否与凋亡机制相关,本研究对cytoC(cytochrome C)、apaf1 (apoptotic protease activating factor-1)、bax(bcl2-associated x protein)、caspase8 (cysteinyl aspartate specific proteinase8)、p53 (tumor suppressor gene)、caspase9 (cysteinyl aspartate specific proteinase9)和caspase3 (cysteinyl aspartate specific proteinase3)基因进行检测(图5)。与空白对照组相比,0.1 μg·L-1BHPF组apaf1、cytoC、bax、caspase8、p53、caspase9和caspase3表达上调,但apaf1和bax表达差异不具有统计学意义。与空白对照组相比,1 μg·L-1BHPF组apaf1、cytoC、bax、caspase8、p53、caspase9和caspase3表达均显著上调,具有统计学意义。研究结果提示,BHPF可以调控斑马鱼脑内凋亡相关基因,并且随着浓度增加,BHPF对基因表达的影响越显著。

图5 BHPF对凋亡相关基因表达的影响注:与空白对照组相比差异显著,*P<0.05,**P<0.01,***P<0.001。Fig.5 Effects of BHPF on the expression of apoptosis-related genesNote:Compared with blank control group,there is significant difference,*P<0.05,**P<0.01,***P<0.001.
2.6 BHPF影响自噬相关基因的表达
为探究BHPF产生神经毒性是否与自噬机制有关,对atg5 (autophagyrelated gene 5)、beclin1、ulk2 (unc-51-like kinase 2)和parkin进行检测(图6)。与空白对照组相比,0.1 μg·L-1BHPF组和1 μg·L-1BHPF组的atg5、beclin1、ulk2和parkin基因的表达以浓度依赖方式上调,具有统计学意义。研究结果提示,BHPF可以通过影响斑马鱼脑内自噬相关基因从而导致神经毒性。
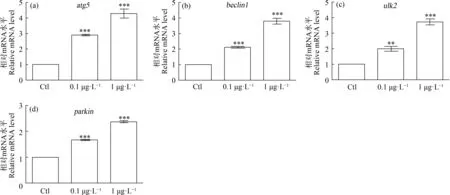
图6 BHPF对自噬相关基因表达的影响注:与空白对照组相比差异显著,**P<0.01,***P<0.001。Fig.6 Effects of BHPF on autophagy related gene expressionNote:Compared with blank control group,there is significant difference,*P<0.05,**P<0.01,***P<0.001.
3 讨论(Discussion)
为探究BHPF对环境和生物健康的潜在威胁,本研究以斑马鱼成鱼为模型,进行了神经行为学和相关基因检测,以揭示BHPF诱导的神经毒性和内在机制。黑白箱测试主要对斑马鱼的认知能力进行检测,健康成年斑马鱼更偏好于黑暗环境,而不喜欢明亮环境;新型水槽测试对斑马鱼探索能力进行检测,健康成年斑马鱼的探索欲望更强,在水槽上部运动更加活跃;T迷宫测试检验斑马鱼的学习记忆能力,健康成年斑马鱼通过训练能够减少游到深水区的时间和游到错误区的次数。3种行为学测试探究的都是斑马鱼的神经损伤情况,三者之间具有相互作用关系,本研究发现黑白箱测试中BHPF对斑马鱼运动能力产生影响;新型水槽测试显示BHPF使斑马鱼探索欲望降低,进一步说明BHPF可以对斑马鱼运动能力产生影响;T迷宫测试结果发现,BHPF不仅对斑马鱼运动能力产生影响还会对斑马鱼学习记忆造成损伤。以往研究利用斑马鱼新型水槽测试揭示了BHPF的抗雌激素毒性[11]。T迷宫测试显示了BPA另一种替代物双酚AF(4,4’-六氟-2-二酚,BPAF)使斑马鱼在错误臂出现次数增加,揭示了BPAF对斑马鱼产生神经毒性效应[12]。Li等[4]研究发现,健康成年斑马鱼与红色相比更偏好绿色区域,50 ng·L-1BPA处理后的斑马鱼对绿色和红色没有明显的偏好,但运动能力降低;当BPA浓度达到500 ng·L-1时,虽仍然没有明显的颜色偏好,但运动开始恢复到正常水平。同样在红色与蓝色偏好测试中发现,健康成年斑马鱼更偏好红色区域,50 ng·L-1BPA处理后的斑马鱼对红色和蓝色没有明显的偏好,但运动能力降低;当BPA浓度达到500 ng·L-1时,虽然仍然没有对红色或蓝色的偏好,但运动开始恢复到正常水平。究其原因可能在于低浓度BPA可使血清素阳性神经元数量减少得更加明显,从而造成斑马鱼运动能力降低。上述行为学测试结果与本研究结果相似,黑白箱测试和新型水槽测试中低浓度BHPF可以对斑马鱼行为运动产生影响,T迷宫实验BHPF可以对斑马鱼学习记忆产生损伤,提示BHPF诱导斑马鱼成鱼的神经毒性。研究发现,BHPF处理组使神经发育、自噬和凋亡相关基因表达显著上调,这与之前有毒化合物暴露对斑马鱼的影响的研究结果相类似。韩沐汐等[13]研究发现,氯化锑处理的斑马鱼凋亡和自噬相关基因表达显著上调。又有研究表明[14],铅暴露导致斑马鱼神经发育相关基因过表达。本研究的主要目的是探究BHPF对斑马鱼产生的神经毒性及作用机制,但是探讨BHPF和BPA的毒性效应差异及内在机制对于水生环境的监测和人类健康发展也是至关重要的。因此,本课题组今后的研究重点将会详细比较和分析BHPF和BPA的毒性效应差异和内在机制。
c-fos是斑马鱼神经元兴奋性的标志物[15];gfap表达上调可产生神经毒性[16];tuba1b在中枢神经系统中发挥重要作用;mbp在斑马鱼胚胎发育阶段的神经系统中表达丰富。syn2a是哺乳动物突触形成的生物标志物,在突触发生和神经递质释放中发挥重要作用[17]。本实验发现,BHPF对c-fos、gfap、tuba1b、mbp和syn2a等神经发育相关基因的表达具有调控作用,上述基因表达上调提示BHPF可能通过影响神经元活动、中枢神经系统结构、突触的发生和神经递质释放产生神经毒性。
细胞凋亡是一种继发性程序化死亡过程,多种基因参与调控,其中bax是启动凋亡的关键基因[18],随着死亡信号的刺激,促凋亡蛋白BAX直接被激活,随后移位至线粒体并形成同源二聚体通道,促进CYTO C释放至胞浆导致APAF1活化,从而使CASPASE蛋白激活并诱导细胞凋亡。p53能通过激活促凋亡因子,同时抑制抗凋亡因子增加线粒体通透性并参与凋亡程序[19]。结果发现,BHPF使apaf1、cytoC、bax、caspase3、caspase8、caspase9和p53凋亡相关基因表达上调,提示BHPF可以通过诱导细胞凋亡产生神经毒性。
自噬是细胞进化的正常生理过程[20],正常生理情况下对细胞有利,在应激刺激时自噬活性升高以应对不利环境。当刺激持续存在时,将会过度激活自噬活性,从而导致细胞的损伤或死亡。atg5基因参与自噬体的形成,在自噬过程中起关键作用[21]。beclin1是第一个被发现与自噬调控相关的关键因子[22]。parkin作为E3泛素连接酶,能从胞质转移到线粒体中,泛素化线粒体蛋白,形成自噬体,进而通过自噬降解受损的线粒体[23]。ulk2能阻止不溶性泛素化蛋白聚集物的积累[24]。研究显示[1],BHPF可以调控beclin1表达显著上调,说明BHPF可以诱导线粒体自噬,降解线粒体结构蛋白,这与本实验结果类似。本研究进一步检测了atg5、parkin和ulk2自噬相关基因,提示BHPF可能由于造成过度自噬产生神经毒性。
综上所述,本研究通过行为学检测(黑白箱测试、新型水槽测试和T迷宫测试)和基因检测(神经发育、自噬和凋亡)相结合的方法,明确了BHPF对斑马鱼成鱼的神经毒性及作用机制,为水生环境的监测和人类健康发展提供了理论基础。

