保鲜膜中微塑料和邻苯二甲酸酯浸出行为及斑马鱼胚胎毒性评价
高宇,许霞,*,施昕澜,张玲,郭俊,张秋亚,彭明国,薛银刚,#
1.常州大学环境与安全工程学院,常州 213164
2.江苏省常州环境监测中心,常州 213001
食品接触材料(food contact material,FCMs),也称食品包装材料,指在食品生产、加工、运输和使用过程中可能直接或间接接触食品的所有材料[1-3]。常见的FCMs包括塑料、玻璃、陶瓷和金属等[4]。塑料制品因为成本低廉、轻便耐用占据了FCMs市场的“半壁江山”[5]。据统计,在2015年全球生产的3.8亿t塑料中,塑料包装独占1.52亿t,其中60%的塑料包装被用于食品和饮料[6-7]。我国食品包装材料尤其是塑料包装的用量持续增长,塑料包装用量已经超过总用量的50%[8]。
塑料包装为人类生活提供了极大的便利,但也对环境和生物健康带来了挑战。一方面,大量塑料包装材料不当的回收与处置加剧了环境负担,并被认为是环境中微塑料(<5 mm的塑料)污染的主要来源[9-11]。近些年来,在塑料包装中也发现了微塑料的存在。例如,瓶装饮料被发现含有来自瓶子本身的微塑料[12],食盐和茶包中发现了来自包装的微塑料[13-14]。现有研究表明,微塑料可以被不同层级的生物摄食,生物体在摄入微塑料后,消化系统会出现堵塞和磨损痕迹,导致食欲下降[15-16]。与生物体接触后,微塑料引起的氧化应激可能导致代谢紊乱和神经毒性[17]。
另一方面,除了微塑料污染外,FCMs中所含添加剂通过食品接触迁移到食品中也引起了广泛关注[18-21]。由于难以与聚合物形成牢固的化学键,它们很容易在与食品接触过程中迁移出来[22]。值得注意的是,从包装材料中迁移出的化学物质可能是食品污染的最大来源,浸出量可能比农药残留高2~3个数量级[23]。邻苯二甲酸酯(phthalic acid ester,PAEs)作为最具代表性的塑化剂,普遍用于保鲜膜的制造[24]。它们的存在可以帮助塑料分子分散更均匀,使保鲜膜具有足够的柔韧性[25]。PAEs被认为是内分泌干扰物(endocrine disrupting chemicals,EDCs)[26],可导致细胞毒性以及生殖和发育缺陷[27]。以往的研究主要集中在塑料食品接触材料中PAEs迁移量的测定[28-29],有关浸提液中微塑料和PAEs的浸出及其对斑马鱼胚胎毒性效应的研究却鲜见报道。
目前市售产品大多宣称在耐温范围内使用不会产生危害,本研究以聚乙烯(polyethene,PE)和聚氯乙烯(polyvinyl chloride,PVC)保鲜膜为测试对象,选取3种食品模拟物(水、50%乙醇和正己烷)进行迁移实验,以早期发育敏感阶段的斑马鱼胚胎(Daniorerio)作为毒性受试生物,通过归纳浸出液中微塑料和PAEs的浸出行为,并探究浸出的PAEs对斑马鱼胚胎的发育影响,为塑料食品接触材料的风险评估和健康安全评价提供科学支撑。
1 材料与方法(Materials and methods)
1.1 实验材料
购买PE和PVC这2种材质的保鲜膜;受试鱼种为中国科学院水生生物研究所国家斑马鱼资源中心培育的AB系斑马鱼,实验室条件下驯化2周。饲养期间严格控制养殖系统的水质卫生条件及光照时间,每天用实验室人工孵化的盐水虾(丰年虾)作为活饲料定时投喂2次,后期用于暴露试验的胚胎均为其后代。
1.2 试剂与仪器
试剂:迁移试验用水采用全玻璃装置重蒸馏的超纯水,标准稀释水(5.5 mg·L-1KCl,63.0 mg·L-1·NaHCO3,123.3 mg·L-1MgSO4·7H2O,294.0 mg·L-1CaCl2·2H2O)用于斑马鱼的相关试验,邻苯二甲酸酯类标准配品纯度为99%(德国Dr.Ehrenstorfer公司),其余试剂均为色谱纯(上海阿拉丁,中国)。
仪器:傅里叶变换红外光谱仪(FTIR,Nicolet IS5,美国);气相色谱质谱联用仪(Agilent 7890B/5977B,美国);超高清测量显微镜(SGO-KK203,深圳光谷,中国);循环水养殖系统(定制,上海海圣,中国);生化培养箱(SPX-250B-Z,上海博迅,中国);循环水式真空泵(SHZ-D(Ⅲ),上海邦西,中国);离心机(TDL-60C,上海安亭,中国);涡旋振荡器(UMV-1,北京优晟,中国);油浴锅(DF-101S,上海力辰,中国);旋转蒸发皿(RE-52AA,上海亚荣,中国);回流冷凝装置(四川蜀玻,中国)。
1.3 实验方法
1.3.1 迁移试验
浸出液的制备参考《食品安全国家标准 食品接触材料及制品迁移试验通则》(GB 31604.1—2015)[30]。不同类别食品对应的食品模拟物如表1所示。PE和PVC保鲜膜的试验温度分别为110 ℃和80 ℃,试验时间均为0.5 h。接触面积与食品模拟物体积比(S/V)采用0.06 m2对应1 L食品模拟物。采用全浸没法,由于试样厚度≤0.5 mm,实验中浸没面积均取单面计算。实验中取0.006 m2保鲜膜样品,100 mL食品模拟物加入接收瓶,于油浴锅中加热回流冷凝。

表1 不同食品类别下的食品模拟物及迁移试验条件Table 1 Simulants and migration test conditions used for different food categories
1.3.2 微塑料的分离与鉴别
浸出液在真空泵下通过纤维素滤膜(直径47 mm,孔径1 μm)进行抽滤,过程中用超纯水反复冲洗容器内壁。滤膜放入洁净的培养皿中,待干燥后置于显微镜下观察。每组样品包括3个平行和1个空白对照(玻璃器皿)。记录可疑微粒的个数、粒径和形貌特征(形状、颜色),用FTIR进行官能团分析。FTIR采用衰减全反射模式,采集时间为3 s,光谱范围为4 000~500 cm-1,测试结果与标准光谱库对比,匹配度≥70%方可被接受[31]。
1.3.3 暴露试验
斑马鱼胚胎实验参考《水质 急性毒性的测定 斑马鱼卵法》(HJ 1069—2019)[32]。选取二甲亚砜(DMSO)作为助溶剂,用标准稀释水稀释至0.05%(V/V)。浸出液按本文1.4.1节的前处理方法挥干后,加入助溶剂。对照组和实验组的试验布局如图1所示,阴性对照即为空白对照,溶剂对照中的溶液为0.05%(V/V) DMSO。取各组溶液加入石英玻璃微孔,每孔2 mL。受精卵在恒温培养箱内静置45 min,显微镜下挑选64-细胞期~128-细胞期的胚胎放入石英玻璃微孔中进行暴露,每孔1个胚胎。每种浸出液设置3个平行,每个平行包含10个胚胎。暴露完的胚胎转入生化箱,26 ℃下培养,记录48 hpf、72 hpf(hours post fertilization,受精后小时数)胚胎相关形态学指标[33-34]。

图1 斑马鱼胚胎试验微孔板布局图 注:DMSO表示二甲基亚砜。Fig.1 Layout of the microplate for the zebrafish embryo testNote:DMSO stands for dimethyl sulfoxide.
1.4 邻苯二甲酸酯类塑化剂的测定
1.4.1 浸出液的前处理
准确量取(10 mL±0.01 mL)各类模拟物浸出液,对于油性模拟物浸出液,45 ℃水浴减压旋转蒸发至近干后挥干,加入1 mL正己烷,振荡3 min,4 000 r·min-1离心5 min;对于水性和含醇模拟物浸出液,先加入4 mL正己烷,振荡10 min,4 000 r·min-1离心5 min,取上层正己烷层,重复提取2次,合并提取液,再按照油性模拟物浸出液的操作方法进行处理。全部完成后,收集上层清液待气相色谱-质谱联用仪检测。
1.4.2 气相色谱-质谱联用仪参数
色谱条件:色谱柱选取5%苯基-甲基聚硅氧烷石英毛细管柱(30 m×0.25 mm×0.25 μm);不分流进样1 μL;进样口温度260 ℃;初始柱温60 ℃,保持1 min,20 ℃·min-1升温至220 ℃,持续1 min,5 ℃·min-1升温至250 ℃,维持1 min,20 ℃·min-1升温至290 ℃,保持7.5 min;载气氦气流速1 mL·min-1。
质谱条件:EI电离源,电离能量70 eV;离子源温度230 ℃,传输线温度280 ℃;溶剂延迟7 min。
1.5 质量控制与保证
实验过程中严格执行品质控制措施,包括使用通风橱、棉衣和乳胶手套以防止外来微粒对结果产生干扰。所有容器未使用时用铝箔覆盖。微塑料过滤前,在显微镜下检查滤膜和培养皿的清洁度。用于暴露的斑马鱼胚胎在培养48 h后,对照组的试验结果应满足以下要求:板对照中无胚胎死亡;阴性对照中胚胎存活率≥90%;阳性对照胚胎存活率<10%,否则重新试验。
1.6 数据处理
实验结果以平均值±标准偏差的形式呈现,微塑料丰度单位为“个·(100 mL)-1”;使用Origin Pro 2017进行正态检验和单因素方差分析(ANOVA);*表示P<0.05,**表示P<0.01。
2 结果(Results)
2.1 浸出液中微塑料的特征
2.1.1 微塑料的类型与丰度
通过FTIR对可疑微粒进行表征(图2),并与标准谱图比对以确定样品的类型。共有79个疑似颗粒被检测,其中包含一些类似塑料的非塑料颗粒。一些微粒的聚合物成分与保鲜膜相同且颜色也为透明,因此,它们被认为是从保鲜膜中剥落的微塑料。在PE和PVC保鲜膜中,自身剥落微塑料分别占总体丰度的21.0%和17.7%。在PE和PVC保鲜膜中也发现了其他类型的聚合物,PE保鲜膜中其他类型的聚合物占比分别为聚对苯二甲酸乙二醇酯(26.3%)、聚酯(21.1%)、丙烯酸(5.3%)、尼龙(15.8%)和人造丝(31.5%),PVC保鲜膜中其分别为聚对苯二甲酸乙二醇酯(28.6%)、聚酯(17.9%)、丙烯酸(7.1%)、尼龙(21.4%)和人造丝(25.0%)。

图2 保鲜膜中微塑料的红外光谱图注:PE表示聚乙烯;PVC表示聚氯乙烯;PET表示聚对苯二甲酸乙二醇酯;PES表示聚酯。Fig.2 Infrared spectrum of microplastics in plastic wrapNote:PE stands for polyethylene;PVC stands for polyvinyl chloride;PET stands for polyethylene terephthalate;PES stands for polyester.
由图3(a)可知,不同模拟物下2种保鲜膜中微塑料的总体丰度,箱线图中的晶须、中线和小方块分别代表丰度的最值、中值和平均值。3种模拟环境下PE保鲜膜中微塑料的丰度在(2.33±0.47) 个·(100 mL)-1到(3.33±0.47) 个·(100 mL)-1之间,平均丰度为(2.67±0.82) 个·(100 mL)-1。PVC保鲜膜中微塑料丰度最高值为(4.33±0.47) 个·(100 mL)-1,最低值为(3.00±0.82) 个·(100 mL)-1,平均为(3.78±0.92) 个·(100 mL)-1。外来源微塑料(非自身剥落)丰度如图3(b)所示,PE保鲜膜中外来源微塑料的平均丰度为(2.11±0.74) 个·(100 mL)-1,占总体丰度的79.0%,PVC中外来源微塑料的平均丰度(3.11±0.57) 个·(100 mL)-1,占总体丰度的82.3%。
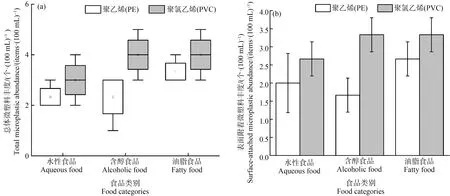
图3 不同模拟物下2种保鲜膜中微塑料的丰度注:(a) 总体微塑料丰度;(b) 表面附着微塑料丰度(非自身剥落)。Fig.3 Abundance of microplastics in two kinds of plastic wrap under different simulantsNote:(a) Total microplastic abundance;(b) Surface-attached microplastic abundance (non-self flaking).
2.1.2 微塑料的形状和粒径
不同模拟物下2种材质保鲜膜中检出的微塑料形状包括2种:薄膜和纤维,且纤维所占比例远远大于薄膜。在水性、含醇和油脂食品模拟物中,PE保鲜膜中纤维状塑料百分比分别是86%、71%和80%,薄膜状为14%、29%和20%(图4(a))。在PVC保鲜膜中,纤维类分别占比89%、83%和77%,薄膜类比例为11%、17%和23%(图4(b))。微塑料根据粒径分为3组:分别为<500 μm、500~1 000 μm和>1 000 μm。如图4(c)所示,PE保鲜膜中<500 μm粒径的微塑料最多(74.1%),其次是粒径在500~1 000 μm的微塑料(22.2%),粒径>1 000 μm的微塑料最少(3.7%)。由图4(d)可知PVC保鲜膜中微塑料的粒径分布情况,500~1 000 μm的微塑料最多(55.9%),粒径<500 μm的微塑料次之(29.4%),>1 000 μm的微塑料依然最少(14.7%)。

图4 不同模拟物下2种保鲜膜中微塑料的形状和粒径注:(a)表示PE保鲜膜中微塑料的形状分布;(b)表示PVC保鲜膜中微塑料的形状分布;(c)表示PE保鲜膜中微塑料的粒径;(d)表示PVC保鲜膜中微塑料的粒径。Fig.4 Shape and size of microplastics in two kinds of plastic wrap under different simulantsNote:(a) Represents shape distribution of microplastics in PE;(b) Represents shape distribution of microplastics in PVC;(c) Represents size of microplastics in PE;(d) Represents size of microplastics in PVC.
2.2 浸出液中PAEs对斑马鱼胚胎发育的影响
2.2.1 各组别对胚胎心率的影响
显著性分析结果表明空白对照组和溶剂对照组之间不存在明显差异。PE保鲜膜中各试验组均未发现20 s内斑马鱼胚胎心跳次数有明显变比。PVC水性环境实验组毒性最弱,对斑马鱼胚胎的心率几乎没有抑制作用。相比之下,含醇和油脂条件实验组对斑马鱼胚胎20 s内心跳次数均有很强的抑制作用,其中油脂环境实验组对胚胎影响最显著。48 hpf时,含醇试验组和油脂试验组中斑马鱼胚胎20 s心跳次数分别相当于溶剂对照组的92.6%和85.9%;72 hpf时,2个试验组暴露下的胚胎20 s心跳次数分别为对照组的87.2%和80.4%(图5)。
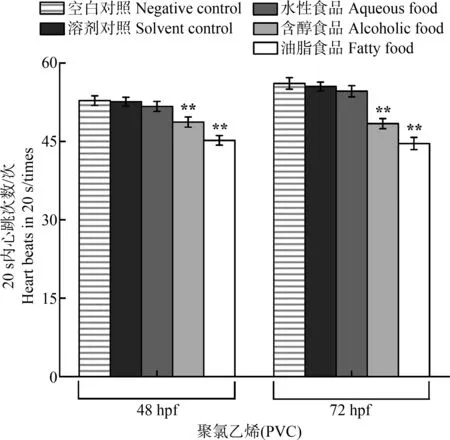
图5 不同模拟物下保鲜膜浸提物对胚胎心率的影响Fig. 5 Effects of the extracts from plastic wrap using different food simulants on the heart rate of embryos
2.2.2 各组别对胚胎的致畸作用
如图6所示,PVC保鲜膜含醇实验组和油脂实验组中暴露的斑马鱼胚胎均出现了脊柱弯曲和心包囊肿。其中脊柱弯曲率分别为6.7%(P<0.01)和13.3%(P<0.01)。心包囊肿率相对较低,分别为3.3%(P<0.01)和6.7%(P<0.01)。相对于48 hpf正常发育的胚胎(图7(a)),在实验组中出现了如心包囊肿(图7(b))和卵黄肿大(图7(c))等畸形症状;72 hpf暴露后,相比正常发育的仔鱼(图7(d)),实验组中发现了心包囊肿(图7(e))和脊柱弯曲(图7(f))的仔鱼。
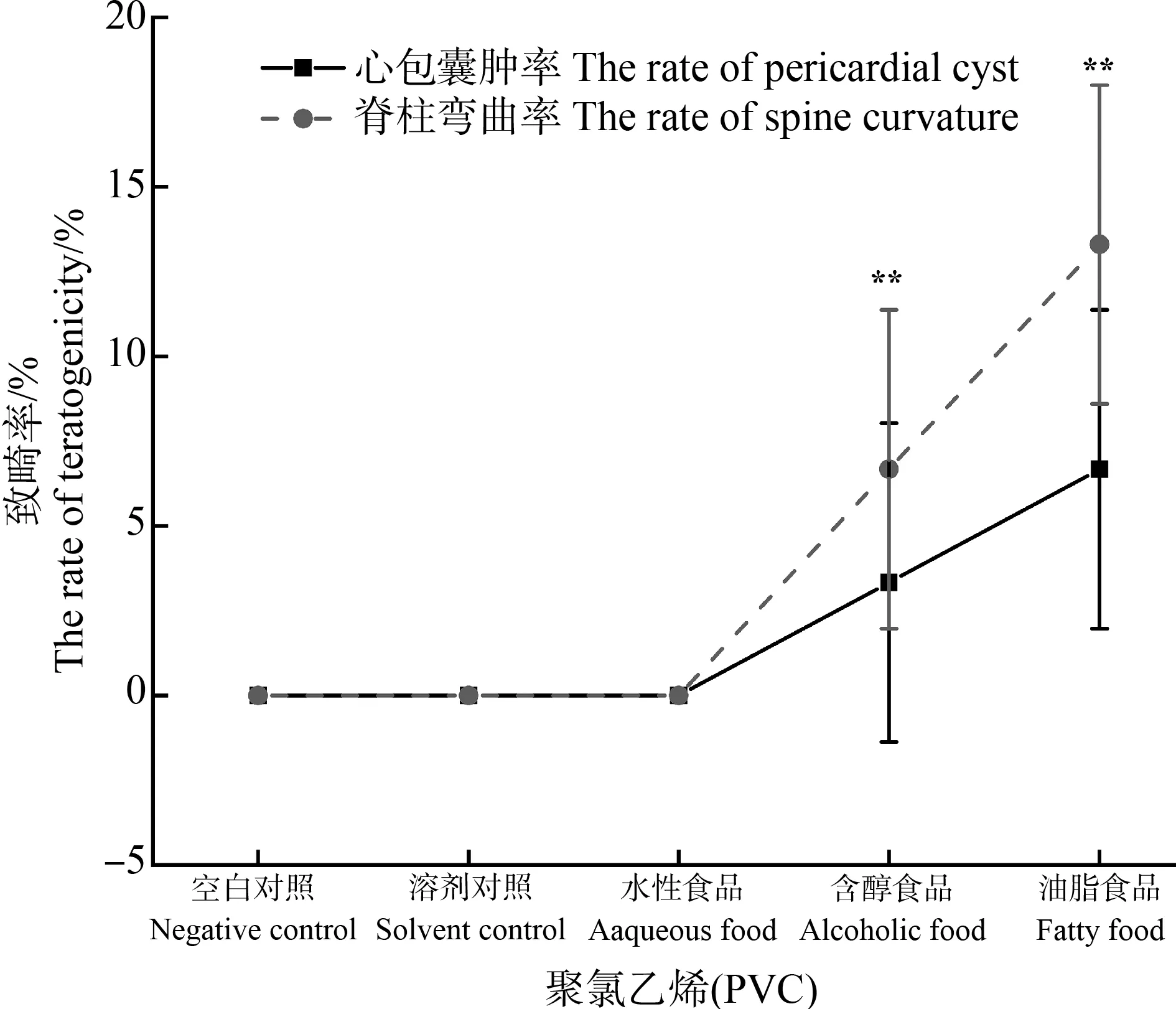
图6 不同模拟物下保鲜膜浸提物对胚胎的致畸作用Fig. 6 Teratogenic effects of the extracts from plastic wrap using different food simulants on embryos

图7 异常胚胎显微照片注:(a) 48 hpf发育正常的胚胎;(b) 48 hpf心包囊肿的胚胎;(c) 48 hpf卵黄肿大的胚胎;(d) 72 hpf发育正常的仔鱼;(e) 72 hpf心包囊肿的仔鱼;(f) 72 hpf脊柱弯曲的仔鱼。Fig.7 Micrographs of abnormal embryosNote:(a) Normally developing embryo at 48 hpf;(b) Embryo with pericardial cyst at 48 hpf;(c) Embryo with yolk deformation at 48 hpf;(d) Normally developing larva at 72 hpf;(e) Larva with pericardial cyst at 72 hpf ;(f) Larva with spine curvature at 72 hpf.
2.3 浸出邻苯二甲酸酯类塑化剂的浓度
通过GC-MS对浸出液中的成分进行分析,结果如表2所示。邻苯二甲酸二(2-乙基己基)酯(DEHP)、邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二辛酯(DOP)在PVC保鲜膜含醇和油脂模拟物的浸出液中被检测出,PE保鲜膜3种食品模拟物的浸出液中都未发现PAEs的浸出。同时,PVC保鲜膜在油脂环境下的迁移量最大,其次是含醇环境,2种保鲜膜在水性环境下都未检出PAEs。

表2 不同模拟物下2种保鲜膜中邻苯二甲酸酯浓度Table 2 Phthalate concentrations of two kinds of plastic wrap under different simulants (mg·L-1)
3 讨论(Discussion)
3.1 2种保鲜膜中微塑料浸出行为
PE和PVC保鲜膜中都发现了微塑料的存在,其中有一部分来源于保鲜膜本身。微塑料可能在塑料制品制造、运输和日常使用过程中从接触材料表面脱落。Du等[35]发现微塑料会在轻微冲洗后从不同类型的外卖容器表面剥落,每人每周通过容器摄入的微塑料可能高达203个。Fadare等[36]对用于食品配送的圆形、矩形塑料容器和日常饮用的一次性塑料杯浸出的微塑料进行了检测,确定了剥落微塑料的平均质量分别为(12±5.12) mg、(38±5.29) mg 和(3±1.13) mg。除了自身剥落的内源污染外,包装材料中也发现了外来源污染,且以纤维状的微塑料比例最高。5种外来源微塑料按比例从高到低分别为人造丝、聚对苯二甲酸乙二醇酯、聚酯、尼龙和丙烯酸。衣物上的塑料纤维可能是外来污染的重要来源。研究表明,纤维状的微塑料主要由服装纤维的断裂产生,其主要成分是人造丝和聚对苯二甲酸乙二醇酯,这2种材质的聚合物在合成纺织纤维中被大量使用[37]。在与食品接触材料加工和包装的过程中,衣物上的塑料纤维可能通过静电作用沾染到保鲜膜表面。除了衣物来源,大气中的微塑料污染也可能通过沉降作用进入到接触材料。大气微塑料污染普遍存在于室内外环境中[38-39]。Cai等[40]对中国东莞市大气沉降物中微塑料的污染特征进行了归纳,发现每天沉降物中微塑料浓度的范围为175~313 个·m-3,且纤维是主要的形状。室内环境的污染更严重,Dris等[41]的研究表明,每天沉降的塑料纤维浓度介于523~3 673 个·m-3之间。本文检出的外来源塑料微粒以纤维形状最为丰富,这与Cai等[40]和Dris等[41]的研究结果相一致。制品在生产、储存、运输和使用过程中不可避免地会接触到空气,大气中的微塑料可能通过这些环节中进入塑料制品中。有研究表明,与摄入大气微塑料沉降物引起的暴露水平相比,通过贝类摄入微塑料对人类健康的影响甚至可以忽略不计[42]。从丰度上看,PVC保鲜膜中的外来颗粒个数大于PE保鲜膜;从粒径分布上看,PVC保鲜膜中含有微塑料的粒径也是大于PE保鲜膜的,这可能因为PVC保鲜膜具有更大的黏性,更有利于大粒径的外来微塑料粘附在表面。相关研究表明,微塑料的存在可能会加剧浸提液的毒性[43-44],具体的毒性机制目前尚不明确。除了塑料制品本身迁移添加剂的毒性,剥落的微塑料也有可能对斑马鱼胚胎产生毒性。
3.2 不同模拟环境下PAEs的迁移量及毒性效应
由于PAEs未与聚合物共价结合,而是通过氢键或范德华力与树脂相连,因此这些化合物很容易从塑料食品接触材料中迁出[45]。Han等[46]对中国外卖食品容器中的PAEs进行了调查,发现DEHP的浸出率最高,达到51.2%。赵电波等[47]发现聚乙烯包装袋在包裹完高温油炸的油条后,包装材料中检测到了DBP和DOP的浸出,最大浸出浓度分别为0.79 mg·L-1和0.24 mg·L-1。不同食品模拟物中PAEs的浸出量也呈现出差异性,相比于水性模拟物,有机模拟物中PAEs有着明显的浸出,这可能与用来抽提的溶剂极性有关[48]。塑料食品接触材料中的添加剂多为非极性化合物,因此难以在极性很强的水溶液中发生迁移,而与水相比,醇和烷烃的极性要小得多,根据相似相溶原理,在这类模拟环境下迁移促进了同样极性较弱的PAEs浸出。PAEs在油脂模拟物中的迁移量大于在含醇环境下的迁移量,这种差异可能归因于正己烷和PAEs相似的C—C长链结构[49],此外,迁移量差异也和溶液体系中有机组分的含量有关,油脂模拟物中高聚物的溶剂化作用更为明显,进而导致更多的PAEs迁移。
PVC保鲜实验组中的受试胚胎受到不同程度的毒害作用,浸提液中检测到DEHP、DBP和DOP这3种PAEs类化合物的浸出。Staples等[50]研究发现DBP、DEHP和DOP可对鱼类胚胎产生毒性效应,且其毒性的强弱与烷基链长度成正相关。何秀婷等[51]研究了4种不同浓度的PAEs对斑马鱼胚胎发育的联合毒性,计算出DBP和DEHP对斑马鱼胚胎48 h半数致死浓度(LC50-48 h)分别为0.20 mg·L-1和0.77 mg·L-1,且DBP和DEHP交互暴露时,可能产生的协同作用会导致毒性加强,对斑马鱼胚胎发育造成更大影响。含醇和油脂实验组中部分斑马鱼胚胎表现出心率异常并伴有特征性的心脏缺陷,这些症状的产生很可能归因于浸出的PAEs。Singh和Li[52]借助比较毒理学数据库对16种PAEs与基因/蛋白质之间的相互作用进行了探究,发现心脏毒性是PAEs毒性排名最高的类别,其次是肝毒性和肾毒性。相关研究表明,PAEs对心脏产生毒性的作用机制可能与Nkx2.5和Tbx5这2种基因的表达变化有关。作为重要的心脏转录因子,在胚胎心脏发育过程中发挥着关键作用[53-54]。Nkx2.5和Tbx5协同参与心肌细胞分化,促进心脏发育[55],其在胚胎中的表达改变可导致严重的心脏分化缺陷和心脏缺陷[56-57]。Sun和Liu[58]证实了邻苯二甲酸丁苄酯(BBP)会损害斑马鱼胚胎的心脏结构和功能,并通过实时定量PCR技术深入探究了BBP对斑马鱼胚胎心脏发育产生不利影响的机理。Nkx2.5和Tbx5的基因表达伴随BBP暴露剂量的上升呈现依赖性下降,这2种基因的改变可能是引起心脏毒性的主要原因。穆希岩等[59]证明了DBP和DEHP可导致胚胎中Nkx2.5蛋白含量降低,这种蛋白含量的减少可能造成胚胎心脏发育缺陷,引起胚胎心率异常[56-57]。Pfuderer和Francis[60]证明了PAEs对心率有影响,其中DBP和BBP可显著降低金鱼的心率,这些结果表明心脏缺陷与酞酸酯类化合物之间存在密切的关联。
暴露于含醇和油脂浸提液的斑马鱼胚胎出现脊柱弯曲,这可能和胚胎中与脊索发育和骨骼发育的相关基因转录水平发生改变有关。之前的研究表明,PAEs类化合物易对骨骼和脊柱的发育造成影响[61-62]。Qian等[63]发现参与脊索发育的col8a1a基因以及参与骨骼发育的BMP-2因子的转录水平在50 μg·L-1DEHP和DBP中显著下调,这可能是导致斑马鱼脊柱缺陷的关键原因。Col8a1a被认为是斑马鱼脊索发育过程中的必要因素,该基因功能的缺失或抑制会影响胚胎脊柱和骨骼系统正常发育,进而造成斑马鱼胚胎脊椎畸形[64]。骨形态发生蛋白(BMP-2)作为骨形成的诱导剂和胚胎发育的调节剂,直接参与脊椎动物胚胎背腹的早期形成,BMP-2的转录减少可能对骨骼发育产生负面影响并进一步诱导脊柱变形[65]。既往的研究也有相似的发现,当暴露于多氯联苯(PCBs)和三唑类化合物时,伴随着BMP-2转录的减少,斑马鱼胚胎脊柱弯曲率上升[66-67]。斑马鱼胚胎相关毒性症状的产生可能是一系列复杂毒性机制综合作用的结果,一方面浸提过程中迁移出的塑料添加剂可能通过改变与发育有关基因的表达,诱导斑马鱼胚胎出现毒性效应,另一方面浸提液中的微塑料可能会对浸提液的毒性起到促进作用,共同影响斑马鱼胚胎发育。

