子痫前期中Nrf2和NQO1的关系及NQO1对HTR-8/SVneo细胞侵袭力影响的研究
吴国红
(广东医科大学附属第三医院<佛山市顺德区龙江医院>,广东 佛山 528300)
子娴前期较为普遍,该病常发生在妊娠20周内,以高血压、水肿、蛋白尿等为临床常见表现,严重的患者可有心肾功能衰竭,此为导致孕产妇死亡主因之一[1]。近年来,随着人们生活方式的改变,先兆子痫和子痫的发病率正在上升。子娴前期在新生儿、孕产妇死亡率中居第二位,对孕产妇和儿童的安全与健康产生严重影响。子娴前期患者的临床特征是胎盘血管床缺乏血流灌注和小动脉痉挛,这种妊娠并发症在围产期较为常见,应及时并积极治疗严重子痫前期患者,及早终止妊娠[2]。氧化和抗氧化的失衡在先兆子痫的病因和发病机理中非常重要。研究表明,先兆子痫患者血液中的超氧化物歧化酶(SOD)活性显著降低。本研究旨在探讨子痫前期Nrf2和NQO1之间的关系以及NQO1对htr-8/svneo细胞侵袭性的影响。
1 资料与方法
1.1 一般资料:本研究74例病例资料来源于医院2018年1月至2020年1月收治的子痫前期患者,同时选取正常妊娠妇女74例,子痫前期组年龄23~36岁,平均(30.71±4.63)岁,孕周35~39周,平均(36.17±2.25)周,收缩压143~162mmHg,平均(155.23±16.24)mmHg,舒张压95~112mmHg,平均(103.52±8.54)mmHg,孕次1~3次,平均(2.0±0.5)次,产次0~1次,平均(0.6±0.1)次;对照组年龄22~37岁,平均(30.50±4.55)岁,孕周35~40周,平均(38.03±2.10)周,收缩压110~124mmHg,平均(116.54±5.21)mmHg,舒张压65~75mmHg,平均(68.75±3.63)mmHg,孕次1~3次,平均(2.0±0.5)次,产次0~1次,平均(0.6±0.1)次。
1.2 研究方法:所有研究对象均抽取空腹静脉血,离心后取血浆,开展Nrf2和NQO1水平检测,Nrf2水平的检测方法为双抗体夹心酶联免疫吸附试验,血浆内的Nrf2和酶标本上包被的Nrf2抗体发生结合,生成结合物,其能够和后续加入的Nrf2抗体、HRP标记的亲和素发生有效反应,从而取得免疫复合物,在波长450nm处对OD值进行测量,开展Nrf2浓度计算。NQO1水平测量方法同样为双抗体夹心酶联免疫吸附试验,检测原理与Nrf2相同。
NQO1对HTR-8/SVneo细胞侵袭力的检测方法为:采用移液器对Eagle培养基、双抗(1mL)以及胎牛血清(10mL)进行吸取,将其放入到灭菌瓶内,然后采用移液器对Eagle培养基吸取,吸取量为7mL,加入2mL胎牛血清和1mL二甲基亚砜,混合均匀。采用移液器对双氧水吸取,吸取量为9.64μL,采用Eagle培养基加入,使其被稀释为250μmol/L,然后以滤膜过滤。首先将细胞进行复苏,然后开展细胞传代,最后开展细胞冻存。测量氧化应激模型中ROS的方法为:将HTR-8/SVneo细胞进行分组,对照组采用Eagle培养基加入,实验组采用双氧水处理液加入,培养4h,向瓶内加入3mL胰酶,消化后在显微镜下观察,在1000r/min速度下离心5min,去除上清液,应用PBS对细胞进行冲洗,继续离心5min,将上层血清去除,加入DCFH-DA溶液3mL,孵育30min,将离心管取出,继续离心5min,将上层清液去除,应用PBS对细胞进行冲洗,再次离心,采用PBS对细胞沉淀进行重悬,应用流失细胞仪后实施检测。随后开展氧化应激模型中细胞存活率测定,采用对数期HTR-8/SVneo细胞,移液器分组,吸取100μLPBS加入空白组每孔中,显微镜下弃去每孔中细胞悬液,实验组加双氧水处理液,对照组加Eagle培养基,孵育12 h后,将双氧水处理液去除,低速震荡10min上机检测。
1.3 统计学处理:运用SPSS 20.0软件分析数据,计量资料(±s)采用t检验,计数资料(n,%)采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组Nrf2和NQO1表达水平比较:子痫前期患者的Nrf2和NQO1水平均低于对照组,差异有统计学意义(P<0.05),子痫前期患者的Nrf2和NQO1表达水平表现为正相关(r=0.916,P<0.05),详见表1。
表1 两组Nrf2和NQO1表达水平比较(±s)
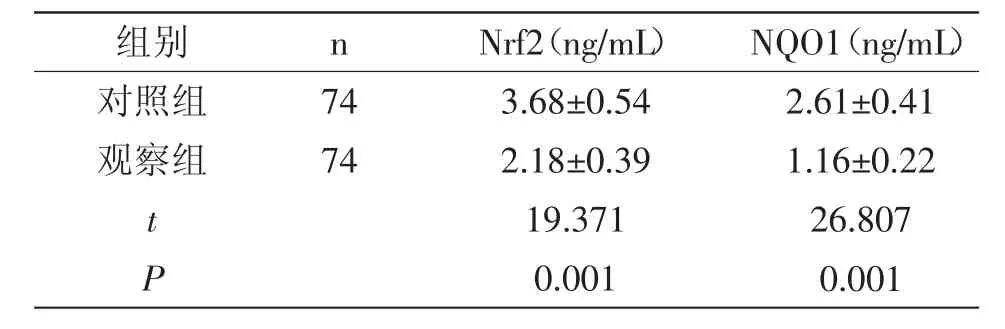
表1 两组Nrf2和NQO1表达水平比较(±s)
组别 n对照组 74观察组 74 tP Nrf2(ng/mL)3.68±0.542.18±0.3919.3710.001 NQO1(ng/mL)2.61±0.411.16±0.2226.8070.001
2.2 NQO1对HTR-8/SVneo细胞侵袭力影响:细胞中Nrf2、NQO1蛋白以及NQO1mRNA双氧水组和tBHQ组相较于对照组,具备更高的表达水平,差异有统计学意义(P<0.05);ML385组与对照组的细胞中Nrf2、NQO1蛋白以及NQO1mRNA相对表达水平差异无统计学意义(P>0.05);相较于双氧水组,双氧水联合ML385组的细胞中Nrf2、NQO1蛋白和NQO1mRNA相对表达水平均更低,差异有统计学意义(P<0.05),详见表2。
表2 NQO1对HTR-8/SVneo细胞侵袭力影响(±s)

表2 NQO1对HTR-8/SVneo细胞侵袭力影响(±s)
指标 对照组 双氧水组 tBHQ组 ML385组 双氧水联合ML385组Nrf2(ng/mL) 0.23±0.051.22±0.211.26±0.360.26±0.040.35±0.15 NQO1(ng/mL) 0.28±0.080.63±0.150.72±0.210.23±0.060.28±0.03
3 讨论
重度子痫前期病因复杂,临床上认为与其相关的因素就有免疫调节功能异常、血管内皮损伤、滋养细胞侵袭异常、遗传等,但具体发病机制尚未有明确的定性。全身小动脉痉挛、内皮功能障碍是重度子痫前期患者发病后主要病理改变[8]。该病会对胎儿发育产生不良影响,不利于妊娠结局,目前,对其的临床诊断指标有限,因此积极探索有效诊断指标来评估重度子痫前期的程度可为该病的有效防治提供依据[9]。
Nrf2作为氧化还原转录因子,已在国内外进行了广泛研究,它通过与抗氧化元素反应相互作用来激活下游抗氧化酶和解毒酶基因的表达,从而保护人体免受内源性和外源性的压力因素的影响[11]。已知血红素加氧酶1(HO-1)受Nrf2调节,是最重要的抗氧化剂保护蛋白,它是人体的典型保护和防御系统,覆盖大脑、心脏、肝脏和其他器官。Nrf2在一般正常情况下与胞浆蛋白伴侣分子结合而处于一种抑制状态。当受到各种刺激时,Nrf2可与胞浆蛋白伴侣分子解离并从胞浆转移至细胞核再与ARE结合,调控下游血红素加氧酶1、NQO l,谷胱甘肽-S-转移酶、谷氨酸半胱氨酸连接酶、细胞色素P450s和多药耐药蛋白等抗氧化酶的表达,从而使机体对外界刺激的抵抗力增强[12]。Nrf通路可产生抗氧化、抗炎、减轻Ca2+超载等作用。有研究显示Nrf2基因敲除的小鼠抗氧化能力下降,哮喘炎症加重,提示Nrf2在哮喘中具有重要的作用[13]。
有研究表明Nrf2和NQO1直接影响肝脏和胃肠道疾病的进展[14],但其是否参与子痫前期的病变过程暂无相关研究佐证。血浆中Nrf2、NQO1水平,子痫前期患者较正常妊娠妇女低,且两者间呈正相关。为进一步证明Nrf2与NQO1之间的相关性,使用了htr-8/svneo细胞,结果显示在htr-8/svneo细胞中NQO1水平变化和Nrf2水平变化呈正相关,说明Nrf2水平下降可对Nrf2途径的激活起抑制作用,进而降低Nrf2途径下游的NQO1表达。目前,先兆子痫暂无有效的治疗方法及预防措施,为避免不良结局只能及时终止妊娠。PE患者胎盘的病理特征是htr-8/svneo细胞浸润低,子宫螺旋动脉浸润不足,导致血管狭窄[15]。因此,寻找增强htr-8/svneo细胞侵袭性的因素在子痫前期患者的治疗中极为迫切及重要。氧化应激作用下致使htr-8/svneo细胞迅速调亡大量减少,受其影响继而细胞浸润方向的分化发生改变,同时还影响子宫螺旋动脉的重建,致使胎盘缺氧的恶性循环加剧,进而造成不良妊娠结局[16]。有研究称,氧化应激可致使先兆子痫患者htr-8/svneo细胞的侵袭性降低,但具体机制不明[17]。这些结果表明在htr-8/svneo细胞中,NQO1水平随着Nrf2水平变化而变化,氧化应激过程中NQO1水平的改变可增强(或减弱)htr-8/svneo细胞的侵袭性。
综上所述,子痫前期患者的Nrf2、NQO1下降,其会导致机体抗氧化能力减弱,在氧化应激条件下,Nrf2可激活NQO1从而使HTR-8/SVneo细胞侵袭力增强。

