一种少见的多发性硬化影像学表现并文献复习
刘凤霞,谢祎,刘举,赵志华,刘洪波,谢南昌
多发性硬化(multiple sclerosis,MS)是一种由免疫介导的慢性中枢神经系统炎性脱髓鞘性疾病,磁共振成像(magnetic resonance imaging,MRI)是诊断MS的重要工具。脑型MS病灶多表现为T1WI等或略低信号,T2WI 高信号[1]。MS 在 T1WI 出现类脑脊液信号强度的黑洞较为少见[2],现将我院神经内科近期收治的2例以急性期类脑脊液信号强度黑洞为特征表现的MS病例结合文献复习报道如下。
1 资料与方法
1.1 临床资料
病例1,男性,46岁,以“言语不清伴右侧肢体无力半月”为主诉于2020年2月17日入院。半月前患者无明显诱因出现言语不清伴右侧肢体无力,尚可持物、行走,自觉右手心、右足心发热,症状持续不缓解,无发热、头晕、头痛,无视物模糊、饮水呛咳、吞咽困难,无胸腹部束带感、大小便障碍。患者于2020年2月11日就诊于郑州某医院,行颅脑MRI平扫示:两侧大脑半球多发囊状信号,周围少许水肿,感染性病变可能,肿瘤性病变待排,给予中药治疗(具体不详),症状稍好转,为求进一步诊治来我院。既往高血压病5年,间断服用替米沙坦片,自述控制可;饮酒史20年,平均50 g/d。查体:心肺腹无异常,神志清楚,语言欠清晰,高级智能活动正常;示齿口角左歪,伸舌右偏,余颅神经检查正常;右上肢近端肌力5级,右手肌力4级,右下肢肌力4级、左侧肢体肌力5 级,四肢肌张力正常,四肢腱反射(++),双侧Babinski征(-),双侧Chaddock征(-);共济运动稳准,Romberg 征(-),步态正常,无不自主运动;右手心、足心烧灼感,其余深、浅感觉系统检查(-);脑膜刺激征(-)。辅助检查:血、尿、便常规无明显异常,血生化、凝血功能、血同型半胱氨酸、维生素B12、叶酸、甲状腺功能全套、结缔组织全套无异常,肿瘤标志物:肿瘤相关抗原72-4:10.63 U/mL(参考值:0~6.9 U/mL),其余正常;脑脊液细胞、常规生化无异常,脑脊液电泳:IgG 指数正常,等电聚焦寡克隆区带Ⅰ型,脑脊液病毒全套、囊虫抗体阴性,血清水通道蛋白-4、MOG 抗体、GFAP 抗体阴性,血清及脑脊液自身免疫性脑炎抗体(NMDA 抗体、AMPA1 抗体、AMAP2 抗体、CASPR2 抗体、LGI1 抗体、GABARB1 抗体)阴性。心电图、胸部CT、腹部彩超未见明显异常,颈胸椎MRI平扫未见明显病变,2020 年2 月 18 日磁共振波谱(MRS)/脑平扫+增强/脑动脉血管成像(MRA)平扫示:双侧额顶叶、双侧侧脑室旁、双侧基底节区及双侧丘脑可见多发异常信号影,增强扫描示多发异常信号可见明显边缘强化(图1),考虑为脱髓鞘病变;2020年3月4日MRI脑平扫+增强示:双侧额顶叶、双侧侧脑室旁、双侧基底节区及双侧丘脑可见多发片状稍长或长T2信号影,增强扫描示脑实质内多发病变未见明确强化;2020 年 4 月 30 日复查 MRI 脑平扫+增强示病变范围较前明显减小,左侧丘脑可见强化,余脑实质内多发病变未见明显强化(图2)。治疗:2020年2月21日给予甲泼尼龙1 g,1次/天,冲击治疗3 d,阶梯式减量至80 mg/d,改为泼尼松口服,后继续缓慢减量,辅以营养神经、降脂、护胃、改善症状等对症支持治疗。患者出院时言语不清及肢体无力等症状明显改善。
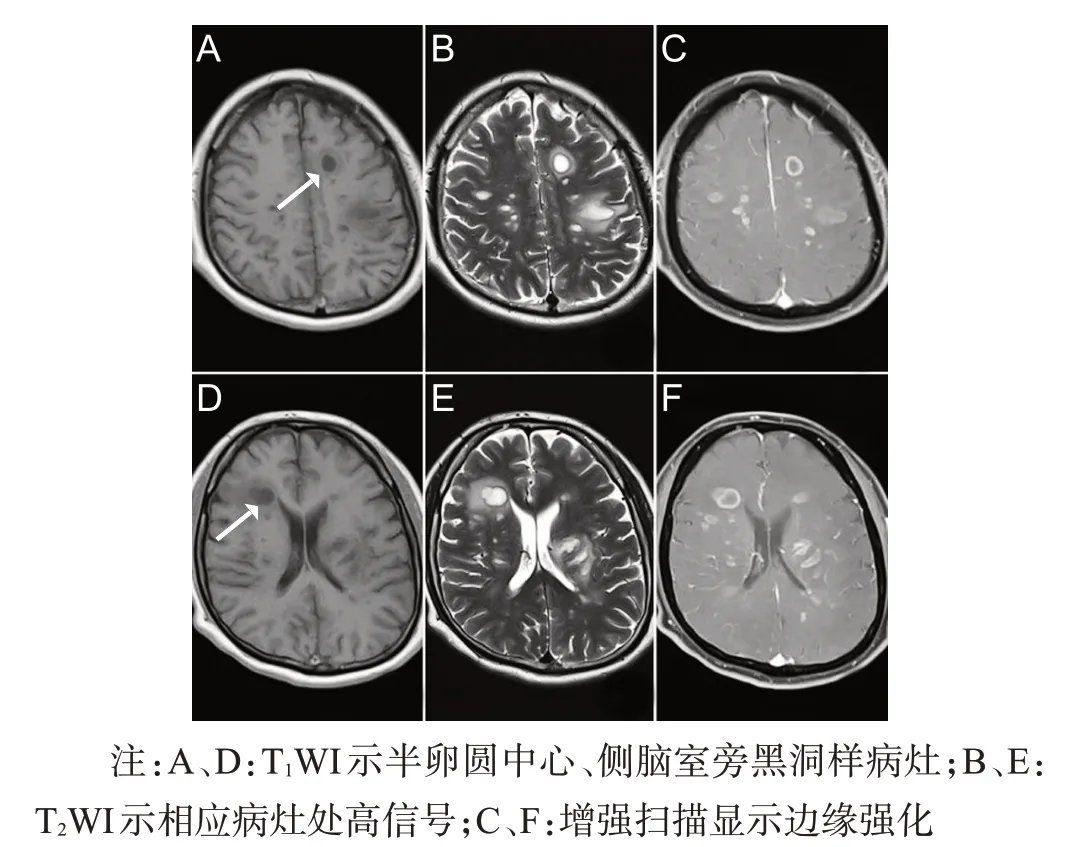
图1 病例1 2020年2月18日头颅MRI

图2 病例1 2020年4月30日头颅MRI
病例2,女性,14 岁,以“言语减少伴四肢无力4 d”为主诉于2020年5月13日入院。4 d前患者无明显诱因出现言语减少伴四肢无力,行走需人搀扶,伴头痛、小便失禁,无发热、恶心、呕吐,无视物模糊、饮水呛咳、吞咽困难,无肢体麻木、疼痛。于当地查头颅MRI示颅内多发异常信号影,为求进一步诊治来我院。既往史及个人史无特殊。查体:心肺腹无异常,神志清楚,言语减少,语速减慢,高级智能活动正常;颅神经检查(-);右上肢近端肌力3级,右手肌力2 级,右下肢肌力3 级,左上肢肌力5级,左下肢肌力4 级,四肢肌张力增高,四肢腱反射(+++),双侧Babinski征(+),双侧Chaddock征(+);共济运动查体欠配合,无不自主运动;深、浅感觉系统检查(-);脑膜刺激征(-)。辅助检查:血、尿、便常规无异常,血生化、凝血功能、炎症指标、血同型半胱氨酸、维生素B12、叶酸、甲状腺功能全套、结缔组织全套、肿瘤标志物均无异常,脑脊液细胞学检查正常,蛋白定性(+),蛋白定量887.6 mg/L(参考值150~450 mg/L),脑脊液电泳:白蛋白商值5.83×10-(3参考值<5.0×10-3)、24 h 鞘内合成率4.69 mg/24 h(参考值-9.9~3.3 mg/24 h)、等电聚焦寡克隆区带Ⅱ型,脑脊液病毒全套、囊虫抗体、抗结核抗体、抗酸染色、墨汁染色均阴性,血清水通道蛋白-4、MOG抗体、GFAP抗体阴性,血清及脑脊液自身免疫性脑炎抗体(NMDA抗体、AMPA1抗体、AMAP2抗体、CASPR2 抗体、LGI1 抗体、GABARB1 抗体)阴性。心脏超声、胸部CT、腹部彩超、双眼视觉诱发电位未见异常,甲状腺彩超示双侧囊性结节(2级),颈胸椎MRI平扫未见明显病变,2020年5月15日MRI平扫+增强/MRS示双侧额顶颞枕叶、双侧侧脑室旁、双侧基底节区,右侧丘脑可见多发片状长T1长T2信号,增强扫描呈环形、斑片状强化(图3);2020 年6 月2 号磁共振弥散张量成像(DTI)示多部位纤维束稀疏或中断;2020年7月8日颅脑MRI 平扫+增强示病灶范围明显缩小,增强扫描未见明显强化(图4)。治疗:2020年5月17日给予甲泼尼龙1 g,1次/天,冲击治疗3 d,阶梯式减量至60 mg/d,改为泼尼松口服,后继续缓慢减量,辅以改善循环,营养神经及对症支持治疗。患者出院时言语减少、肢体无力等症状明显改善。
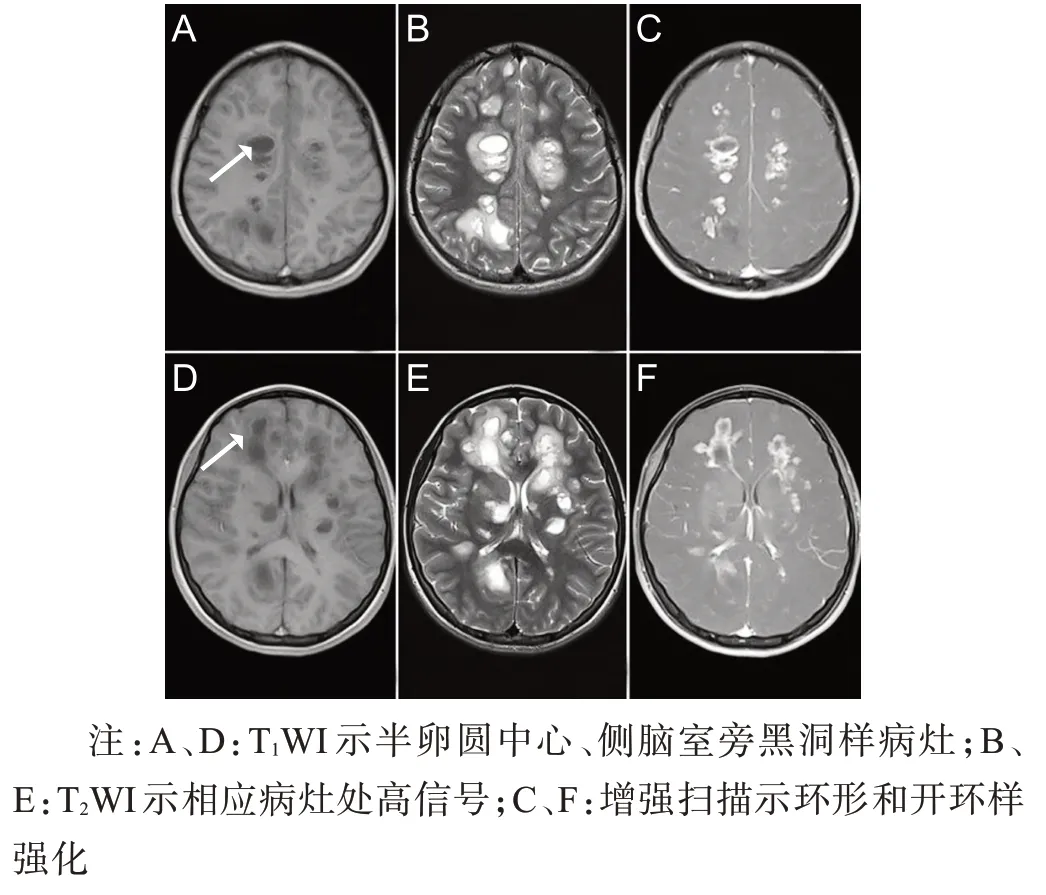
图3 病例2 2020年5月15日头颅MRI
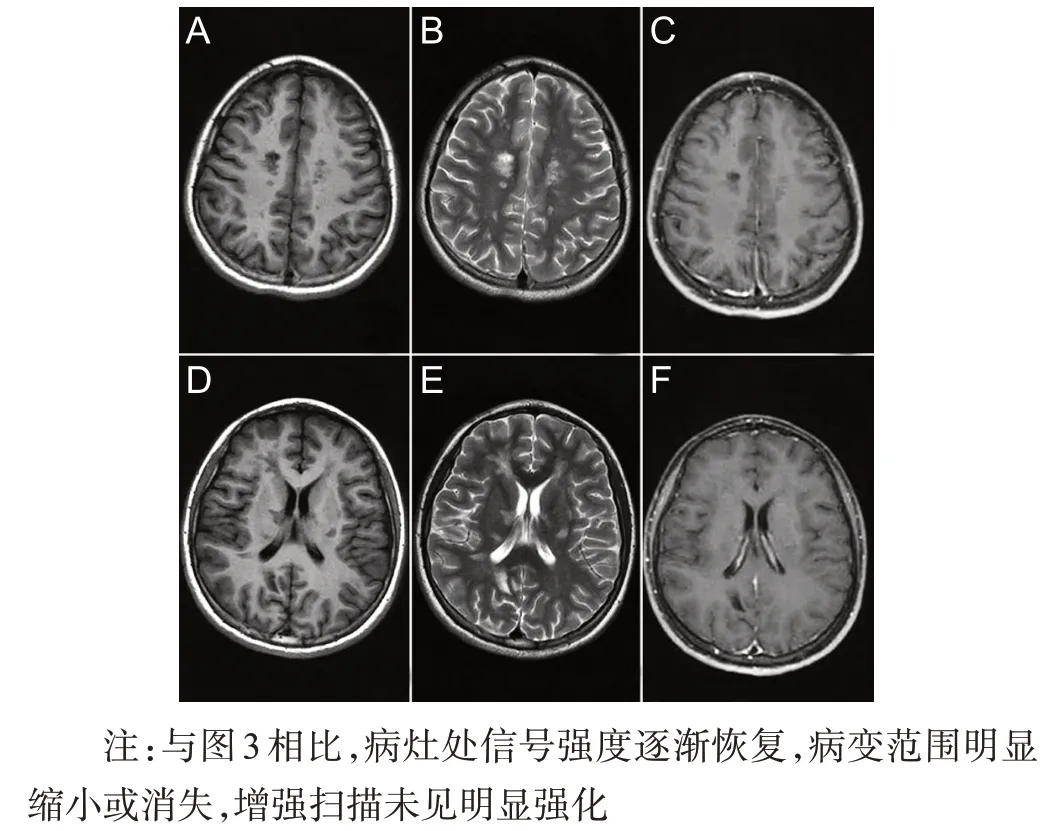
图4 病例2 2020年7月8日头颅MRI
1.2 方法
通过 pubmed 数据库,以“multiple sclerosis”“acute black holes”为关键词进行搜索,收集相关文献(检索时间截至2021年8 月19 日),得到所有关于MS 患者急性期黑洞的相关病例报道。对符合条件的所有病例从影像学特点进行分析。
2 结果
共检索出66例存在急性期黑洞的MS患者,排除慢性黑洞或黑洞定义不明确者9 例,共纳入57 例患者。71%的急性期黑洞发生在深部白质;所有的病例最初MRI 扫描均表现出强化,经过常规治疗后,随访发现黑洞病灶强化消失。40%的患者黑洞持续存在,约60%的患者在12个月之内黑洞逐渐消失。
3 讨论
笔者根据临床症状、实验室检查、MRI 的影像学特点、随访结果,在排除其他疾病的基础上,对2 例患者做出了MS 的诊断[3]。2例患者的年龄在10~50岁之间,急性起病,均以肢体无力为首发症状,MRI 显示双侧侧脑室旁多发长T1长T2信号,两病例MRI均显示出空间多发性,病例1在随访中出现新的钆增强病灶,病例2 脑脊液电泳寡克隆区带阳性,符合2017 版McDonald诊断标准[4]。笔者通过炎症指标、寄生虫抗体、风湿免疫全套、自身免疫性脑炎抗体、水通道蛋白-4等检验结果及颈胸椎MRI平扫排除了感染性疾病、结缔组织病及其他自身免疫性疾病。虽然本文两例患者及家属均拒绝脑活检,但根据对激素冲击治疗的反应、随访中病情和MRI 病灶变化,排除了淋巴瘤等肿瘤性病变。
本文中两例患者的MRI在MS急性期显示出数个类脑脊液信号强度病灶,这是少见的。这些病灶呈圆形或卵圆形,边界较清晰,增强扫描显示出边缘强化或环形强化,激素治疗后病灶明显缩小或消失。通常认为,MS 急性期组织病理学以水肿、炎症、轻度脱髓鞘为特征;慢性期表现为严重的脱髓鞘、胶质细胞增生和大量轴突丢失[5]。Bitsch等[5-7]的研究证实MS急性期存在髓鞘脱失及轴突损伤,且脱失、损伤程度越大,在T1WI上信号强度越低,在严重的病变中甚至会表现为囊性组织坏死[8]。两例患者MRS结果显示,与正常脑组织相比,病灶处的N-乙酰天门冬氨酸(N-acetyl-aspartate,NAA)存在不同程度的降低,NAA作为轴突的体内标记物,它的降低提示轴突的损害;病例2 DTI显示出多部位纤维束稀疏或中断。不同的磁共振成像技术都反映出MS急性期即存在轴突的丢失。因此,推测2例患者急性期的组织病理学过程包括组织水肿、炎症、严重的脱髓鞘和轴突丢失。这些病理过程使细胞外间隙扩大,延长了T1的弛豫时间,在MRI 中表现出类脑脊液信号强度病灶。笔者在随访中发现类脑脊液信号强度黑洞逐渐向正常信号值恢复、病变范围明显缩小或消失,分析原因可能与急性期的水肿、炎症的消退及广泛的再髓鞘化有关[9];急性期的激素冲击治疗,限制了炎症因子对神经轴突的攻击[10]。
在临床工作中,MS 应注意与急性播散性脑脊髓炎(acute disseminated encephalomyelitis,ADEM)、原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)、脑囊虫病相鉴别。ADEM多有前驱感染史或疫苗接种史,在儿童早期发病率高,中位年龄为5~8岁,在成人中很少发生,临床诊断强调全脑症状表现包括意识水平改变、行为或认知改变,寡克隆区带阳性较罕见,其同样对激素冲击治疗敏感,但ADEM 典型影像学表现不会出现黑洞[11-13]。PCNSL通常表现为持续数周的认知或行为改变、局灶性神经功能缺损和颅压升高,在免疫功能正常的患者中,PCNSL患者MRI增强扫描大多显示明显且均匀强化的单一病灶,边界清晰,伴周围中度水肿[14]。发生于脑实质的囊虫病,一般以癫痫发作为主要表现[15],在囊尾蚴存活期,MRI 上表现为类脑脊液信号强度的长T1长T2信号,周围无水肿,增强扫描无强化,退变死亡期,由于虫体变形坏死产生的炎症反应,周围常伴有明显水肿,增强扫描显示出环形强化[16]。通过临床资料与影像学特征相结合,临床医生应尽早识别类脑脊液信号强度病灶,及时予以正确的药物治疗,以免延误病情。
MS在急性期出现类脑脊液信号黑洞可能是多种病理过程共同作用的结果,其同样对激素冲击治疗反应良好。临床上应提高对MS 急性期此种影像学表现的认识,注意与ADEM、PCNSL、脑囊虫病相鉴别,及早明确诊断并进行积极治疗,阻止其向慢性黑洞演变,以免造成永久性神经功能缺损。

