肾上腺皮质癌中CENPF基因的表达及对患者治疗和预后的影响
王 莉,李 丹,唐 凯,黄育刚
肾上腺皮质癌(adrenocortical carcinoma,ACC)是一种发生于肾上腺皮质的较为罕见的恶性肿瘤,易发生局部浸润和转移,约占原发性肾上腺瘤的14%[1]。ACC患者预后较差,有局部晚期疾病的ACC患者5年生存率为35%~50%,有远处转移患者的5年生存率为0~28%[2]。目前,外科手术或基于米托坦-铂的化学疗法仍然是唯一有效的治疗策略[1-3]。因此,提高ACC的早期诊断率、发现评估预后的新指标和抗肿瘤治疗的新靶点已成为ACC研究的焦点。着丝粒蛋白F(centromere protein F,CENPF)是细胞周期相关核抗原,参与细胞周期的调控[4-5]。研究表明,CENPF参与多种肿瘤的发生,包括肝癌[6]、乳腺癌[7]、前列腺癌等[8];但国内外鲜有CENPF在ACC中表达的报道。本文根据肿瘤基因相关公共数据库对ACC中CENPF的表达、预后的相关性及生物学功能进行初步分析,以提高临床与病理医师对ACC的认识水平,为ACC的预后或治疗提供参考。
1 材料与方法
1.1 临床资料收集2011年1月~2021年5月湖北省十堰市太和医院/湖北医药学院附属医院病理科ACC 6例、肾上腺皮质腺瘤12例及正常肾上腺皮质12例(对照组),患者均有完整的临床病理资料,术前均未行放、化疗。本实验经我院伦理委员会批准,患者或家属均知情同意。
1.2 免疫组化手术标本均经10%中性福尔马林固定,石蜡包埋,4 μm厚连续切片,常规HE、免疫组化EnVision两步法染色。兔抗人CENPF一抗(Abcam公司,稀释比1 ∶500)37 ℃孵育60 min,HRP二抗(福州迈新公司)37 ℃孵育30 min,苏木精复染30 s。光镜下观察CENPF蛋白的表达,每个组织随机选择3个视野(400×)进行计数,并计算CENPF阳性细胞百分比,即CENPF阳性细胞率=CENPF阳性细胞计数/肿瘤细胞计数×100%。所有切片均经两位病理医师采用双盲法阅片。
1.3 细胞系RNA干扰实验及RT-PCR设计干扰性小分子RNA(siCENPF),探讨CENPF在人ACC细胞系SW13细胞中的功能。用50 nmol/L的CENPF-siRNA(siCENPF组)或对照siRNA(siNC)分别转染人SW13细胞48 h。siCENPF引物:5′-GACCCA GAAACUAGCUUAUTT-3′;siNC引物:5′-UUCUCCGA ACGUGUCACGUTT-3′。使用TRIzol试剂(美国Invitrogen公司)从SW13细胞中提取总RNA。利用Oligo(dT)引物和逆转录酶生成的cDNA,运用QuantiTect-SYBR-Green-PCR-Master-Mix试剂盒(德国Qiagen公司)和ABI-Prism 7000分析仪(美国Applied Biosystems公司)行实时定量PCR检测。CENPF:正向引物5′-AGCACTGATCACCTGTTAGC-3′,反向引物5′-ACCCACATACAAACAGAGATTG-3′;内参基因GAPDH:正向引物5′-CGGAGTCAACGGATTTG GTCGTAT-3′,反向引物5′-AGCCTTCTCCATGGTG GTGAAGAC-3′。所有实验均重复3次,使用2-ΔΔCt法计算siCENPF组和对照组中CENPF mRNA水平,引物均由上海生工生物公司合成。
1.4 Western blot法用siCENPF和siNC分别转染人SW13细胞48 h,收集细胞,提取蛋白。加入CENPF一抗(Abcam公司,稀释比1 ∶500),4 ℃孵育细胞膜过夜;与HRP二抗结合的IgG抗体室温下孵育1.5 h。ECL化学发光试剂盒显色。
1.5 CCK-8细胞增殖实验将人SW13细胞以100 μL(合计2×103个细胞)接种于96孔板,分别转染50 nmol/L的siCENPF和siNC。向每孔中添加10 μL CCK-8试剂(上海碧云天生物公司)。细胞在培养箱中培养24、48、72和96 h,分别测量各时间点在450 nm处的吸光度值(OD)。
1.6 划痕试验将人SW13细胞接种于DMEM(含10%胎牛血清)的12孔板中,用50 nmol /L siCENPF和siNC分别转染细胞48 h。用20 μL移液管尖划痕;每孔再用PBS冲洗5次,以清除划痕上的漂浮细胞,并向每孔中添加3 mL 10%FBS、含1%抗生素的DMEM。在0、48 h拍摄划痕区域,48 h内细胞迁移的宽度=0 h划痕宽度-48 h划痕宽度。
1.7 肿瘤数据库的信息分析本实验根据GEO数据库查询与ACC研究相关的所有数据集,研究资料包括人ACC及其邻近或正常肾上腺皮质组织,筛选得到数据集:GSE90713。在GEPIA基因数据服务平台可检索到 TCGA数据库和GTEx项目的79例ACC和128例正常样本的RNA测序表达数据。本实验应用GEPIA平台进行肿瘤及正常组织中CENPF的差异表达、病理分期、CENPF相关的表达、基因相关性及患者生存分析。
1.8 统计学分析采用SPSS 25.0软件进行统计学分析,应用t检验对正常组织与ACC组织中CENPF的表达差异进行比较。采用单因素方差分析(One-way ANOVA)进行多组间比较;应用χ2检验或Fisher精确概率法分析CENPF表达与临床病理特征的关系。采用Kaplan-Meier生存曲线分析CENPF表达对ACC患者预后的影响;应用Log-rank检验比较两组间的生存差异;并用Cox回归模型分析CENPF表达对生存期及临床特征(分期、分级等)的影响。以P<0.05为差异有统计学意义。
2 结果
2.1 正常肾上腺组织、肾上腺皮质腺瘤及ACC组织中CENPF的表达肾上腺皮质腺瘤的结节切面呈金黄色、质硬(图1A);ACC切面的包膜完整或有缺陷,一些区域呈灰红色,有坏死(图1B)。HE染色示:正常肾上腺皮质的网状带细胞,胞质呈嗜酸性颗粒,细胞排列无特征性,空泡状、核仁小(图2A)。肾上腺皮质腺瘤肿瘤细胞呈巢、团状分布,胞质丰富,呈嗜酸性,可见小核仁(图2B)。ACC细胞呈片状或大的巢、团状排列,被纤细的窦系网状结构分隔,癌细胞生长密集,核仁清楚(图2C)。免疫组化检测显示:CENPF在肾上腺皮质腺瘤组和正常肾上腺组中均呈低表达或不表达(图3A、B),在ACC中呈核表达,且表达量显著高于肾上腺皮质腺瘤及正常肾上腺组织(图3C)。CENPF在ACC组织中的阳性率显著高于正常肾上腺皮质、肾上腺皮质腺瘤(图4)。本组6例ACC中CENPF均阳性,其中5例CENPF的阳性细胞率>10%,1例CENPF的阳性细胞率约8%。而CENPF在肾上腺皮质腺瘤及对照组中大多数不表达(阳性细胞率0~2%)。
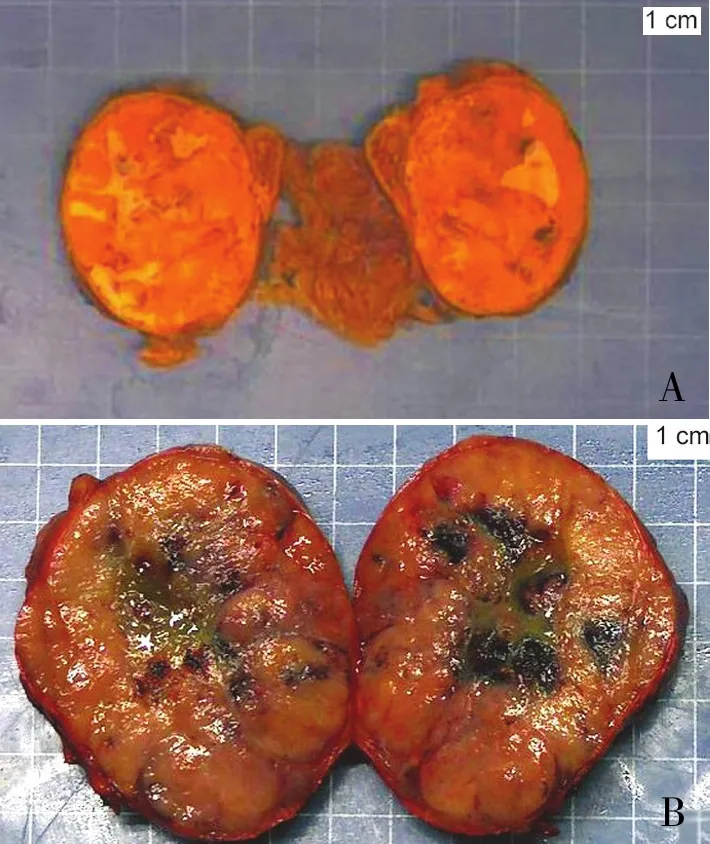
图1 A.肾上腺皮质腺瘤的结节切面呈金黄色、质硬;B.肾上腺皮质癌切面的包膜完整或有缺陷,一些区域呈灰红色,有坏死

图2 A.正常肾上腺皮质的网状带细胞,胞质呈嗜酸性颗粒,细胞无特征性排列,空泡状、核仁小;B.肾上腺皮质腺瘤的肿瘤细胞呈巢、团状分布,胞质丰富,呈嗜酸性,可见小核仁;C.肾上腺皮质癌肿瘤细胞呈片状或大的巢、团状排列,被纤细的窦系网状结构分隔,癌细胞生长密集,核仁清楚 图3 A.CENPF在正常肾上腺皮质中低表达;B.CENPF在肾上腺皮质腺瘤中不表达;C.CENPF在肾上腺皮质癌中的染色呈核表达(红色箭头),EnVision两步法

图4 不同肾上腺皮质组织中CENPF的表达:***P<0.001,ns为P>0.05
2.2 ACC中CENPF的表达差异为进一步验证CENPF在ACC中的表达,对GEO数据集应用GEO2R进行表达差异分析,GSE90713数据集包含5例正常肾上腺皮质组织和58例ACC组织。在GSE90713研究芯片中,CENPF mRNA在ACC中的表达量高于正常肾上腺皮质组织(P=0.000 7,图5A)。在GEPIA平台中,数据库包含128例正常肾上腺皮质组织和79例ACC组织。本组结果显示:CENPF mRNA在ACC中的表达量高于正常肾上腺皮质(P<0.05,图5B)。此外,根据GEPIA平台的分析显示,在ACC患者中CENPF mRNA表达量与临床分期(Ⅰ、Ⅱ、Ⅲ、Ⅳ)呈正相关(P=0.000 174,图5C)。这表明CENPF异常表达与ACC的恶化程度或疾病进展相关。

图5 肾上腺皮质癌中CENPF表达的差异:A.GSE90713的分析;B.GEPIA平台的分析:*P<0.05;C.CENPF mRNA表达量与TNM分期的分析
2.3 ACC中CENPF 表达与临床病理特征的关系根据TCGA肿瘤数据库中CENPF mRNA表达的中位值,将79例ACC分为低表达组(39例)和高表达组(40例),分析CENPF表达与患者性别、年龄、临床分期、病理分级等相关性。在ACC中,CENPF表达与患者年龄、性别、肿瘤发生位置无关(P>0.05,表1)。随着临床分期升高,CENPF高表达者显著多于CENPF低表达者(尤其是TNM分期 Ⅲ、Ⅳ期,P<0.001)。CENPF高表达者更易发生肿瘤复发(P<0.001,表1)。肿瘤发生淋巴结转移的患者中,CENPF高表达者明显多于CENPF低表达者(P<0.001,表1)。

表1 肾上腺皮质癌中CENPF表达与临床病理特征的关系
采用Cox单因素、多因素回归分析,CENPF与患者年龄、性别、分级、TNM分期、发生肿瘤复发等临床因素对ACC患者预后的影响。Cox单因素回归分析显示:CENPF和TNM分期与ACC患者的预后相关(P<0.01,表2)。Cox多因素回归分析显示:CENPF和TNM分期可能是ACC患者的独立预后因素(P<0.01,表2)。

表2 肾上腺皮质癌中CENPF的Cox单因素、多因素回归分析
2.4 ACC中CENPF表达与预后的关系为进一步分析CENPF基因表达与ACC患者预后的关系,根据CENPF mRNA表达的中位值将ACC患者分为CENPF高表达组和CENPF低表达组,应用GEPIA平台绘制生存曲线。结果显示:CENPF表达与患者预后,即总生存率、无进展生存率均呈显著负相关(HR=8.88,P=0.000 24;HR=4.12,P=0.001 7,图6)。

图6 肾上腺皮质癌中CENPF表达与患者预后的关系 A.CENPF表达与肾上腺皮质癌患者总生存率的关系;B.CENPF表达与肾上腺皮质癌患者无进展生存率的关系
2.5 CENPF在细胞系SW13中的RNA干扰实验为探索CENPF基因在ACC发生、发展中的生物学功能,本实验构建了CENPF的表达抑制体系,应用人SW13细胞转染siCENPF后,siCENPF组中CENPF mRNA(P<0.01,图7A)和蛋白(P=0.001 1,图7B、C)的表达显著被抑制,表明CENPF表达干扰体系构建成功。CCK-8细胞分裂实验结果显示:与siNC组相比,抑制CENPF表达(siCENPF)的SW13细胞生长速度显著受到抑制(P<0.01,图8)。划痕实验结果显示:与siNC相比,抑制CENPF表达(siCENPF)后,SW13细胞的迁移速度显著受到抑制(P=0.005 3,图9)。

图7 CENPF在肾上腺皮质癌细胞SW13中的siRNA体系的建立:A.实时定量PCR检测CENPF mRNA相对表达,**P<0.01;B.Western blot检测CENPF蛋白的表达;C.蛋白表达的灰度值分析

图8 CCK-8细胞增殖能力实验:检测CENPF对SW13细胞增殖的影响:**P<0.01,*P<0.05

图9 划痕实验分析CENPF对SW13细胞迁移能力的影响
3 讨论
ACC是一种较为少见的恶性肿瘤,文献报道较少[9-10]。目前,外科手术、化疗分别是治疗早、晚期ACC的主要方式。近年大量文献表明:WNT-β-catenin、p53-RB信号通路、错配修复相关酶的缺陷和TERT基因表达异常,与ACC的疾病进展及预后相关[11-13]。但这些基因异常表达或信号异常调控只存在于ACC少部分患者中[10],因此寻找ACC发生、发展的关键分子或靶点,对治疗ACC具有重要的临床意义。
近年越来越多的证据表明,CENPF的过度表达或激活是恶性肿瘤的常见行为,与肝癌、乳腺癌、前列腺癌等多种肿瘤的恶化和预后不良密切相关。然而,CENPF在ACC患者中的表达模式和确切作用尚不清楚,其分子机制和功能也未见报道。本组通过对临床样本及肿瘤数据库(GEO和GEPIA)中CENPF相关基因信息的分析,发现CENPF在ACC中显著高表达,CENPF基因高表达与TNM分期呈正相关、与患者预后呈显著负相关;表明CENPF表达可能促进ACC的疾病进展。此外,在ACC中CENPF表达与TNM分期、肿瘤复发、是否发生淋巴结转移密切相关(P<0.001);与患者年龄、性别、肿瘤发病部位无关(P>0.05)。CENPF表达、TNM分期与ACC患者的预后相关,且可能是ACC患者的独立预后因素。在ACC中CENPF可能通过调控细胞的分裂、迁移,促进ACC的发生或进展。以上结果拓展了ACC的相关研究,分析CENPF与ACC发病及进展的相关性,为下一步的分子机制实验研究提供线索与依据。本文也存在一定的局限性,由于收集样本量较少,CENPF与ACC发病及进展的相关性、预后信息等皆以生物信息学分析为基础,故以上结论仍需要进一步的分子实验及临床样本来验证。

