CNN2通过上皮-间质转化促进结直肠癌细胞的侵袭与迁移
郭静宇,王祎丽,千新来,朱会芳
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤,其发病率有逐年上升趋势[1]。我国最新研究数据显示:随着肿瘤早期筛查工作的开展以及新的治疗方法应用,CRC的病死率有所下降,但是其发病率却明显上升且日益年轻化[2]。CNN2(calponin 2)是一种肌动蛋白细胞骨架结合蛋白,可以结合肌动蛋白、钙调蛋白、肌钙蛋白和肌球蛋白[3],参与细胞骨架形成、肌肉收缩和细胞黏附[4]。目前,CNN2在肿瘤的发生及进展中报道并不一致[5-8]。本文着重探讨CNN2在CRC细胞中的表达及其侵袭和转移中的作用,以期为CRC的临床治疗提供新的理论基础。
1 材料与方法
1.1 材料
1.1.1结直肠癌组织 收集2017~2021年我院病理科保存的30例结直肠癌石蜡标本。其中男性15例,女性15例,年龄35~65岁。肿瘤分化程度:低分化5例,中分化12例,高分化13例;TNM分期:Ⅰ~Ⅱ期15例,Ⅲ~Ⅳ期15例;淋巴结转移:有转移17例,无转移13例。入选标准:(1)结直肠癌;(2)术前未接受放、化疗;(3)石蜡标本经HE染色示具有结直肠癌及癌旁正常组织结构。
1.1.2细胞系 人正常结直肠细胞NCM460和人CRC细胞株HCT116、SW620、HCT-8、RKO、LOVO、DLD-1,均由本实验室自主保存。
1.1.3主要试剂 DMEM高糖培养基,购自美国Hyclone;胎牛血清(fetal bovine serum,FBS),购自美国Gibco公司;胰蛋白酶购自上海索莱宝生物公司。蛋白裂解液、BCA测蛋白浓度工作液、5×SDS蛋白上样缓冲液、SDS凝胶试剂盒,均购自上海碧云天公司。蛋白Marker购自美国Thermo公司;GAPDH单克隆抗体、E-cadherin、N-cadherin和vimentin抗体,均购自Proteintech公司;CNN2多克隆抗体购自美国Abcam公司;SP免疫组化超敏试剂盒及DAB显色剂,均购自北京中杉金桥公司。ECL超灵敏化学发光液,购自上海雅酶公司;PVDF膜购自美国GE公司;Trizol、逆转录试剂盒及实时荧光定量试剂盒,均购自Takara公司。
1.2 方法
1.2.1免疫组化 采用免疫组化SP法检测CNN2和E-cadherin蛋白的表达。标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,5 μm厚切片,脱蜡及水化,抗原修复、封闭、滴加一抗等,用PBS缓冲液代替一抗作为阴性对照,用已知阳性标本作为阳性对照,具体操作步骤严格按SP及DAB显色剂说明书进行。
结果判定:由两名病理科医师独立完成阅片和判读,每张切片随机选取5个高倍视野。CNN2抗体阳性着色分布于细胞质,呈棕黄色颗粒。E-cadherin抗体阳性着色分布于细胞膜,呈棕黄色。(1)根据阳性细胞染色强度计分:未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。(2)根据阳性细胞百分率计分:阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。两者得分相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(),>8分为强阳性();其中(-)和(+)为低表达,()和()为高表达。
1.2.2细胞培养与转染 复苏本实验室保存的人正常结直肠细胞NCM460和人CRC细胞株HCT116、SW620、HCT-8、RKO、LOVO、DLD-1,使用含10% FBS的DMEM高糖培养基,在37 ℃、5% CO2培养箱中常规传代培养,选择处于生长对数期的细胞作为研究对象。
细胞转染:取对数生长期的CRC细胞HCT-8、HCT116,胰酶消化并接种于6孔板中,使细胞汇合度达40%~50%时进行转染。转染前用PBS冲洗6孔板洗2次,加入1.5 mL的opti-MEM培养基,然后每孔另配0.5 mL的转染体系。每孔对应2个EP管,均加入0.25 mL opti-MEM培养基,2个管中分别加入10 μL转染终浓度为50 nmol/L的siRNA和5 μL Lipofectamin 2000脂质体混匀,静置5 min。将opti-MEM-siRNA和脂质体混合,离心20 s后静置20 min形成转染复合物,将复合物均匀的加入6孔板中,培养6~8 h,换成含血清无双抗的培养基。常规培养24 h后可收集细胞团提取RNA,48 h后可收集细胞团提取蛋白。细胞分组:对照组(NC组)、干扰CNN2组(si-CNN2组)。
1.2.3qRT-PCR法 取对数生长期的人正常结直肠细胞NCM460和人CRC细胞HCT116、SW620、HCT-8、RKO、LOVO、DLD-1,按照Trizol试剂盒说明书提取细胞总RNA,分光光度计测量总RNA浓度及纯度,取1 μg RNA按照逆转录试剂盒说明书将其逆转录成cDNA。按照SYBR Master Mix试剂盒说明书进行qRT-PCR检测。CNN2引物序列:CNN2正义链:5′-ATCAAGGCCATGGTCAGCTA-3′;CNN2反义链:5′-ATGGTGGCATCGTCGAAATT-3′。根据2-ΔΔCt值计算相对表达量,实验重复3次,计算平均值。
1.2.4Transwell小室实验检测细胞的侵袭能力 收集对数生长期的干扰组si-CNN2 CRC细胞以及对照组si-NC细胞,先用胰酶消化各组细胞,然后用无血清的DMEM培养基重悬细胞,制成单细胞悬液。将200 μL单细胞悬液(含1×105个细胞)接种于Transwell小室的上室;用500 μL含10%胎牛血清的DMEM完全培养基作为趋化因子置于下室,于37 ℃、5% CO2培养箱内孵育48 h;4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,用棉签轻轻擦拭上层未迁移细胞,PBS冲洗3次,将膜用刀片划下置于可吸附载玻片上,滴加中性树胶封固,在正置光学显微镜下选取不同视野进行计数并拍照。最后,取均值并进行统计学分析。
1.2.5划痕愈合实验检测细胞的迁移能力 取对数生长期的干扰组si-CNN2 CRC细胞以及对照组NC细胞,用胰酶消化转染后的各组细胞制成单细胞悬液。然后将两组细胞接种于6孔板中(按5×105个/孔),将不同组的细胞置于37 ℃、5% CO2培养箱中常规培养;待细胞的融合达90%时,用10 μL的无菌枪头划板,弃去原培养基,用PBS轻洗3次。最后于倒置显微镜10倍视野下取点,分别记录划板0、24、48 h痕迹宽度的不同变化。同时,利用Image J软件测量其细胞的迁移距离,并计算细胞的迁移率。计算方法:细胞迁移率=(24 h划痕宽度-0 h划痕宽度)/0 h划痕宽度×100%。
1.2.6Western blot法 收取转染常规培养48 h后的HCT116、HCT-8细胞团以及对应的对照组细胞团,加入适量细胞裂解液,蛋白酶抑制剂后置于冰上裂解30 min,离心收取蛋白上清。用BCA蛋白检测试剂盒,检测并计算蛋白上样量。常规配置10%分离胶和5%浓缩胶,按照计算的上样量上样,80 V 30 min电泳至蛋白Marker分离,调至120 V跑分离胶。用PVDF膜按三明治结构顺序进行转膜,结束转膜后用5%脱脂牛奶封闭1 h。裁剪对应分子量常规敷抗体,用曝光仪曝光条带。
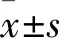
2 结果
2.1 CRC和癌旁正常组织中CNN2蛋白的表达及与临床病理特征的关系CNN2阳性定位于细胞质和细胞膜;30例CRC中CNN2高表达23例,低表达7例,提示CRC组织中CNN2的表达明显高于癌旁正常肠黏膜组织(P<0.001,表1,图1)。本组分析CRC组织中CNN2表达与临床病理特征的关系,结果显示:CNN2表达与患者性别(P=0.464)、年龄(P=0.713)和分化程度(P=0.076)均无关;与肿瘤的淋巴结转移(P=0.010)及TNM分期(P=0.014)有关(表2)。
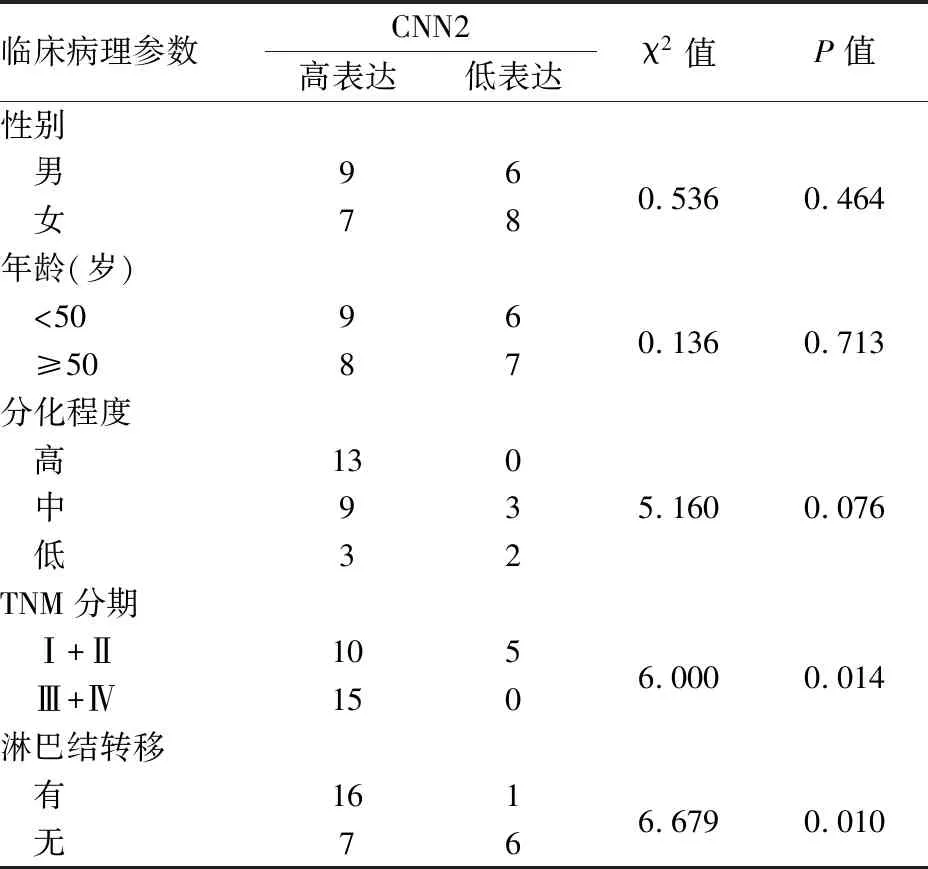
表2 结直肠癌中CNN2表达与临床病理特征的关系
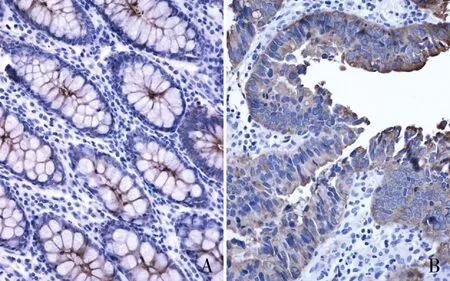
图1 CNN2在癌旁正常组织及结直肠癌组织中的表达:A.CNN2在癌旁正常组织中的表达;B.CNN2在结直肠癌组织中的表达,SP法

表1 结直肠癌及癌旁正常组织中CNN2的表达
2.2 不同CRC细胞株中CNN2 mRNA的表达采用qRT-PCR法检测CNN2 mRNA在正常人结直肠细胞NCM460和6种不同CRC细胞株中的表达。结果显示:与正常结直肠细胞NCM460相比,CRC细胞株HCT116、SW480、SW620、HCT-8、RKO、LOVO、DLD-1中CNN2的相对表达量分别为4.143±0.607、3.753±0.277、2.495±0.209、2.533±0.306、5.822±0.475、9.615±0.478;提示与正常结直肠细胞相比,CNN2在CRC细胞株中的表达明显上调(P<0.05,图2)。

图2 qRT-PCR法检测CNN2 mRNA在正常人结直肠细胞NCM460和结直肠癌细胞株中的表达:与NCM460相比,*P<0.05,**P<0.01)
2.3 干扰片段的筛选选取CNN2表达较稳定的2株CRC细胞(HCT116和HCT-8)作为实验对象。靶向CNN2的3条干扰片段分别转染HCT116和HCT-8细胞,每种细胞设干扰组(si-CNN2-1、si-CNN2-2及si-CNN2-3)和对照组(si-NC),通过qRT-PCR法分别检测3条干扰片段的转染效率,结果显示:与si-NC相比,HCT116细胞中si-CNN2-1、si-CNN2-2及si-CNN2-3组中CNN2的相对表达量分别为:0.136±0.124(P<0.05)、0.135±0.013(P<0.001)和0.08±0.103(P<0.05)。干扰效率分别为:66.4%、66.5%、92%。HCT-8细胞中si-CNN2-1、si-CNN2-2及si-CNN2-3组中CNN2的相对表达量分别为:0.486±0.033(P<0.01)、0.129±0.021(P<0.001)和0.106±0.013(P<0.01)。干扰效率分别为:51.4%、87.1%、89.4%。因此,选用干扰效果最好的siRNA-3用于后续实验。
2.4 干扰CNN2与CRC细胞的侵袭和迁移的关系通过Transwell侵袭实验检测干扰CNN2后,观察CRC细胞侵袭能力的变化。结果显示:si-NC组和si-CNN2组HCT116细胞侵袭数分别为137.67±5.25和51±5.35,HCT-8细胞的si-NC组和si-CNN2组侵袭数分别为178.33±12.28和89±3.27;提示与si-NC相比,干扰CNN2后CRC细胞HCT116和HCT-8的侵袭数明显减少(P<0.001,图3A、B)。
通过划痕愈合实验检测干扰CNN2后,CRC细胞迁移能力的变化。结果显示:HCT116细胞si-NC组和si-CNN2组划痕迁移率分别为(55.4±0.9)%和(24.2±4.3)%,si-NC组和si-CNN2组HCT-8细胞划痕迁移率分别为(57.3±1.6)%和(24.05±2.65)%。CRC细胞的迁移能力与si-NC组相比,干扰CNN2后CRC细胞迁移率明显降低(P<0.05,图3C、D)。以上结果说明干扰CNN2后,能抑制CRC细胞的侵袭和迁移能力。
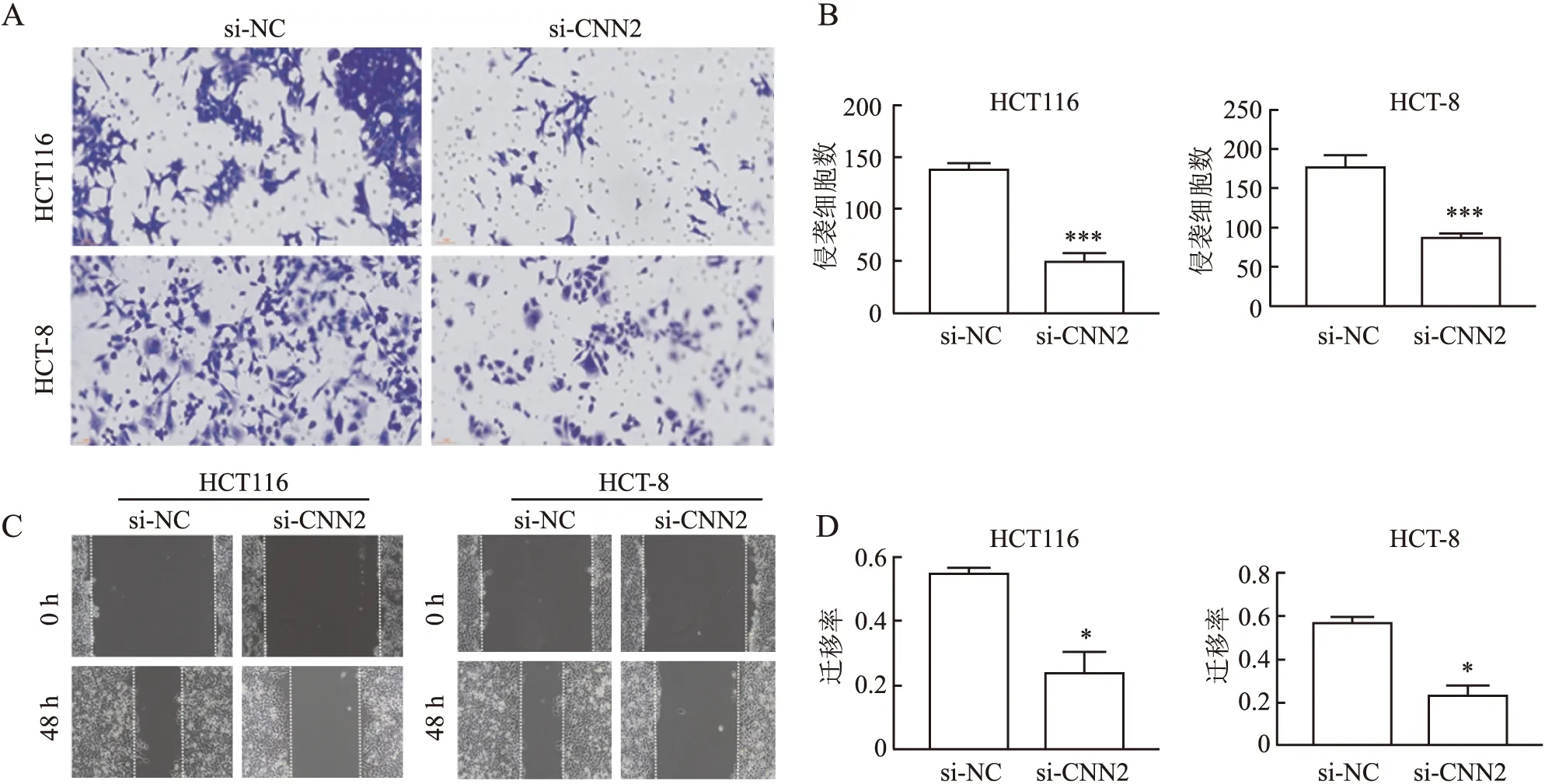
图3 CNN2对结直肠癌细胞HCT116和HCT-8侵袭和迁移的影响:A.Transwell侵袭实验检测CNN2对结直肠癌HCT116和HCT-8侵袭的影响;B.Transwell侵袭实验的统计学分析,***P<0.01;C.划痕愈合实验检测CNN2对结直肠癌细胞HCT116和HCT-8迁移的影响;D.划痕愈合实验的统计学分析,*P<0.05
2.5 干扰CRC细胞CNN2对EMT相关蛋白表达的影响Western blot结果显示:与si-NC组相比,干扰CNN2后HCT116和HCT-8细胞中的上皮标志物E-cadherin的表达(分别为:1.615±0.047、1.229±0.073)增加(P<0.05,图4),而间叶标志物N-cadherin和vimentin的表达(N-cadherin分别为:0.597±0.181 5、0.451±0.003 5;vimentin分别为:0.723±0.047 5、0.676±0.134)均下降(P<0.05,图4);提示干扰CNN2能抑制CRC细胞的EMT进程,EMT可能参与CNN2的促癌作用。
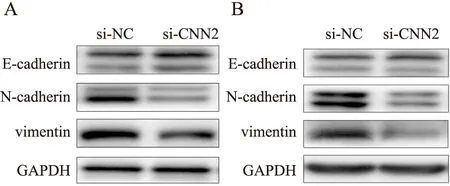
图4 Western blot法检测干扰结直肠癌细胞CNN2对EMT相关蛋白表达的影响:A.Western blot法检测干扰CNN2后,HCT116细胞中EMT相关蛋白的表达;B.Western blot法检测干扰CNN2后,HCT-8细胞中EMT相关蛋白的表达
2.6 CRC和癌旁正常组织中E-cadherin表达与CNN2的相关性免疫组化结果显示,E-cadherin阳性定位于细胞膜(图5);30例CRC中E-cadherin高表达4例,低表达26例,提示CRC组织中E-cadherin的表达明显低于癌旁正常肠黏膜组织(P<0.05)。应用Spearman秩统计学方法分析CRC组织中E-cadherin和CNN2蛋白表达的相关性,结果显示:CNN2与E-cadherin的表达呈负相关(r=-0.866,P<0.01)。

图5 E-cadherin在癌旁正常组织及结直肠癌组织中的表达:A.E-cadherin在癌旁正常组织中的表达;B.E-cadherin在结直肠癌组织中的表达,SP法
3 讨论
CNN2是一种细胞骨架结合蛋白,参与细胞骨架形成、肌肉收缩和细胞黏附。CNN2在多种肿瘤组织中均表达[9-10],还可以作为肝癌、乳腺癌的血清诊断潜在的特异性标志物[11-13]。近年,研究表明CNN2的降低与前列腺癌易发生骨转移有关[14]。潘妍等报道CNN2在CRC组织与正常结直肠组织相比,其表达量明显降低,下调CNN2后促进CRC细胞在体外的增殖、迁移能力增强等。Choi等通过RT-PCR法检测12例患者直肠癌细胞及相应正常直肠细胞的基因表达谱,结果显示CNN2在直肠癌细胞中呈高表达,可能参与直肠癌的发生。目前,CNN2在CRC中的具体作用机制尚未见报道。本实验首先检测CNN2在CRC组织及细胞中的表达,发现CNN2在两者中呈高表达,说明CNN2对于CRC的发生、发展具有调控作用。为了明确CNN2在CRC细胞的侵袭、迁移中作用,通过细胞体外Tarnswell侵袭实验、划痕愈合实验发现,干扰CNN2后CRC细胞的侵袭和迁移能力下降。
EMT是肿瘤发生、发展中的重要机制之一,上皮细胞在部分因素的作用下,失去极性及细胞间紧密连接和黏附连接,获得游走性和浸润性的迁移能力,变成具有间质细胞形态和特性的细胞改变[15-17]。在细胞发生EMT过程中,常伴细胞骨架以及相关表型的改变,如上皮标志物E-cadherin的下降以及间质标志物vimentin和N-cadherin的表达增加[18-20]。我们猜想CNN2可能参与了肿瘤的EMT进程,进而促进了肿瘤的侵袭和转移。为了探讨CNN2可能参与CRC的发生机制,采用Western blot法检测CNN2对EMT相关蛋白的影响,干扰CNN2后,CRC细胞HCT116、HCT-8中EMT相关上皮标志物E-cadherin表达量明显增加,间质标志物vimentin、N-cadherin表达量下降。此结果表明,CNN2可能通过CRC细胞的EMT进程促进CRC细胞的侵袭、迁移能力。采用免疫组化法检测CRC组织中CNN2与E-cadherin的表达,并应用统计学方法分析两者的相关性,结果发现CNN2与E-cadherin表达呈负相关,提示CNN2可能通过促进EMT发挥促癌作用。但是CNN2促进EMT进程的具体调控机制尚不明确,未来需要进一步深入分析。
综上所述,CNN2在CRC细胞中呈高表达,其可能通过促进CRC细胞的EMT表型改变,从而促进CRC细胞侵袭和迁移的能力,为CRC的诊疗提供了新的治疗思路。

