基于SSR标记羊角槭子一代和子二代的遗传多样性分析
罗芊芊, 赵明水, 肖德卿, 金国庆, 庞春梅, 祁祥斌, 周志春,①
(1.抚州市林业科学研究所, 江西 抚州 344000;2.中国林业科学研究院亚热带林业研究所 浙江省林木育种技术研究重点实验室, 浙江 杭州 311400;3.浙江天目山国家级自然保护区管理局, 浙江 杭州 311300)
近年来的研究结果表明:即使是狭域种、濒危种或特有种,也保持着较高的遗传多样性,例如漾濞槭(AceryangbienseY.S.Chen et Q.E.Yang)[1]。Spielman等[2]比较了170个濒危物种及相关非濒危物种的平均杂合度,77%濒危物种的杂合度较低,且濒危物种的杂合度比相关非濒危物种低35%,表明濒危物种的进化潜力降低,生殖健康受损,灭绝风险升高。近亲繁殖引起的遗传多样性降低意味着该物种繁殖适合度降低,这会增加濒危物种在自然栖息地灭绝的风险[3]。此外,濒危植物渐少的主要外部原因是天然植被屡遭破坏和生境恶化[4,5]。了解珍稀濒危植物的濒危机制,掌握珍稀濒危植物的遗传多样性变化规律和亲缘关系有利于对其开展科学保育工作。
羊角槭(AceryangjuechiFang et P.L.Chiu)为槭树科(Aceraceae)槭属(AcerLinn.)落叶乔木,被列入《国家重点保护野生植物名录(第一批)》,具有重要的科研及园林应用价值[6,7]。由于人为(折损)和自然(台风和冰雪)的双重影响,分布于浙江省杭州市西天目山的羊角槭4株原生大树(亲代)已死亡,仅有小苗留存下来。近年来,虽然相关部门对羊角槭采取了有效的保护和引种措施,但由于羊角槭存在败育严重、生存能力较差和种子深休眠等特性[8]9,35,其仍然面临生境破坏、人为干扰和自身更新困难等问题。因此,亟需对羊角槭遗传多样性进行研究,这对其遗传保育和扩繁工作具有重要意义。本研究通过13对SSR引物系统分析了来自浙江省杭州市西天目山的羊角槭子一代和子二代的遗传多样性和亲缘关系,以期最大化利用其基因资源的多样性生产优质种子,并为其科学遗传保育提供理论依据。
1 材料和方法
1.1 材料
供试材料为分布于浙江省杭州市西天目山的羊角槭子一代和子二代群体。该地区气候多雾、潮湿,年平均温度在12 ℃左右,空气相对湿度为76%~81%,年降水量约为1 600 mm,土壤酸碱度为pH 4.0至pH 5.0,土壤为山地红壤或黄壤[9]。羊角槭天然分布区内的主要伴生树种为毛竹〔Phyllostachysedulis(Carrière)J.Houz.〕、构树〔Broussonetiapapyrifera(Linn.)L′Hér.ex Vent.〕和枫香树(LiquidambarformosanaHance)等,植被类型为亚热带常绿阔叶林。近年来,有关部门对仅存的12株实生子代苗(以下简称为子一代,树龄20~40 a,编号Y1至Y12)采取了就地保护和引种驯化措施,并营建了0.33 hm2羊角槭母树林。本文中子二代植株共54株,其中,编号Y13为子一代Y6的旁生小树,其余53株〔树龄较大且较为接近(8~10 a),编号Y14至Y66〕皆来自羊角槭母树林[10]。
于2020年6月,在每株冠层中部的靠阳面,随机采集无病虫害当年生叶片50 g,单株混合,用锡箔纸包裹后置于液氮中,带回实验室后于-80 ℃保存、备用。采样时,使用胸径尺(精度1 mm)测量样株胸径,使用测距望远镜(精度0.1 m)测量树高,使用GPS记录样株所处的经度、纬度和海拔,使用指南针判断坡向,使用坡度测量仪(精度1°)测量坡度,肉眼判断坡位和郁闭度。羊角槭子一代和子二代样株的基本信息见表1。
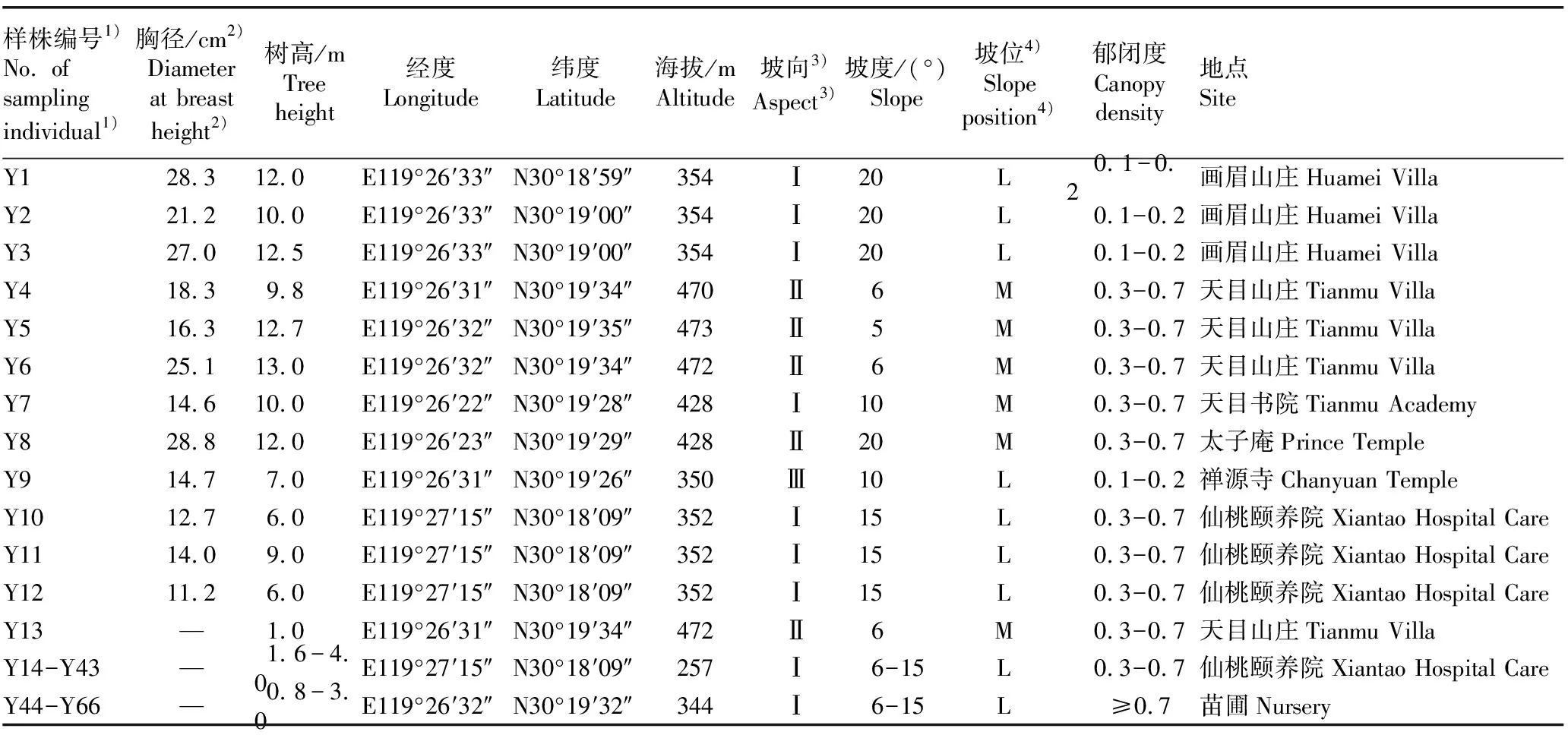
表1 羊角槭子一代和子二代样株的基本信息
1.2 方法
参照文献[11-17]收集多个引物片段,初筛后选出13对条带清晰且多态性较高的SSR引物(表2)进行PCR扩增。采用DN14 CTAB植物基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取羊角槭叶样的基因组DNA,使用NanoDrop 2000超微量分光光度计(美国Thermo Fisher Scientific公司)和质量体积分数1.0%琼脂糖凝胶电泳检测基因组DNA浓度及质量。
PCR扩增反应体系总体积25.0 μL,包括2×TaqPlus Master MixPCR预混液(南京诺唯赞生物科技股份有限公司)12.5 μL、ddH2O 8.5 μL、20 ng·μL-1DNA模板2.0 μL以及10 μmol·L-1正向和反向引物各1.0 μL。使用TP600梯度PCR仪(日本Takara Bio公司)进行PCR扩增反应,扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、相应温度退火60 s(退火温度见表2)、72 ℃延伸60 s,共33个循环;72 ℃延伸7 min。采用Qsep100TM全自动核酸蛋白分析系统(光鼎生物科技股份有限公司)对所有PCR扩增产物进行电泳分离检测[18,19]。

表2 用于羊角槭子一代和子二代群体SSR标记分析的13对SSR引物信息
1.3 数据处理和统计分析
采用Q-analyze 3.0软件对SSR检测结果进行峰图分析、等位基因读取和胶图比对,然后采用GenALEx 6.5软件[20]对子一代和子二代群体的遗传多样性进行分析,遗传参数包括观测等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、固定指数(Fi)、Shannon’s多样性指数(I)和子二代特有等位基因数(Nu),其中,Fi值的计算公式为Fi=1-Ho/He。采用HP-RARE 1.1软件[21]计算等位基因丰富度(AR)及私有等位基因丰富度(PA)。采用CERVUS 2.0软件[22]对子一代和子二代群体进行哈迪-温伯格(Hardy-Weinberg)平衡检验,最小期望频率为5,使用叶氏连续性修正,使用Bonferroni校正,获得微卫星位点的多态性信息含量(PIC)。采用Micro-checker 2.2.3软件[23]对13个位点进行无效等位基因检测,按照Brookfield估算方法得出无效等位基因频率并对观测等位基因频率进行调整。采用FSTAT 2.9.3软件[24]对上述遗传多样性参数在子一代和子二代群体间的区别进行检测(1 000次模拟),计算子一代和子二代群体的近交系数(Fis)[25]。
根据Q-analyze 3.0软件显示的分型结果,在相同位置,有条带赋值为“1”,无条带赋值为“0”。计算供试材料的遗传相似系数(GS),采用非加权组平均法(UPGMA)进行聚类分析,绘制树状图。以上操作均在EXCEL 2016和NTSYS pc 2.10e统计分析软件中完成[26-28]。
2 结果和分析
2.1 羊角槭子一代和子二代群体的遗传多样性
采用13对SSR引物对供试羊角槭12个子一代样株和54个子二代样株进行遗传多样性分析,结果见表3和表4。
由表3可知:13对SSR引物共扩增出128个观测等位基因(Na),各引物对应位点的Na值为6~17,均值为9.8;有效等位基因数(Ne)为2.4~8.5,均值为4.4;观测杂合度(Ho)为0.421~1.000,均值为0.738;期望杂合度(He)为0.524~0.873,均值为0.727;Shannon’s多样性指数(I)为1.058~2.319,均值为1.559;多态性信息含量(PIC)为0.425~0.906,均值为0.723,表明各引物的多态性较高。13对SSR引物中,A14、A21、A61、A67和A82引物对应位点的固定指数(Fi)小于0,且13对SSR引物对应位点的Fi值的均值也小于0,表明羊角槭群体内存在杂合子过剩的现象。哈迪-温伯格平衡检验结果表明:13对SSR引物对应位点中,有4对SSR引物对应位点显著偏离遗传平衡。此外,13对SSR引物对应位点的子二代特有等位基因数(Nu)为1~8,均值为4.2;无效等位基因频率为0.000~0.279。
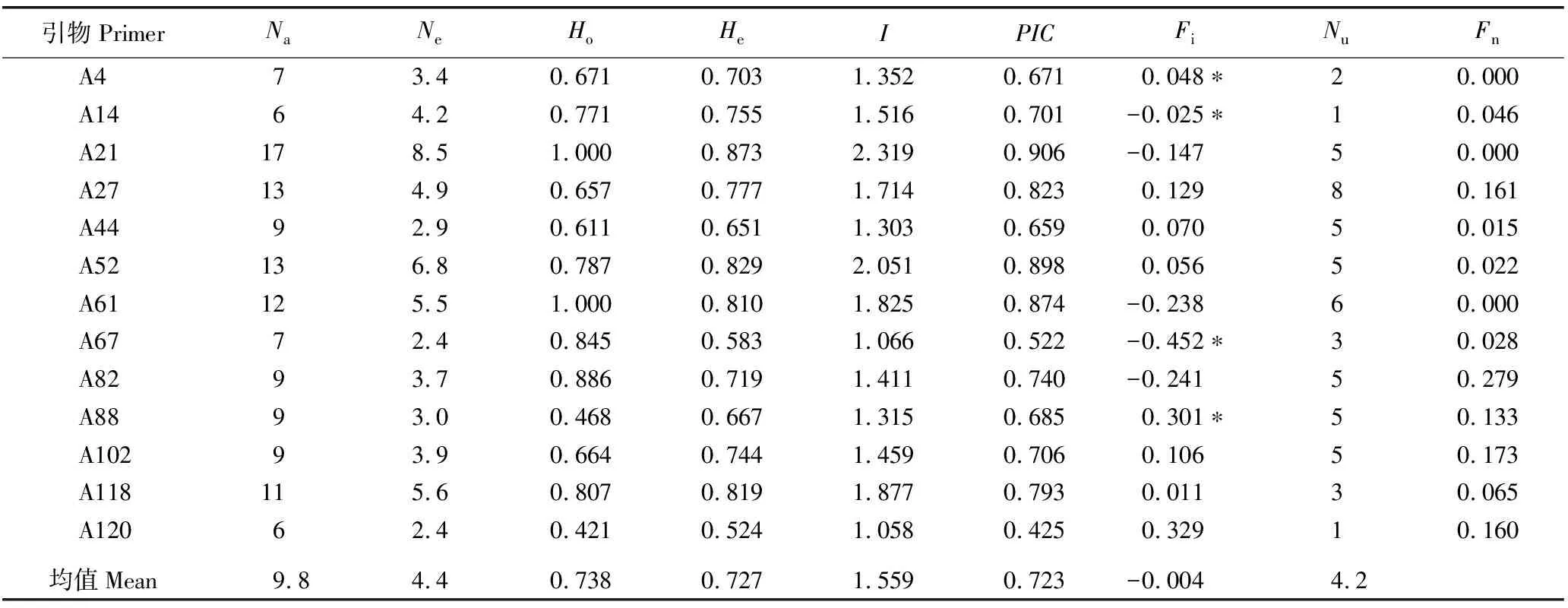
表3 用于羊角槭子一代和子二代群体SSR标记分析的13对引物对应位点的遗传参数1)
由表4可知:羊角槭子一代和子二代群体的遗传多样性水平总体较高,与子一代群体相比,子二代群体的遗传多样性水平更高(Na=9.2,Ne=5.0,He=0.740,I=1.671)。羊角槭子一代群体的Ho值大于He值,而子二代群体的Ho值小于He值,且子一代群体的近交系数(Fis)小于0,子二代群体的Fis值大于0,表明子一代群体中杂合子过剩,而子二代群体中杂合子缺失。此外,子二代群体的Ho值略小于子一代群体,说明子二代群体中实际杂合单株比率较子一代群体有所下降。
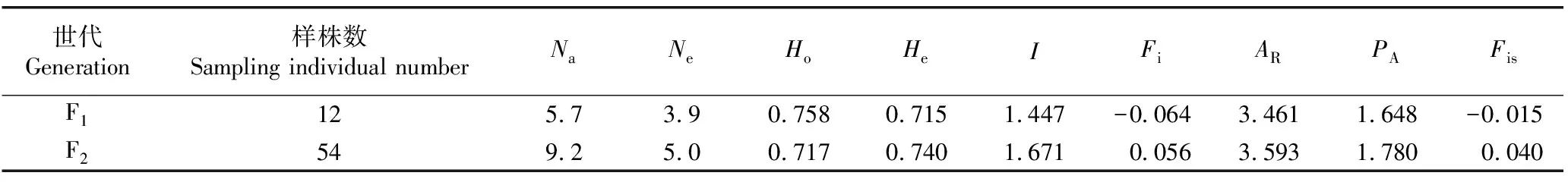
表4 羊角槭子一代(F1)与子二代(F2)群体的遗传多样性比较1)
2.2 羊角槭子一代和子二代群体的亲缘关系分析
羊角槭66个样株间的遗传相似系数为0.540~0.908。羊角槭子一代样株中,Y4与Y10的亲缘关系最近(遗传相似系数为0.897),Y5与Y12的亲缘关系最远(遗传相似系数为0.644);羊角槭子二代样株中,Y33与Y34以及Y41与Y43的亲缘关系最近(遗传相似系数均为0.908),Y17与Y65的亲缘关系最远(遗传相似系数为0.540)。羊角槭子一代样株与子二代样株间,子一代Y5与子二代Y24的亲缘关系最近(遗传相似系数为0.851),子一代Y12与子二代Y36、Y37和Y65的亲缘关系最远(遗传相似系数均为0.575)。
基于遗传相似系数的羊角槭子一代和子二代群体的UPGMA聚类图见图1。由图1可知:以遗传相似系数0.709为阈值,羊角槭66个样株分为A、B和C 3组。A组包括51个样株,以遗传相似系数0.723为阈值进一步分为A1和A22个亚组。A1亚组中,子一代Y1单独聚为一支,与子二代Y46、Y49、Y50、Y51、Y52、Y53、Y54、Y55、Y56、Y57、Y58、Y59、Y60、Y61、Y62、Y63、Y64和Y65的亲缘关系较近;A2亚组中,子一代Y7和Y8与子二代Y14和Y29的亲缘关系较近。B组包括14个样株,以遗传相似系数0.718为阈值进一步分为B1和B22个亚组,B1亚组包括子一代Y2、Y3、Y4、Y6、Y9、Y10、Y11和Y12以及子二代Y13、Y19和Y24,其中,Y4与Y10先聚为一支,亲缘关系较近;B2亚组包括子一代Y5以及子二代Y22和Y23。大多数的子一代样株聚集在B组。C组仅包括子二代Y66。
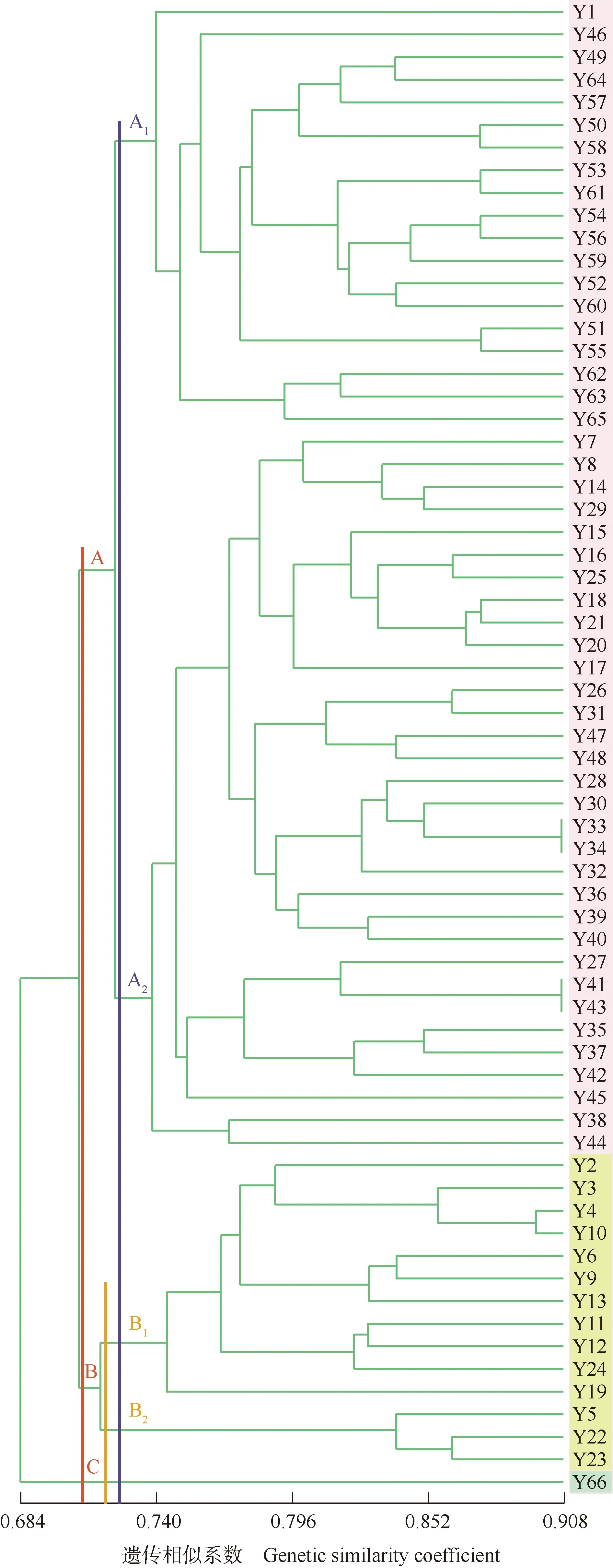
Y1-Y12: 子一代样株编号No.of sampling individual of first filial generation; Y13-Y66: 子二代No.of sampling individual of second filial generation.
3 讨论和结论
羊角槭群体数量少,种子不孕率高,交配方式以异交为主,部分自交亲和[29],其主要传粉方式为虫媒传粉,具有传粉效率低、胚珠败育和落花落果现象明显等特点,这些因子均导致羊角槭的自然结实率和繁殖成功率较低[8]18-19,29。本研究中,羊角槭子一代和子二代群体的遗传多样性水平总体较高,且子二代群体的遗传多样性水平略高于子一代群体。刘晓宏[30]的研究结果表明:在槭属树种中的遗传聚类结果中羊角槭单独聚为一类,在槭属中较特殊。与血皮槭〔Acergriseum(Franch.)Pax〕[11]53、葛萝槭〔Acerdavidiisubsp.grosseri(Pax)P.C.de Jong〕[31]、金钱槭(DipteroniasinensisOliv.)[32]和云南金钱槭(DipteroniadyerianaHenry)[32]相比,羊角槭的遗传多样性水平较高,且明显高于亲缘关系较近的庙台槭(AcermiaotaienseP.C.Tsoong)(Shannon’s多样性指数为0.291 8)[33],说明羊角槭群体具有一定的进化潜力。本研究中,羊角槭子二代的亲本并不完全包括在供试的子一代群体内,由于羊角槭子一代群体中部分植株已死亡,推测子二代中检测到的特有等位基因可能来源于已死亡的子一代植株。
本研究中,13对SSR引物对应位点的多样性水平存在一定差异,A21、A27、A52、A61和A118引物对应位点的观测等位基因数较多,为11~17个,且这5对SSR引物对应位点的期望杂合度、Shannon’s多样性指数和多态性信息含量也高于其他引物,说明这5对SSR引物能揭示羊角槭群体更为丰富的遗传多样性信息。其余8对SSR引物对应位点的观测等位基因数较少(6~9),其相应的遗传多样性参数也相应较低。羊角槭子一代群体的观测杂合度大于期望杂合度,子二代群体的观测杂合度却小于期望杂合度,表明子一代群体中杂合子过剩,子二代群体中杂合子缺失;并且,子二代群体的观测杂合度略小于子一代,说明子二代群体中实际杂合单株比率较子一代群体有所下降,但差异不大,子二代样株中存在近亲交配的后代。杂合子过剩一般出现在研究对象为小群体或者封闭群体[34],如羊角槭野生群体中的子一代群体往往由于亲本数量所限,出现的奠基者效应(founder effect)会导致连锁不平衡现象,继而造成杂合子过剩。而羊角槭子二代群体呈现的杂合子缺失除与无效基因和研究样本范围大小有关外,还可能与人为干扰、单株交配型式样改变、群体退化和亲缘近交所造成的稀有碱基丢失等有关[35]。此外,人类砍伐和自然灾害等也会影响其群体遗传多样性和单株交配型式样。
聚类分析结果显示:A1亚组中,羊角槭子一代Y1与18个子二代样株的亲缘关系较近,遗传相似系数为0.644~0.805,推测这18个子二代样株为Y1的后代。羊角槭花期传粉昆虫以蝇类、蛾类和蜜蜂为主[8]19,这类昆虫的传粉飞行距离较短[36],所以距离相近的子一代Y1和Y2易促成异交结实,有利于繁殖成功,这与其异交为主、部分自交可育的繁殖特性相关联[29]。A2亚组中,仅有的子一代Y7和Y8的地理分布位置较近,且二者的亲缘关系也较近,有可能来源于同一个母本。此外,子一代Y7和Y8与30个子二代样株的亲缘关系较近,推测A2亚组中的这些子二代样株应为Y7和Y8的后代。B1亚组中,子一代Y2、Y3、Y4和Y10聚为一个小分支,这4个单株均位于浙江省杭州市西天目山的同一山坳,加上其主要依赖昆虫传粉,导致这4个单株很可能来源于同一祖先。子一代Y6和Y9与子二代Y13以及子一代Y11和Y12与子二代Y24的亲缘关系较近。在实地调查过程中发现,Y13是Y6树下旁生的小树,Y11和Y12与Y24的地理位置也较近,推测Y13为Y6与Y9的异交子代,Y24为Y11和Y12的异交子代。B2亚组中,子二代Y22和Y23与子一代Y5聚为一个小分支,三者间亲缘关系较近,推测Y5很可能是Y22和Y23的父本或母本。66个样株中,子二代Y66与其他样株的遗传相似系数为0.632~0.759,但却单独聚为C组,说明Y66的亲本可能是子一代中已死亡的植株。
羊角槭与庙台槭亲缘关系非常近,《Flora of China》将二者归并为1个种[37],但林立等[38]通过nrDNA ITS和cpDNA序列比对发现二者差异较大,采集于武汉和杭州的羊角槭样品在5条DNA序列上都表现出100%相似度,而与庙台槭则在5条DNA序列上存在13个位点差异,分子证据不支持将羊角槭归并为庙台槭;此外,二者在形态和地理分布上也差异较大,庙台槭分布于甘、陕2省,小枝、果序和叶柄无毛,而羊角槭分布于浙西北地区,小枝、果序和叶柄被宿存的灰色或淡黄色短柔毛,因此,不支持将羊角槭归并为庙台槭。
本研究中供试的羊角槭子二代群体已被浙江天目山国家级自然保护区管理局划分为羊角槭母树林。在对羊角槭母树林实施就地保护的过程中,可在其分布较为集中的地方,有规模地扩大幼树和幼苗的林窗面积,这样既能增加群落下层光照,提高林下幼苗和幼树的光合作用速率,又不至于因光照太强对幼苗和幼树的叶片造成伤害[39]。羊角槭自然受精率、结实率低[8]35-37,人为地将遗传相似系数较小的植株间的种子、幼苗植株进行交叉种植,有利于促进自然异交。此外,还可对其实施人工采种,选取亲缘关系较远植株的种子进行人工培养,如Y17和Y65,开展人工杂交授粉,扩大羊角槭的遗传变异,丰富其遗传信息。

