99Tcm-MDP SPECT/CT定量分析预测前列腺癌单发骨转移的价值
闫 君,常雁荣,李险峰
(1 山西省大同市第三人民医院核医学科,大同 037008;2 山西医科大学第一医院放疗科;* 通讯作者,E-mail:yanjun0352@126.com)
在欧美发达国家,前列腺癌居男性肿瘤发病率首位[1]。现阶段我国前列腺癌的发病率及死亡率逐步升高,严重威胁着我国男性健康[2,3],骨骼是前列腺癌主要且最常见的转移靶器官,我国13.3%~26%前列腺癌患者在确诊时已发生了明确骨转移[4],骨骼是否发生转移会明显影响患者下一步的治疗方案及预后。锝[99Tcm]-亚甲基二磷酸盐(99Tcm-methylene diphosphonate,99Tcm-MDP)全身骨显像作为前列腺癌骨转移诊断及随访首选的功能影像手段,现在广泛应用于临床工作中,其具有较高的敏感性,即对骨盐代谢活跃的病变表现出异常的显像剂浓聚,但特异性较低,难以鉴别出引起骨盐代谢活跃的原因是否为肿瘤所致[5,6]。单光子发射计算机成像/计算机体层成像(single photon emission computed tomography/computed tomography, SPECT/CT)以3D的方式显示病灶形态学改变及显像剂分布状态,进一步提高对病灶诊断的特异性[7]。
病灶标准化摄取值(standardized uptake value, SUV)的可测性,有效弥补了目测分析法的不足,使得骨显像兼具对病灶定性和定量诊断的价值[8,9]。前列腺癌骨转移以多发、非对称分布和成骨性改变多见,而骨单发转移相对少见,约占10%左右[10]。因此,骨单发转移的把握度较多发骨转移明显降低。本文回顾性分析了患者的一般信息、血清学检查及SPECT定量参数,旨在探讨SPECT定量参数在前列腺癌骨单发转移与骨良性病变中的诊断价值及其诊断效能。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月至2019年10月于本院核医学科行99Tcm-MDP SPECT/CT骨定量显像的前列腺癌患者。纳入标准:①显像前经穿刺活检病理证实为前列腺癌;②骨全身显像明显发现骨单发显像剂异常浓聚灶;③所有单发骨显像浓聚灶以穿刺活检和/或12个月及以上的影像学[全身骨骼扫描(WBS)、核磁共振成像(MRI)或正电子发射断层/X线计算机断层(PET/CT)]随访为判断金标准。排除标准:①患者有骨折、外伤史手术史或代谢性骨病者;②注射点显像剂外渗或明显的显像剂污染;③患者无法配合饮水,如严重肾功能不全或透析的患者等。
最终共纳入患者169例,骨单发转移患者102例,骨良性病变67例,年龄52~90岁,平均(67.4 ±8.4)岁。
1.2 全身骨平面显像
静脉注射总剂量为925 MBq99Tcm-MDP(原子高科股份有限公司生产)。嘱患者注射药物后饮水500~1 000 ml,显像前排空膀胱;如饮水困难,应行静脉补液至少500 ml。如患者已行尿道引流术,嘱患者勤倒尿袋。静脉注射后3 h行全身骨显像。显像设备为德国西门子公司Symbia Intevo 16 SPECT(xSPECT)行全身骨显像或骨断层显像,采集参数如下:患者取仰卧位,双手紧贴双侧大腿,脚尖并拢,扫描速度为13~15 cm/min。
1.3 骨定量显像
根据全身骨平面显像的结果,由科室经验丰富的2名医生判定是否需要加做CT,决定局部SPECT/CT显像部位。局部断层CT扫描后,行相应部位定量SPECT图像采集,具体参数:CT管电流120~150 mA,管电压130 kV,螺距0.75;SPECT以3D模式采集,采用低能高分辨准直器、能峰140 keV,矩阵256×256,10 s/帧,共采集60帧。图像重建:CT层厚按照3.0 mm进行重建,SPECT经24次迭代,2个子集,平滑7.5 mm后经子集共轭梯度重建算法(ordered subsets conjugate gradient, OSCG)及增强后处理进行图像重建。同时记录注射前99Tcm-MDP剂量及测量时间、注射后99Tcm-MDP空针剂量及测量时间、注射时间、扫描时间、患者的身高和体重等相关信息。
1.4 图像分析
将骨定量SPECT/CT图像传输至图像后处理工作站(Syngo MI NM 1292,西门子)。由2位经验丰富的核医学医师(从事SPECT影像诊断工作10年以上)确定病变部位进行容积感兴趣区(volume of interest,VOI)勾画(30%SUV为阈值进行勾画),勾画时应同时结合横断位、冠状位和矢状位观察病灶是否全部勾画进去,并记录每个VOI的最大标准摄取值(maximum standardized uptake value, SUVmax)及平均标准摄取值(mean standardized uptake value, SUVmean),其计算公式为:
如病变部位在盆腔时,需挖除膀胱后进行VOI测量。分析2位核医学医师测出的SUVmax和SUVmean数值的一致性。SUVmax及SUVmax的计算值均由仪器自动生成。
1.5 统计学分析
本研究应用SPSS软件进行统计分析(version 26.0,Chicago, IL, USA)。分类变量应用Chi square法进行统计。连续性变量先进行正态性检验,符合正态分布的数据使用两独立样本t检验,不符合整体分布的连续性变量则使用Mann-WhitneyU检验方法进行对比分析,并用中位数及四分位间距的方式表达数据。正态性检验P>0.05认为符合正态分布或方差齐。上述分类或连续变量检验方法认为双侧P<0.05时差异有统计学意义。
2 结果
2.1 一般资料分析
本研究共纳入169例均经病理证实的前列腺癌患者。经增强MRI和/或活检确诊前列腺癌骨单发转移共102例,年龄52~79岁,平均(67.0 ±7.9)岁。经增强MRI及活检确诊前列腺癌骨关节退变共67例,年龄52~90岁,平均(67.9 ±9.0)岁。所有患者一般资料见表1。

表1 骨单发转移组与骨关节炎症组临床资料比较
2.2 代谢参数分析
前列腺癌骨转移病灶的显像剂浓聚程度显著高于骨关节退变组(见表1)。SUVmax在两组间具有统计学差异(t=20.09,P<0.001),分别为(36.22 ±8.10)g/ml和(24.57 ±9.10)g/ml。另外,SUVmean在两组间也均有统计学差异(t=14.63,P<0.001,见图1和表2),分别为(15.60 ±2.71)g/ml和(8.13 ±1.55)g/ml。SUVmax和SUVmean的组内相关系数(interclass correlation coefficient, ICC)分别为0.93(95%CI 0.85~0.95)和0.95(95%CI 0.92~0.97,见表2),说明感兴趣区测量的数值重复性好,结果可靠。

与骨关节炎症组比较,* * * * P <0.000 1
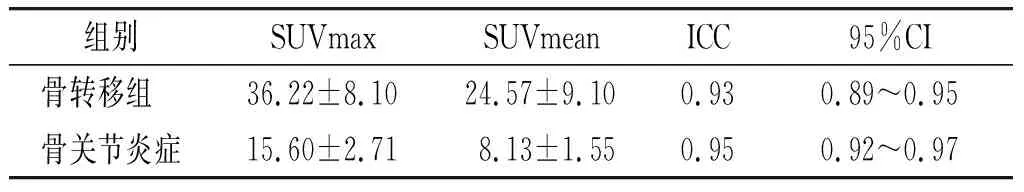
表2 对比骨单发转移组与骨关节炎症组平均SUVmax和SUVmean及一致性检验
ICC>0.75表示一致性较好
3 讨论
骨穿刺活检是诊断骨转移性肿瘤的金标准,因为是有创性检查,临床普及应用受到一定的限制;目前诊断前列腺癌骨转移的首选检查方法是常规的SPECT或SPECT/CT全身骨显像,全身骨骼显像的显像剂是99Tcm-MDP只要是成骨细胞活跃的部位都可聚集大量的99Tcm-MDP。因此除恶性肿瘤导致的成骨性骨转移外,一些良性疾病(如骨折和退行性变等)也可激活成骨细胞,这些良性病变部位也可聚集大量的99Tcm-MDP[11]。因此显像结果出现假阳性的可能性较大,经常容易与骨关节炎、脊柱退行性改变等疾病的显像结果出现混淆;如果骨显像出现全身多发的、非对称的、异常浓聚的图像,再加上肿瘤病史,就很容易诊断为前列腺癌骨转移。然而,对于骨平面图像出现单发的骨显像剂异常浓聚灶,在临床诊断中把握性不大;如果在全身平面骨显像基础上加做CT断层融合显像,再结合SUVmax和SUVmean半定量指标,可以更有效地发现和诊断早期骨转移或可疑病灶。翟威豪等[12]研究表明SPECT/CT骨定量诊断的准确度、特异性、阳性预测率和阴性预测率均明显高于常规SPECT/CT。对于老年前列腺癌骨转移灶的检出体现出更大的优势,有利于早期全面评估肿瘤骨转移情况。
前期Mohd Rohani等[13]和杜芬等[14]对不同恶性肿瘤骨转移的SUVmax进行研究,结果表明骨转移病灶的SUVmax明显高于退行性关节疾病,SUVmax≥20可用于鉴别骨转移与退行性关节疾病。本研究单发病灶骨转移组的SUVmax和SUVmean均明显高于骨关节炎组,与上述研究基本相符,但稍有差异,表现在平均SUVmax数据略高,可能的原因是上述研究针对广泛的恶性肿瘤患者,具体到前列腺癌骨转移的病例比较少,尤其是骨单发病灶病例更少。
既往只有PET/CT可以测量SUV值,且SUVmax和SUVmean在PET/CT中已被广泛应用[15]。尤其在定量诊断前列腺癌单发骨转移方面具有客观性、准确性及可重复性等更多优势,但是PET/CT价格昂贵,需要正电子显像药物及设备,普及性和经济性在基层医院应用受到限制;随着现代SPECT/CT的不断发展和优化,有研究显示,SPECT/CT定量分析测得SUV具有与PET/CT类似的量化功能[16]。Yamane等[17]也证明SPECT/CT定量指标SUVmax、SUV峰值具有好的重复性,可作为患者管理的一个临床参考指标;骨定量显像在骨转移诊断方面有着不可替代的作用。
综上所述,本研究结果显示前列腺癌骨单发转移灶骨定量分析的半定量指标SUVmax和SUVmean的值均明显高于骨关节炎组,组内相关性高,重复性好,可显著提高前列腺癌骨单发转移的诊断效能,可作为患者诊断、治疗和随访过程中的一项客观临床参考指标。

