MiR-663b/ALDH6A1轴通过ROS调节口腔鳞状细胞癌细胞增殖
许 朗,黄忠卫,鲁大鹏,韩 炎,周丽芝
(1.北京积水潭医院口腔科,北京 100035;2.北京王府中西医结合医院口腔科,北京 102200;3.首都医科大学附属北京口腔医院急诊综合治疗中心,北京 100050;4.文安县医院口腔科,河北 廊坊 065800;5.河北省唐山市第八医院口腔科,河北 唐山 063000)
口腔癌是临床常见的恶性肿瘤,其中口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)约占90%[1]。尽管目前OSCC患者的预后获得了极大改善,但其长期预后仍不容乐观,5年生存率低于50%[2]。因此,有必要深入研究OSCC发生、发展的内在机制。研究表明,微小核糖核酸(microRNA,miRNA)参与调节包括OSCC在内的多种恶性肿瘤的生物学特征[3-5];有研究发现,miR-663b在结直肠癌中表达上调,其能促进结直肠癌细胞的增殖而发挥致癌基因作用[6];此外,miR-663b在骨肉瘤细胞中表达水平升高,干扰miR-663b表达可有效诱导骨肉瘤细胞凋亡[7]。然而,miR-663b在OSCC细胞中的作用目前仍不清楚。本研究旨在通过生物信息学分析和功能实验探讨miR-663b在OSCC发生、发展中的生物学功能及机制。
1 材料与方法
1.1 细胞、实验动物与试剂
人OSCC细胞系HSC-3、CAL-27(丰晖生物),SPF级Nu/Nu品系裸鼠18只(北京维通利华实验动物技术有限公司),体质量15~20 g;本实验根据实验动物管理与保护的有关规定饲养动物并进行实验。
miR-663b、醛脱氢酶6家族成员A1(aldehyde dehydrogenase 6 family member A1,ALDH6A1)过表达质粒(上海吉凯基因医学科技股份有限公司),ALDH6A1一抗(英国Abcam公司),HRP标记的IgG二抗(美国BioRad公司),DMEM培养基(武汉普诺赛生命科技有限公司),双荧光素酶报告基因检测试剂盒(美国Promega公司),NADPH/NADP+比值检测试剂盒(美国Abbkine公司),Lipofectamine 2000(美国Invitrogen公司)。
1.2 方法
1.2.1 生物信息学分析 利用基因表达汇编(gene expression omnibus,GEO)数据库OSCC组织芯片(GSE45238、GSE28100、GSE98463)分析癌组织和正常对照样本中的差异表达miRNA,并取交集;下载TCGA数据库中头颈癌表达数据和临床信息,并挑选出OSCC患者,以miR-663b的表达水平均数分组,使用GSEA3.0软件分析miR-663b表达水平与细胞增殖、氧化还原的关系。分析GSE138206、GSE74530共同下调的基因,并与miRWalk预测miR-663b的靶基因取交集。以ALDH6A1表达水平中位数分组,基因富集分析(genomic enrichment analysis,GSEA)ALDH6A1表达水平和细胞氧化还原以及细胞增殖的关系。
1.2.2 细胞培养与转染 人OSCC细胞系HSC-3、CAL-27细胞使用含10%胎牛血清的DMEM培养基于37 ℃、5%CO2的培养箱中培养,待细胞生长汇合率达85%以上后进行传代培养。采用Lipofectamine 2000将miR-663b mimic及ALDH6A1过表达质粒转染至HSC-3、CAL-27细胞。miR-663b慢病毒表达载体由上海吉凯基因医学构建、包装后转染HSC-3细胞,用于构建裸鼠皮下移植瘤模型。
1.2.3 裸鼠皮下移植瘤实验 18只裸鼠分为miR-NC组和miR-663b组,每组9只,取稳定转染miR-NC或miR-663b的HSC-3细胞约5×106个重悬于100 μL PBS中,分别注射到裸鼠腋下诱导OSCC皮下移植瘤模型;待成瘤后,每2 d使用标尺测量肿瘤体积,肿瘤体积(V)=0.5×瘤体长(L)×瘤体宽(W)2;监测14 d后处死裸鼠,剥离瘤体,测量瘤体体积并称重。
1.2.4 双荧光素酶报告基因实验 根据靶基因预测数据库miRwalk预测的可能结合位点构建ALDH6A1结合位点的野生型(WT)和突变型(MUT)3’UTR序列的荧光素酶报告基因载体pmiR-ALDH6A1-WT或pmiR-ALDH6A1-MUT。将上述构建的质粒载体和miR-663b或miR-NC共转染至HSC-3细胞,培养48 h后,测定荧光素酶活性变化。
1.2.5 CCK-8检测细胞增殖 转染48 h后,将HSC-3、CAL-27细胞消化后以1 000 r/min离心5 min、PBS冲洗,使用DMEM培养基配成单细胞悬液后,以6 000个/孔的密度接种于96孔板,放入培养箱中常规培养,分别于培养0 h、24 h、48 h、72 h、96 h和120 h后加入10 μL CCK-8溶液,继续培养2 h后测定450 nm处吸光度(OD)值。
1.2.6 细胞活性氧(ROS)检测 转染48 h后,将HSC-3、CAL-27细胞以4×105/mL的密度接种于6孔板,于37 ℃、5% CO2的培养箱中培养24 h后,使用PBS更换细胞培养液,然后将细胞与10 μmol/L DCF-DA于37 ℃、5% CO2条件下继续培养20 min。使用Dynatech MR5000 plate reader分析每孔在488 nm处的吸光度。
1.2.7 细胞NADPH/NADP+检测 转染48 h后,将HSC-3、CAL-27细胞以4×105/mL的密度接种于6孔板,于37 ℃、5%CO2的培养箱中培养24 h后,按照NADPH/NADP+比值检测试剂盒说明书步骤检测细胞中NADPH/NADP+比值。
1.2.8 克隆形成实验 转染48 h后,将HSC-3、CAL-27细胞使用DMEM培养基配成单细胞悬液,以100个/孔的密度接种于6孔板,放入培养箱中常规培养,每2 d换液,2周后终止培养。分别使用中性甲醇固定、结晶紫染色后拍照,于低倍显微镜下计数大于50个细胞的克隆数。
1.2.9 实时荧光定量聚合酶链式反应(qRT-PCR)分析 收集各组细胞后,采用TRIzol试剂提取总RNA,测定其浓度和纯度后,以反转录试剂盒合成cDNA,PCR仪进行扩增,选择U6为内参,根据试剂盒说明书步骤检测miR-663b水平,以2-ΔΔCt法计算miR-663b水平。引物序列由上海生工合成,见表1。

表1 引物序列
1.2.10 Western blot检测蛋白表达 BCA法定量提取蛋白样品后,取40 μg蛋白,在100 V电压条件下经SDS-PAGE电泳50 min,300 mA转膜1 h至PVDF膜,5%脱脂牛奶室温封闭2 h,以β-actin为内参,加入ALDH6A1一抗于4 ℃孵育过夜,TBST洗膜3次;最后加二抗室温下孵育2 h,ECL法显色,Image J分析条带灰度值。
1.3 统计学方法

2 结果
2.1 miR-663b在OSCC细胞中的表达及与临床病理特征的关系
利用GEO数据库OSCC组织芯片(GSE45238、GSE28100、GSE98463)获取癌组织和正常对照样本中的差异表达基因并取交集发现,miR-663b表达上调。通过进一步GSEA发现,miR-663b生物学功能与调节细胞增殖、氧化还原反应及ROS相关,见图1。

a:GEO数据库3个数据集GSE45238、GSE28100、GSE98463分析所得表达下调基因韦恩图;b~d:miR-663b生物学功能GSEA结果
2.2 上调miR-663b对OSCC细胞增殖的影响
与转染miR-NC mimic比较,HSC-3、CAL-27细胞转染miR-663b mimic后,miR-663b水平、NADPH/NADP+比值上调(P<0.05),ROS水平降低(P<0.05);上调miR-663b促进HSC-3、CAL-27细胞的体外增殖和克隆形成能力(P<0.05),见图2。
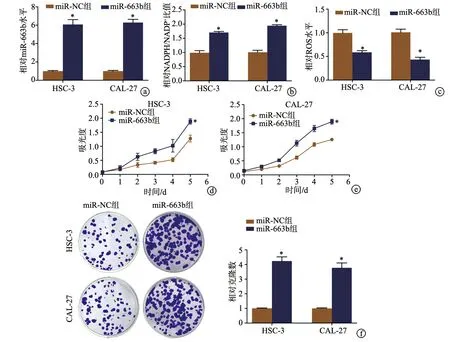
a:qRT-PCR检测HSC-3、CAL-27细胞中miR-663b的表达;b:转染后细胞中NADPH/NADP+比值;c:转染后DCF-DA荧光探针检测细胞中ROS水平;d、e:CCK-8检测细胞增殖;f:平板克隆形成实验(结晶紫染色×20) *:与miR-NC组比较,P<0.05
2.3 上调miR-663b对OSCC裸鼠皮下移植瘤生长的影响
与miR-NC组比较,裸鼠体内注射稳定过表达miR-663b的HSC-3细胞后,每2 d测量的肿瘤体积明显增加P<0.05),监测14 d后剥离的瘤体体积和质量均明显增加(P<0.05),移植瘤组织中miR-663b表达显著上调(P<0.05),提示上调miR-663b显著促进裸鼠皮下移植瘤的生长,见图3。
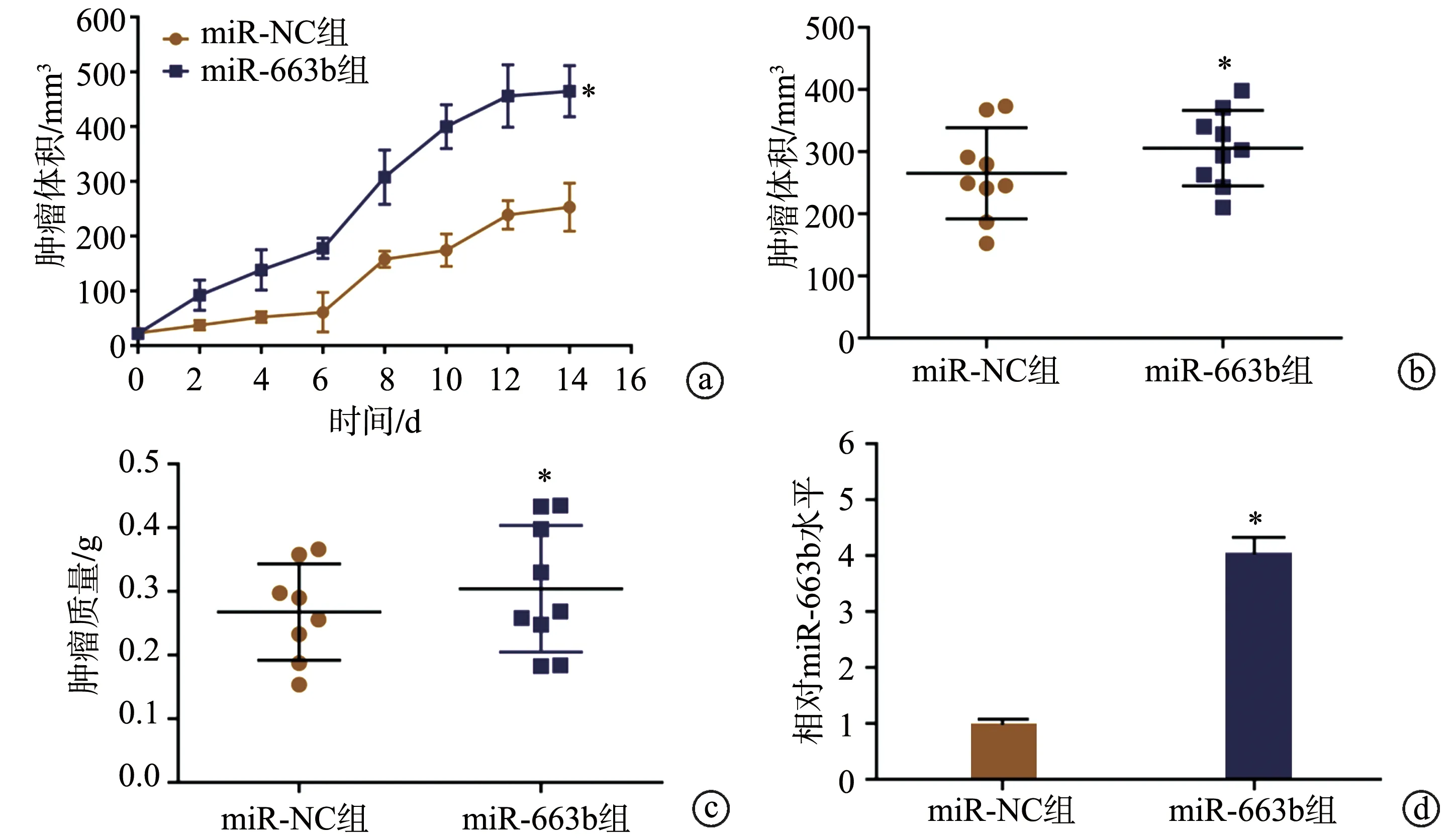
a:裸鼠皮下移植瘤体积变化;b、c:处死裸鼠后取出的肿瘤体积和质量;d:qRT-PCR检测移植瘤组织中miR-663b水平 *:与miR-NC组比较,P<0.05
2.4 miR-663b与ALDH6A1的靶向关系
GEO 2R分析GSE138206、GSE74530数据中,下调的基因以及miRwalk预测miR-663b的靶基因,三者取交集。其中ALDH3A2、ALDH6A1、CYP4B1、DIO2被发现与氧化还原密切相关,进一步对这4个基因进行GSEA分析,结果发现ALDH6A1与细胞增殖和氧化还原均相关,因此选择ALDH6A1进一步研究。miRwalk提示ALDH6A1 mRNA的3’UTR区与miR-663b存在直接结合位点。双荧光素酶报告基因实验提示,共转染miR-663b和野生型ALDH6A1 3’UTR报告基因载体后,荧光素酶活性显著降低(P<0.01)。此外,转染miR-663b能显著下调HSC-3、CAL-27细胞的ALDH6A1 mRNA和蛋白表达(P<0.05),见图4。

a:GSE138206、GSE74530数据集中表达下调的基因与miRwalk预测靶基因的韦恩图;b~d:GSEA分析TCGA_OSCC数据中ALDH6A1表达水平与氧化还原和细胞增殖的关系;e:miRwalk预测的miR-663b与ALDH6A1的3’UTR的结合位点;f:双荧光素酶报告基因实验验证miR-663b与ALDH6A1的靶向关系;g、h:qRT-PCR和Western blot分别检测HSC-3、CAL-27细胞ALDH6A1 mRNA和蛋白表达 *:P<0.05;#:P<0.01
2.5 miR-663b靶向ALDH6A1调节ROS而抑制OSCC细胞增殖
与转染miR-NC mimic比较,HSC-3、CAL-27细胞转染miR-663b mimic显著下调HSC-3、CAL-27细胞的ALDH6A1蛋白表达和ROS水平(P<0.05),升高NADPH/NADP+比值(P<0.05),并促进其体外增殖和克隆形成能力(P<0.05);与转染miR-663b mimic比较,HSC-3、CAL-27细胞共转染miR-663b mimic和ALDH6A1过表达质粒后,显著上调了ALDH6A1蛋白表达和ROS水平(P<0.05),降低NADPH/NADP+比值(P<0.05),并抑制其体外增殖和克隆形成能力(P<0.05),见图5。

a:Western blot检测ALDH6A1蛋白表达;b:转染后细胞中NADPH/NADP+比值;c:转染后DCF-DA荧光探针检测细胞中ROS水平;d、e:CCK-8检测细胞增殖;f:平板克隆形成实验(结晶紫染色×20) *:与miR-NC组比较,P<0.05;#:与miR-663b组比较,P<0.05
3 讨论
miRNA为内源性非编码单链RNA,其能通过与靶RNA的3’UTR区互补配对干扰目标蛋白的合成从而达到调控靶基因的目的。研究发现,miRNA水平异常与众多肿瘤的生物学特征具有明显关联,在不同类型肿瘤中miRNA可以发挥致癌因子或抑癌因子作用[8-9]。miR-663b是一种保守的miRNA,其在结直肠癌[6]、骨肉瘤[7]中作为致癌因子发挥作用。然而,miR-663b在OSCC发生、发展中的作用及机制尚不完全清楚。本研究基于GEO数据库的组织芯片数据分析显示,相比正常对照组织,miR-663b在OSCC组织细胞中表达均显著上调,而在功能实验中,上调miR-663b表达可明显促进OSCC细胞体外增殖和克隆形成能力,且在体内促进了裸鼠皮下移植瘤的生长,提示miR-663b在OSCC中同样发挥致癌因子的作用。
miRNAs通过靶向其下游目的基因发挥调控作用,准确确认miR-663b的下游功能靶点有助于阐明miR-663b促进OSCC细胞体内、外增殖的详细分子机制。本研究通过GSEA发现,miR-663b生物学功能与调节细胞增殖、氧化还原反应及ROS相关。进一步经miRNA-mRNA预测数据库miRwalk与双荧光素酶报告基因实验验证,ALDH6A1 mRNA的3’UTR区被证实与miR-663b存在靶向结合位点,且在OSCC细胞中上调miR-663b水平能有效抑制ALDH6A1蛋白表达。ALDH6A1为醛脱氢酶(aldehyde dehydrogenase,ALDH)家族成员之一,ALDH家族成员可利用NAD或NADP作为辅酶将醛氧化成相应的羧酸NADH或NADPH,参与肿瘤的代谢通路[10]。既往研究发现,ALDH同工酶变异与肝细胞癌密切相关,ALDH6A1被鉴定为肝癌预后的预测因子[11]。此外,Lu等[12]研究指出,过表达ALDH6A1抑制肾透明细胞癌细胞增殖,并通过生物信息学分析认为ALDH6A1与肿瘤代谢有关。本研究结果显示,ALDH6A1的表达与OSCC进展呈负相关,与Lu等[12]研究中ALDH6A1发挥抑癌作用的结果相符合。
细胞增殖及凋亡异常是肿瘤不受限生长的重要基础[13]。NADH的增加是肿瘤细胞代谢重构的显著特征,而过表达ALDH6A1会损害肿瘤细胞代谢。既往研究显示,ALDH水平增加会诱导NADPH/NADP+比值降低,从而破坏线粒体膜电位,而线粒体膜电位的破坏会导致ROS水平升高[14]。在OSCC中,ROS作为应激和呼吸的副产物,其水平下降可能是导致宿主氧化还原状态失衡的重要原因[15]。此外,在肿瘤进展过程中,ROS在肿瘤细胞生长方面发挥重要作用,调节癌细胞中ROS水平可能是癌症治疗的潜在策略[16]。本研究中,上调ALDH6A1表达可显著下调NADPH/NADP+比值,上调ROS水平,OSCC细胞的体外增殖被显著抑制,这与Shin等[11]研究中ALDH6A1所表现的功能相一致,且与本研究中miR-663b在OSCC细胞增殖中的调控作用完全相反。以上数据表明,miR-663b对OSCC细胞增殖的调节作用是通过靶向抑制ALDH6A1表达进而调节ROS水平而实现的。
综上所述,miR-663b在OSCC细胞中表达上调,并可通过靶向抑制ALDH6A1表达调节ROS水平,进而促进OSCC细胞增殖发挥致癌基因作用。miR-663b可能是OSCC的潜在治疗靶点。

