LncRNA PVT1/miR-124轴靶向Jagged-1/Notch通路抑制晶状体纤维化的分子机制研究
汪 涛,张振华,陈文兵,刘建军,张彩霞,吕嘉华
(1.南京医科大学附属苏州科技城医院眼科,江苏 苏州 215153;2.苏州眼耳鼻喉科医院眼科,江苏 苏州 215006;3.苏州大学附属第一医院眼科,江苏 苏州 215006;4.上海复旦大学附属眼耳鼻喉科医院眼科,上海 200031)
纤维化是一种慢性多器官疾病,其主要病变基础为病理性上皮—间充质转化(epithelial-mesenchymal transformation,EMT)[1]。晶状体纤维性疾病,如前囊下白内障(anterior subcapsular cataract,ASC)和后囊膜混浊(posterior caular opacification,PCO),是视力障碍的常见原因[2-3],其细胞学机制都与晶状体上皮细胞(lens epithelial cells,LECs)EMT有关,转化生长因子-β(transforming growth factor-beta,TGF-β)诱导的LECsEMT被认为是构建晶状体纤维性疾病体外模型的有效途径,这为我们开展相关研究提供了方便的实验模型[4]。据报道,众多非编码RNA(non-coding RNA,ncRNA)在调节EMT过程中发挥关键作用[5-7]。深入探索基因调控网络,如LncRNAs/miRNAs/mRNAs,有助于了解晶状体纤维化的进展机制。本研究结合ASC患者的晶状体前囊膜组织转录组学数据,筛选差异性表达最典型的LncRNA PVT1,探究其在LECs纤维化和白内障进展中的作用及潜在分子机制,以期证实针对LncRNA PVT1/miR-124/Jagged-1/Notch通路的药物靶向在预防和治疗ASC、PCO或其他器官纤维化方面的价值。
1 材料与方法
1.1 材料
1.1.1 临床标本采集 共收集了18例捐赠者(年龄40~58岁,男性15例,女性3例)的新鲜晶状体标本,其中9例来自白内障手术患者(ASC患者,晶状体混浊度LOCSⅢ分级4~6级,排除糖尿病葡萄膜炎病史者),术中取出晶状体囊膜后,用撕囊钳分离前囊纤维化组织部分;另9例正常透明晶状体组织来自健康人体的死后捐赠眼(在死后8 h内获得,排除眼部疾病,LOCSⅢ分级1~2级),采用撕囊钳沿晶状体赤道区切开晶状体前囊膜,取晶状体上皮组织。将晶状体上皮组织块置于含体积分数1%胎牛血清、体积分数1%非必需氨基酸、100 IU·mL-1青霉素和100 μg·mL-1链霉素的DMEM培养基中,培养上皮侧面朝上。本研究获南京医科大学附属苏州科技城医院医学伦理委员会批准(2020021),所有实验及样本采集符合《赫尔辛基宣言》。
1.1.2 细胞、主要药物与试剂 人晶状体上皮细胞株SRA01/04(中国医学科学院肿瘤研究所协和医院)。TGFβ2、特异性Notch受体裂解抑制剂同义γ-分泌酶抑制剂Ⅸ(γ-Secretase Inhibitor Ⅸ,GSI-Ⅸ)、TGF-β/Smad抑制剂SB431542(美国Sigma-Aldrich公司);miRNeasy Mini试剂盒(德国Qiagen公司)。GenePORTER转染试剂(美国Genlantis公司);pcDNA3.1质粒(美国Invitrogen公司);SYBR Premix Ex Taq Ⅱ试剂盒、PrimeScript RT Master Mix试剂盒、SYBR PrimeScript RT-PCR试剂盒(日本TaKaRa公司)。初级抗体:纤维蛋白(fibronectin,FN)、Ⅳ型胶原蛋白(collagen type Ⅳ,Col Ⅳ)、钙黏附蛋白E(E-cadherin)、钙黏附蛋白N(N-cadherin)、肌动蛋白α(alpha-smooth muscle actin,α-SMA)、Jagged-1、Notch-1、Notch-2、Notch-3、Snail、Slug(美国Cell Signaling Technology公司)。EZ-Magna RIP RNA结合蛋白免疫沉淀试剂盒(美国Millipore公司)。
1.1.3 主要仪器 ND-1000紫外分光光度计(美国NanoDrop Technologies公司);LSM510激光扫描共聚焦显微镜(德国ZEISS公司);LightCycler 480II实时PCR系统(瑞士Roche公司)。
1.2 方法
1.2.1 细胞转染及分组 将SRA01/04细胞培养于DMEM完全培养基(含体积分数1%胎牛血清、体积分数1%非必需氨基酸、100 IU·mL-1青霉素和100 μg·mL-1链霉素)中。为了研究下调LncRNA-PVT1表达对EMT及下游通路的影响,将SRA01/04细胞分为空白组、TGFβ2组、si-control组、si-PVT1组、si-PVT1+miR-NC组、si-PVT1+miR-124-inhibitor组。空白组细胞不作任何特殊处理。TGFβ2组用5 ng·mL-1TGFβ2作用48 h,si-control组、si-PVT1组、si-PVT1+miR-NC组、si-PVT1+miR-124-inhibitor组分别转染PVT1小分子干扰RNA(siRNAs)的阴性对照序列、si-PVT1-1/si-PVT1-2、si-PVT1+miR-124 inhibitor阴性对照序列或miR-124 inhibitor序列后,用5 ng·mL-1TGFβ2作用48 h。为了研究TGFβ2对LncRNA PVT1表达的影响,将SRA01/04细胞分为空白组、TGFβ2组、GSI-Ⅸ+TGFβ2组和SB431542+TGFβ2组。GSI-Ⅸ+TGFβ2组和SB431542+TGFβ2组分别在TGFβ2作用前60 min加入GSI-Ⅸ(10 μmol·L-1)或SB431542(10 μmol·L-1)。
1.2.2 微阵列分析 使用TRIzol试剂和miRNeasy Mini试剂盒提取组织或细胞总RNA(每3份RNA合并成1份样本)。利用紫外分光光度计检测RNA样本的质量和纯度,通过凝胶电泳测定RNA完整性。利用Agilent Array平台进行微阵列分析,分别以健康眼和ASC眼、TGFβ2组和未经TGFβ2处理的空白组SRA01/04细胞LncRNAs差异表达为目标。从总RNA中去除rRNA后提纯mRNA,然后采用随机引物法扩增样本,并沿着整个转录本长度转录成荧光cRNA。将标记的cRNAs与Arraystar人LncRNA微阵列v3.0杂交。利用Agilent G2505C扫描仪扫描和特征提取软件v11.0.1.1对采集的阵列图像进行分析,用GeneSpring GX v11.5.1软件对微阵列数据进行生物信息学分析和可视化处理。
1.2.3 实时荧光定量PCR法检测基因表达 利用TRIzol试剂提取SRA01/04细胞总RNA,使用DNase I酶提纯基因组DNA。合成cDNA,并在ABI Prism7000热循环仪上进行实时PCR反应。循环条件为:50 ℃ 2 min;95 ℃ 5 min;然后在95 ℃ 10 s和60 ℃ 45 s下进行40次循环。采用RNU6B和GAPDH作为内参。
1.2.4 Western blot法检测蛋白表达 用100 μL裂解液提取细胞总蛋白,经12%聚丙烯酰胺凝胶电泳分离后,半干法电印迹到聚偏氟乙烯膜上。用体积分数5%的脱脂牛奶封闭细胞膜,并与不同的一抗(Jagged-1、Notch-1、Notch-2、Notch-3、Snail、Slug、FN、Col Ⅳ、E-cadherin、N-cadherin、α-SMA)在4 ℃下孵育过夜。然后在室温下与辣根过氧化物酶藕联的二抗孵育1 h。
1.2.5 双荧光素酶报告基因分析 利用两种靶向识别工具Pictar(http://pictar.mdc-berlin.de/)和TargetScan 4.2(http://www.targetscan.org/vert_42/)来寻找LncRNA PVT1和miR-124的潜在靶基因。用PCR法扩增含有预测miR-124结合位点或相应突变位点的Jagged-1和LncRNA PVT1的3’-UTR序列,并转染至pMIR-RB-REPORT荧光素酶编码区。在转染前24 h先将293T细胞接种于96孔板中。次日用LipofectamineTM2000转染试剂将100 ng·mL-1报告质粒和50 nmol·L-1的miR-124 mimics或对照序列共转染至293T细胞,用双荧光素酶检测系统检测荧光素酶活性。
1.2.6 RNA结合蛋白免疫共沉淀(RNA binding protein immunoprecipitation,RIP)法分析 裂解1×107个细胞,将100 μL细胞裂解混合物与含有抗Ago2结合磁珠的RIP缓冲液共孵育。用蛋白酶K缓冲液消化样本,分离免疫沉淀RNA。
1.3 统计学方法

2 结果
2.1 微阵列分析LncRNAs差异表达谱
利用人LncRNA微阵列分析,热图显示健康眼、ASC眼前囊膜组织存在628个差异性表达的LncRNAs(变化倍数≥2.0,P<0.05),其中287个LncRNAs表达上调,341个LncRNAs表达下调,其中PVT1上调最明显(图1a)。此外,在LECs样本中,空白组、TGFβ2组存在371个差异性表达的LncRNAs(变化倍数≥2.0,P<0.05),其中171个LncRNAs表达上调,200个LncRNAs表达下调,PVT1是上调最明显(前五位)的LncRNAs之一(图1b)。
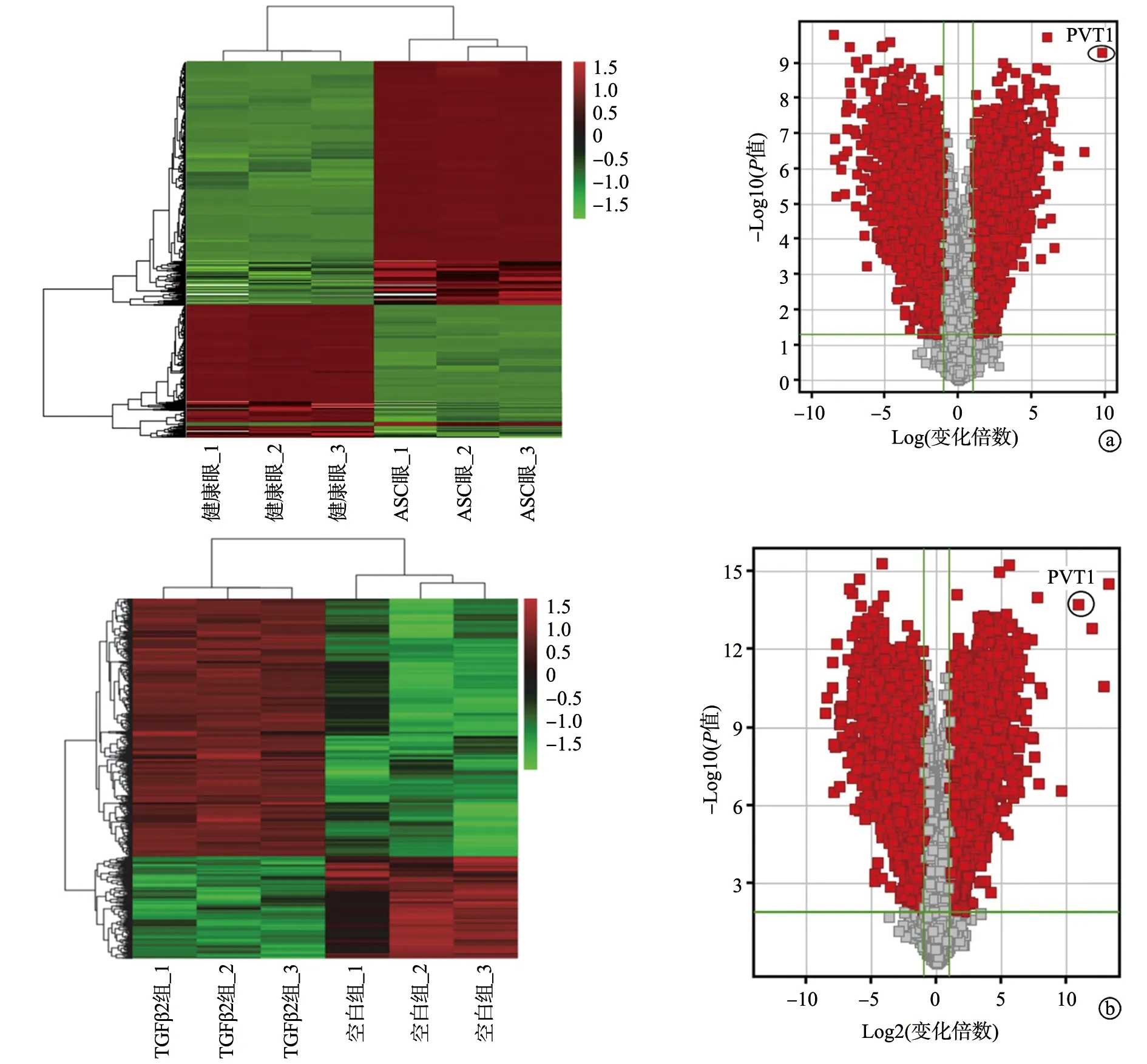
a:健康眼和ASC眼差异性表达的聚类分析热图和火山图;b:空白组和TGFβ2组SAR01/04细胞差异性表达的聚类分析热图和火山图
2.2 实时荧光定量PCR法检测前囊膜组织和细胞中LncRNA PVT1、miR-124 mRNA表达水平
ASC眼的前囊膜组织和TGFβ2组SAR01/04细胞中LncRNA PVT1 mRNA表达水平较健康眼或空白组细胞升高(P<0.05),同时miR-124 mRNA表达水平降低(P<0.05)。经Spearman秩相关系数分析,在ASC眼的前囊膜组织或TGFβ2组SRA01/04细胞中LncRNA PVT1与miR-124表达水平均呈负相关性(P<0.05)。此外,分别用1 ng·mL-1、2 ng·mL-1、5 ng·mL-1TGFβ2作用于细胞48 h,LncRNA PVT1 mRNA表达水平逐渐升高(P<0.05);用5 ng·mL-1TGFβ2分别作用于细胞12 h、24 h、48 h,LncRNA PVT1 mRNA表达水平亦逐渐升高(P<0.05),说明TGFβ2可显著诱导SRA01/04细胞LncRNA PVT1过表达,且呈剂量依赖性和时间依赖性,见图2。
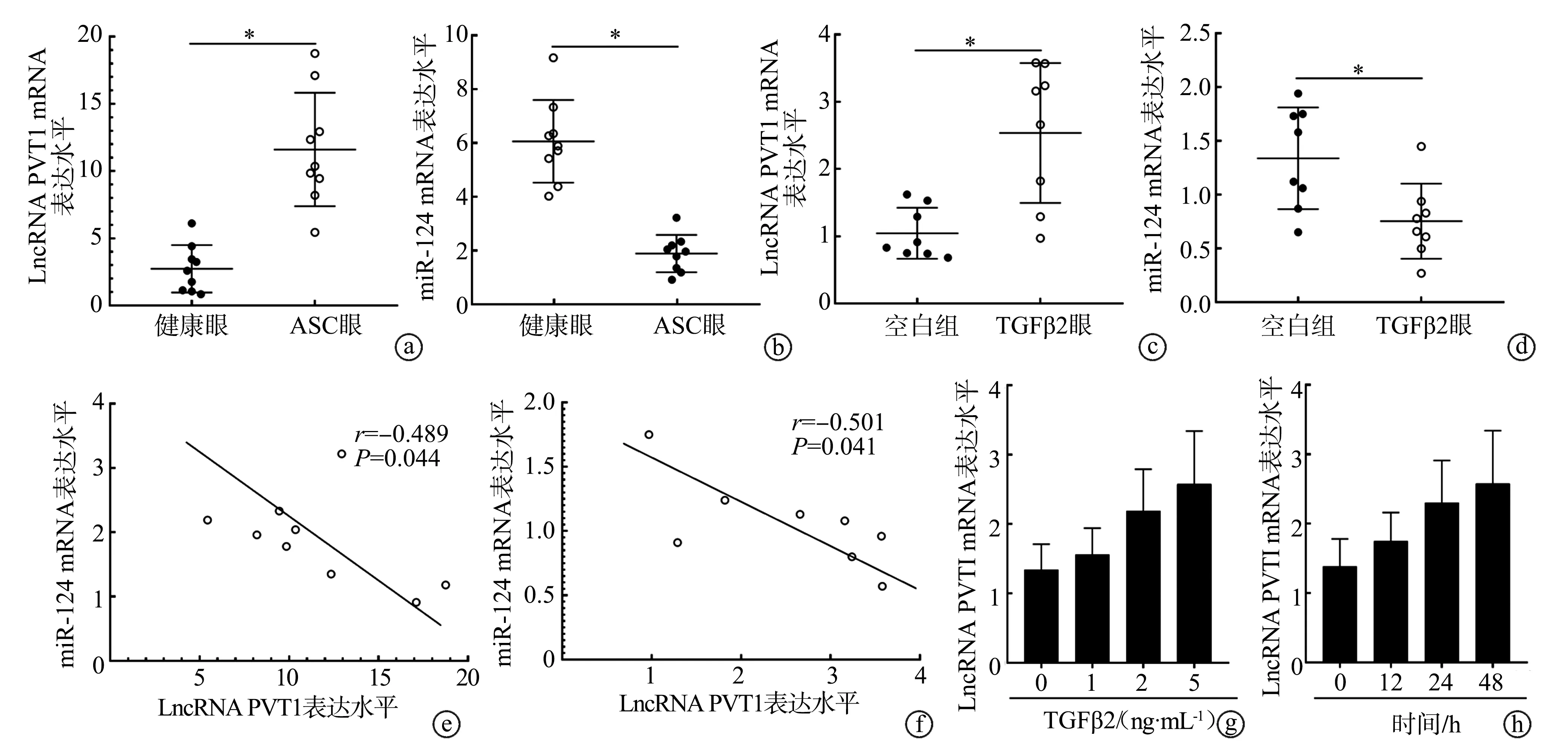
a:前囊膜组织LncRNA PVT1 mRNA表达差异(n=9);b:前囊膜组织miR-124 mRNA表达差异(n=9);c:SRA1/04细胞中LncRNA PVT1 mRNA表达差异(n=8);d:SRA1/04细胞中miR-124 mRNA表达差异(n=8);e:前囊膜组织LncRNA PVT1 mRNA和miR-124 mRNA表达的关系;f:SRA1/04细胞LncRNA PVT1 mRNA和miR-124 mRNA表达的关系;g:不同浓度TGFβ2作用于SRA1/04细胞48 h;h:不同时间5 ng·mL-1 TGFβ2作用于SRA1/04细胞 *:P<0.05
2.3 Western blot法检测SRA01/04细胞EMT标记蛋白表达
与空白组相比,TGFβ2组上皮分化标志物E-cadherin蛋白表达下调,同时间充质细胞标志物FN蛋白表达上调(P<0.05)。然而分别转染si-PVT1-1和si-PVT1-2后,E-cadherin蛋白表达高于TGFβ2组和si-control组,同时FN蛋白表达低于TGFβ2组和si-control组,尤其以si-PVT1-2组变化最明显(P<0.05),见图3a。故选择转染si-PVT1-2用于后续实验。此外,与空白组相比,TGFβ2组和si-control组间充质细胞标志物FN、α-SMA、Col IV、Snail、Slug蛋白表达上调,而si-PVT1组和si-PVT1+miR-NC组上述蛋白表达低于TGFβ2组和si-control组,但si-PVT1+miR-124-inhibitor组可逆转si-PVT1对上述蛋白表达的下调作用(P<0.05),见图3b。
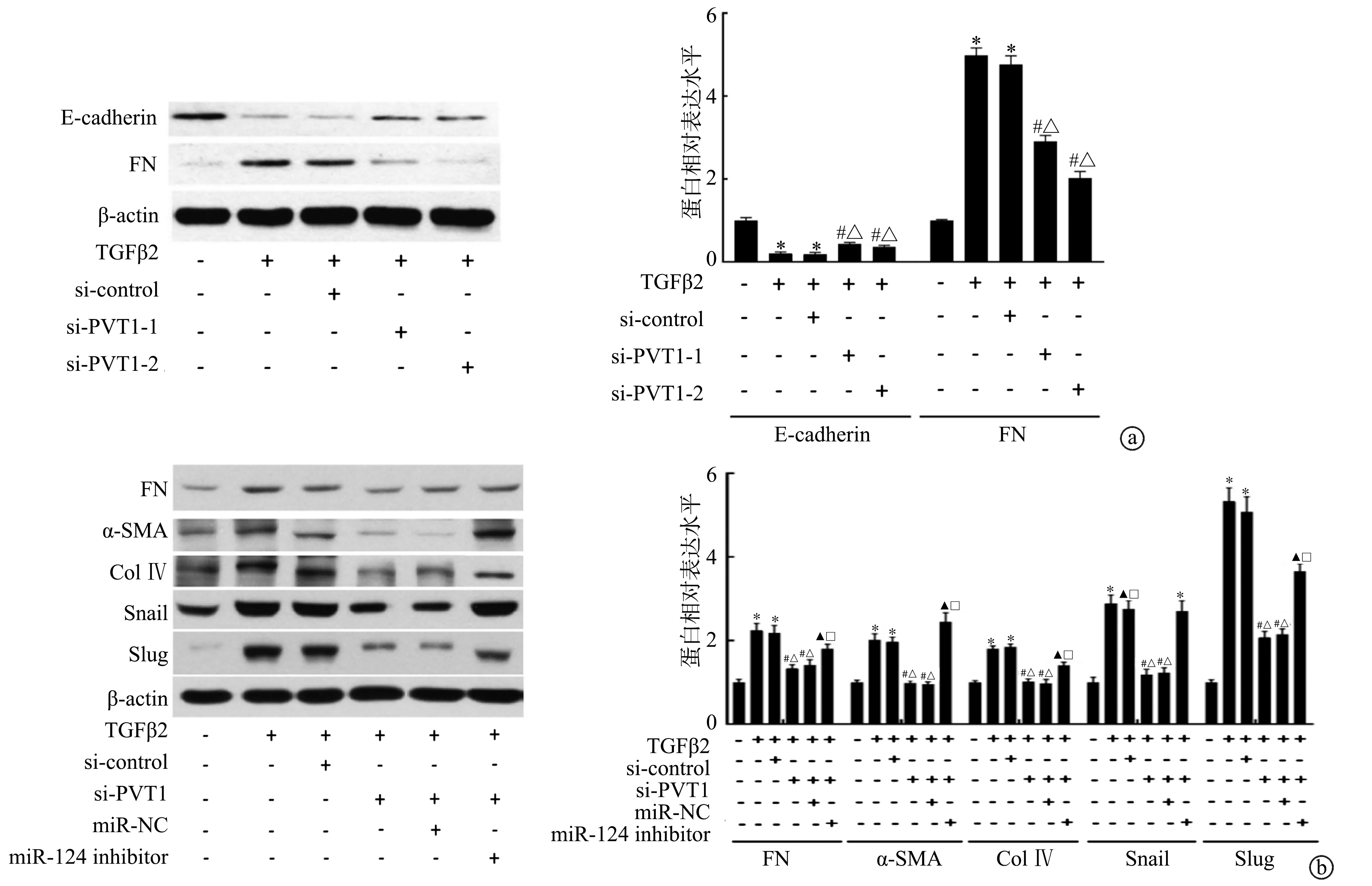
a:FN、E-cadherin蛋白表达;b:FN、α-SMA、Col Ⅳ、Snal、Slug蛋白表达 *:与空白组相比,P<0.05;#:与TGFβ2组相比,P<0.05;△:与si-control组相比,P<0.05;▲:与si-PVT1组相比,P<0.05;□:与si-PVT1+miR-NC组相比,P<0.05
2.4 双荧光素酶报告基因验证LncRNA PVT1、miR-124、Jagged-1之间的靶向作用
与转染miR-NC相比,转染miR-124 mimics能显著降低PVT1、Jagged-1野生型(位点1、位点2)的荧光素酶活性(P<0.05),见图4。
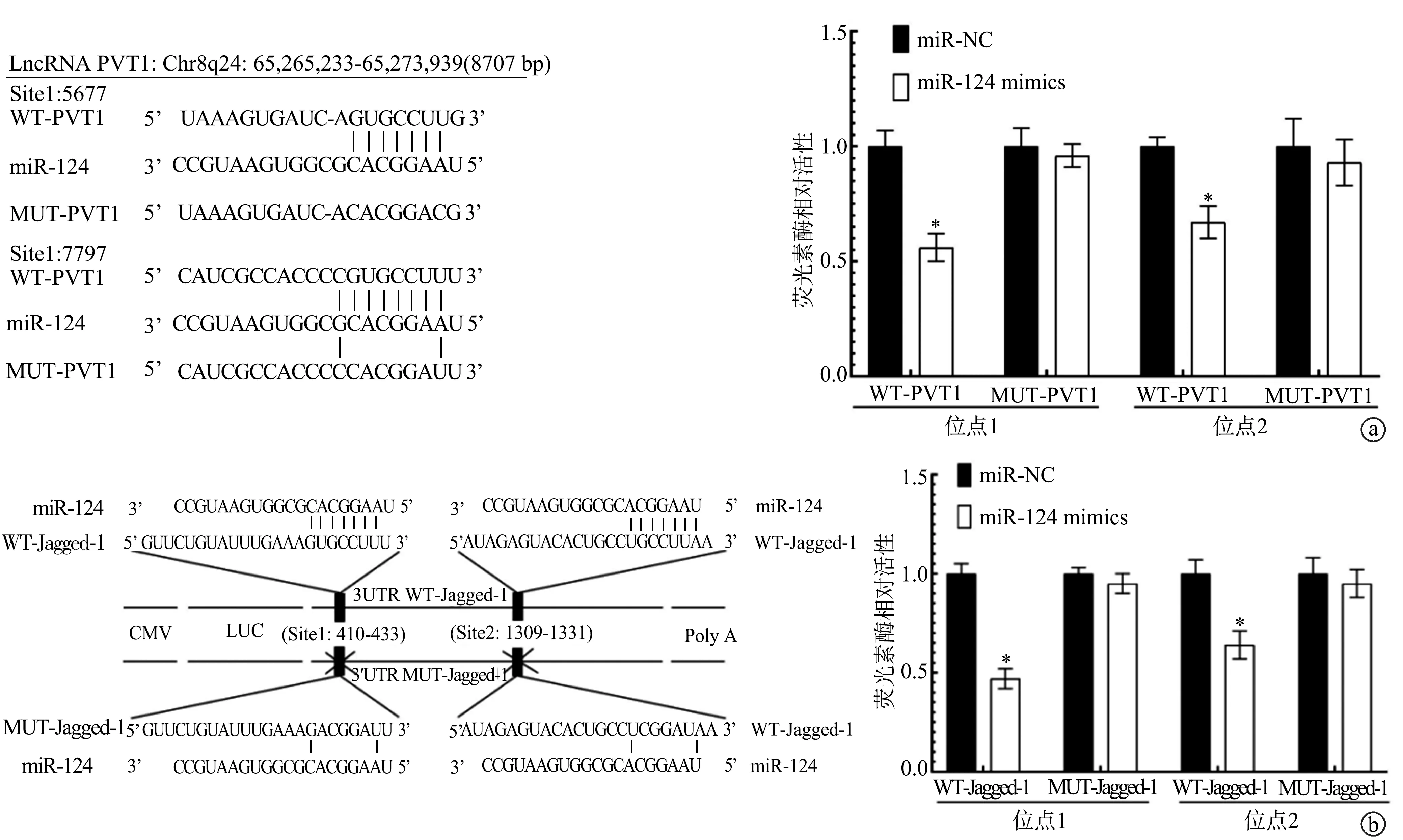
a:LncRNA PVT1与miR-124靶向结合关系;b:Jagged1与miR-124靶向结合关系 *:与miR-NC相比,P<0.05
2.5 RIP法分析LncRNA PVT1和miR-124的调控关系
结果证实,LncRNA PVT1和miR-124都特异性富集了Ago2抗体相关复合物(P<0.05),见图5,表明PVT1通过“海绵吸附”miR-124,负向调节miR-124的表达。
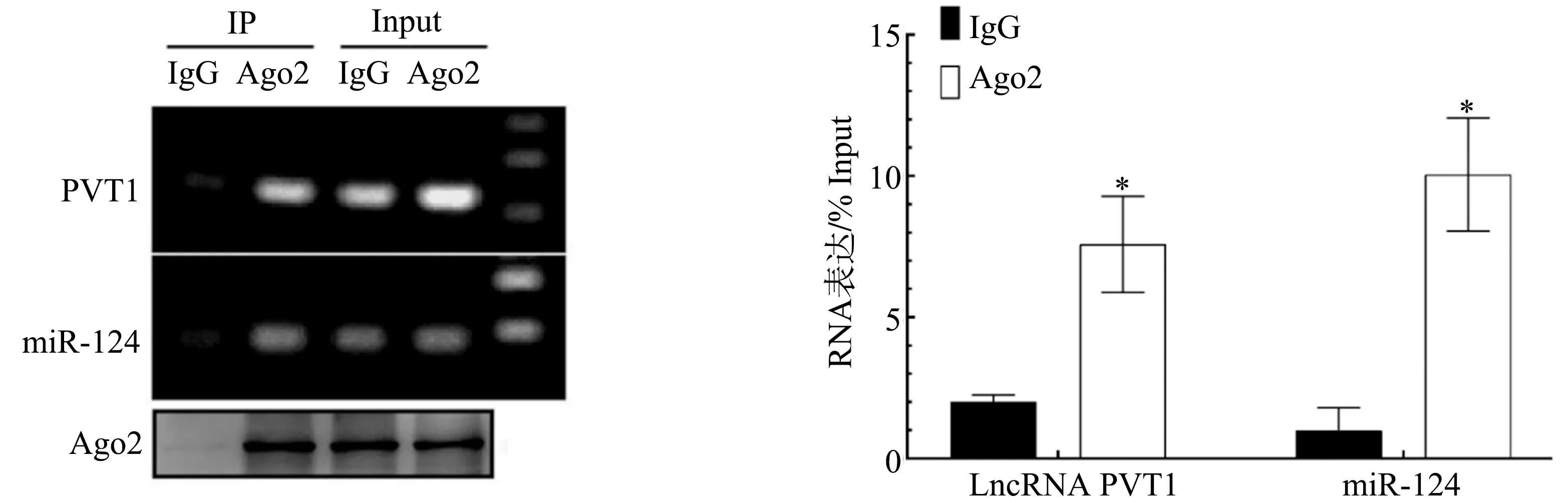
*:与IgG相比,P<0.05
2.6 Western blot法检测SRA01/04细胞Jagged-1/Notch通路相关蛋白表达
与空白组相比,TGFβ2组Jagged-1、Notch-1、Notch-2、Notch-3蛋白表达显著上调,而GSI-Ⅸ+TGFβ2组、SB431542+TGFβ2组Jagged-1、Notch-1、Notch-2、Notch-3蛋白表达则低于TGFβ2组(P<0.05),见图6a。此外,同样在TGFβ2作用下,si-PVT1组Jagged-1、Notch-1、Notch-2、Notch-3蛋白表达则低于TGFβ2组和si-control组,同时si-PVT1+miR-124-inhibitor组可逆转si-PVT1对上述蛋白表达的下调作用(P<0.05),见图6b。
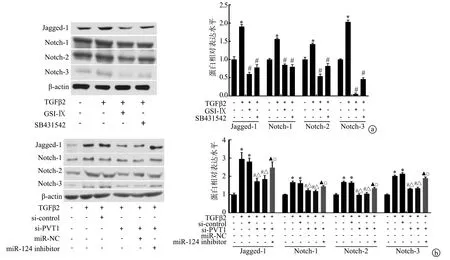
a: TGFβ2对Jagged-1、Notch-1、Notch-2、Notch-3蛋白表达的影响;b:LncRNA PVT1对Jagged-1、Notch-1、Notch-2、Notch-3蛋白表达的影响 *:与空白组相比,P<0.05;#:与TGFβ2组相比,P<0.05;△:与si-control组相比,P<0.05;▲:与si-PVT1组相比,P<0.05;□:与si-PVT1+miR-NC组相比,P<0.05
3 讨论
本研究首先基于微阵列数据,发现LncRNA PVT1在ACS前囊膜组织或TGFβ2诱导的LECs中明显表达上调。进一步的细胞实验证实,TGFβ2可诱导LECs中上皮分化标志物E-cadherin蛋白表达下调,同时间充质细胞标志物FN蛋白表达上调,说明TGFβ2可促进LECs向间充质细胞表型转化。在机制分析实验中,TGFβ2可诱导SRA01/04细胞LncRNA PVT1过表达,这是一个呈剂量依赖性和时间依赖性的过程;而PVT1可负性调节miR-124,进而导致Jagged-1/Notch信号通路激活。因此,我们认为PVT1/miR-124/Jagged-1/Notch轴可能是TGFβ2诱导LECs发生EMT的重要分子机制之一。
LncRNA是非编码转录体,虽然缺乏蛋白质编码能力,但其在调节基因表达方面起着关键作用[8]。LECs发生EMT是导致ASC或PCO等继发性白内障的重要原因,而TGFβ2被认为是一个重要的诱因[2-4]。本研究结果显示,TGFβ2以剂量依赖性和时间依赖性的方式诱导SRA01/04细胞LncRNA PVT1表达上调,这一点在ASC眼的前囊膜组织中也得到证实,说明LncRNA PVT1参与了ASC的病变过程。Western blot结果显示,TGFβ2可抑制上皮分化标志物E-cadherin蛋白表达,同时诱导间充质细胞标志物FN蛋白表达上调,且TGFβ2诱导LECs发生EMT的作用受到LncRNA PVT1基因敲除的影响,下调PVT1基因表达后,miR-124表达相应上调,而TGFβ2对LECs中EMT标志物表达的影响得以改善。因此,我们认为TGFβ2通过PVT1依赖性机制诱导LECs发生EMT。
在分子机制方面,LncRNAs通过与miRNAs相互作用,调节miRNA下游靶基因的表达,发挥其在疾病发生发展中的作用。研究显示,PVT1能与miR-214[9]、miR-26b[10]等相互作用,进而调节细胞下游TGFβ1信号转导,影响肿瘤细胞的侵袭和迁移。本研究双荧光素酶报告基因实验和免疫共沉淀实验证实,PVT1可通过吸附miR-124进而影响miR-124下游通路Jagged1/Notch轴的激活。miR-124属于肿瘤抑制分子,研究显示其在癌症[11-12]、肾间质纤维化[13]等疾病中可以抑制细胞EMT进程。此外,miR-124可以通过调节STAT3抑制视网膜母细胞瘤细胞的活性和侵袭[14]。本研究发现,ASC眼前囊膜组织中miR-124表达下降,说明其参与了继发性白内障的发病,并且miR-124在TGFβ2诱导的LECs-EMT中起着重要作用。目前已发现多种miR-124靶基因与纤维化有关,包括ColⅠ[15]、结缔组织生长因子[16]、Smad4[17]等。在本研究中,我们确定了其另一个靶基因Jagged-1,miR-124可直接与Jagged-1的3’-UTR相互作用,从而负向调节Jagged-1的表达。此外,miR-124也可影响Notch-1、Notch-2和Notch-3受体表达,这意味着miR-124除了直接抑制Jagged-1信号传递外,还可抑制下游Notch受体的表达,进而影响LECs纤维化进程。Notch信号在胚胎发育[18]、肿瘤转移[19]和各种纤维化疾病[20]中起关键作用。因此阻断Jagged-1信号传导,可以整体逆转TGFβ2诱导的LECs-EMT进程。
综上,TGFβ2通过一种LncRNA PVT1依赖机制诱导LECs发生EMT。其机制之一是LncRNA PVT1通过“海绵吸附”miR-124负性调节其表达,进而诱导下游Jagged-1/Notch信号通路激活。因此,PVT1/miR-124/Jagged-1/Notch轴参与了TGFβ2诱导的LECs-EMT进程,而LncRNA PVT1有望成为治疗ASC或PCO的潜在靶点。

