芍药苷对放射性肝纤维化大鼠的作用机制研究*
放射治疗是治疗恶性腹部疾病的重要手段,然而,它不可避免地会对器官造成损害(如放射性肝纤维化),有时甚至是致命的
。放射性肝损伤是放射治疗和辐射事故的潜在后遗症。辐射致肝损伤的晚期后遗症包括实质细胞严重枯竭,中央静脉和导管周围的纤维组织明显增多
。因此,开发新的预防策略对于改善辐射致肝损伤具有重要意义。越来越多的证据表明,烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX4)在肝星状细胞和肝细胞中高表达,敲低NOX4可抑制氧化应激的产生,降低α-平滑肌肌动蛋白(α-SMA)的表达,从而抑制肝纤维化进展
。自噬是一种高度保守的代谢过程,它消除受损成分以维持正常的细胞内稳态,并通过分解细胞内成分作为替代能源
。最近研究表明,在四氯化碳(CCl
)诱导的急、慢性肝损伤模型中,肝组织自噬活性增强。使用自噬抑制剂或者敲除自噬相关基因7(ATG7)可抑制肝星状细胞激活,导致肝纤维化进程受阻
。芍药苷是我国传统中药芍药的主要活性成分。芍药苷具有突出的肝保护功效,能减轻曼氏血吸虫病肝损伤后肝纤维化
。因此,芍药苷可能在放射性肝纤维化中具有重要作用。本研究旨在探究芍药苷对放射性肝纤维化的作用及其作用机制。
1 材料与方法
1.1 实验动物 45只SPF级雄性SD大鼠,体质量(200±20)g,饲养在温度(23±2)℃、湿度(58±2)%、光照可控(12 h光/暗周期)的环境下,所有大鼠自由进食和饮水。待所有大鼠适应性喂养1周后,进行造模操作。
2.1.1 A组:每天给予患者常规构音障碍康复练习,每日1次,每次20分钟,每周5次,持续2周。B组:在A组基础上联合针灸,每日针灸1次,1次针灸治疗(20分钟),每周五天,持续2周。
1.2 主要材料 芍药苷(纯度≥98%)购自成都德思特生物技术有限公司;复方鳖甲软肝片购自内蒙古福瑞医疗科技股份有限公司;Masson三色染色试剂盒购自南京森贝伽生物科技有限公司;丙二醇(MDA)检测试剂盒和谷胱甘肽(GSH)检测试剂盒购自北京雷根生物技术有限公司;超氧化物歧化酶(SOD)活性检测试剂盒购自北京索莱宝科技有限公司;α-SMA、collagenⅠ和fibronectin抗体购自英国Abcam公司; Bax、Bcl-2和NOX4抗体购自美国GeneTex; Beclin1、LC3和p62抗体购自美国Cell Signaling Technology;GAPDH抗体购自武汉三鹰生物技术有限公司。
1.3 动物分组、造模及给药处理 造模前12 h,大鼠禁食不禁水。将45只SD大鼠随机分为对照组、模型组、阳性药对照组、芍药苷低剂量组和芍药苷高剂量组,每组各9只。除对照组外,其余组均参照文献
,建立肝纤维化模型。对照组大鼠只麻醉,不进行照射。随后阳性对照组大鼠灌胃复方鳖甲软肝片0.6 g/kg
,芍药苷低剂量组灌胃芍药苷0.1 g/kg,芍药苷高剂量组灌胃芍药苷0.2 g/kg
,对照组和模型组大鼠灌胃等量溶剂。所有大鼠每天给药1次,连续给药8周
。
OPNET采用离散事件驱动的模拟机理和混合建模机制,并提供了包括模型设计、仿真和统计量收集、分析的各种研究工具,同时它还引入了面向对象的编程技术。OPNET的特点是建模方便,功能强大,尤其是在大规模网络模拟中表现卓越。
1.4 HE染色检测肝病理学变化 末次给药结束后,所有大鼠禁食12 h,3%戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,随后处死大鼠,取肝脏。4%多聚甲醛固定组织24 h,梯度乙醇脱水,二甲苯透明。组织块浸蜡、包埋。对包埋的组织块进行修块后,切片机切片。最后将切片置于温箱中烘干。石蜡切片二甲苯、梯度乙醇脱蜡至水,蒸馏水冲洗切片后,苏木素染色液染色15 min,切片流水冲洗1 min,1%盐酸乙醇分化3 s后,氨水返蓝,伊红染色液染色10 s后,流水冲洗。切片梯度乙醇脱水、二甲苯脱水透明。滴加中性树胶至载玻片上封片,显微镜下观察。
1.7 Western blot检测α-SMA、collagenⅠ、fibronectin、Bax、Bcl-2、NOX4、Beclin1、LC3和p62蛋白表达 常规方法操作。
而实际上,林某强只是名义上承包了这个项目,真正负责人是林中伟。业主方城投公司将工程款结算给市建公司,市建公司扣除管理费后再打到林某强的个人银行账户,林某强的这个银行账户由林中伟公司的财务负责人保管。这个工程的利润一部分用于林中伟公司的开支,一部分用于林中伟个人的开支。
1.8 试剂盒检测血清MDA、GSH和SOD水平 按照试剂盒说明书所示,检测血清中MDA、GSH和SOD水平。
1.5 全自动生化仪检测血清生化指标 末次给药结束后,所有大鼠禁食12 h,3%戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,腹主动脉采血,室温静置20 min后,12 000 rpm离心20 min取上层血清。采用全自动生化仪检测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)水平。
1.6 Masson染色检测胶原沉积 常规方法操作。
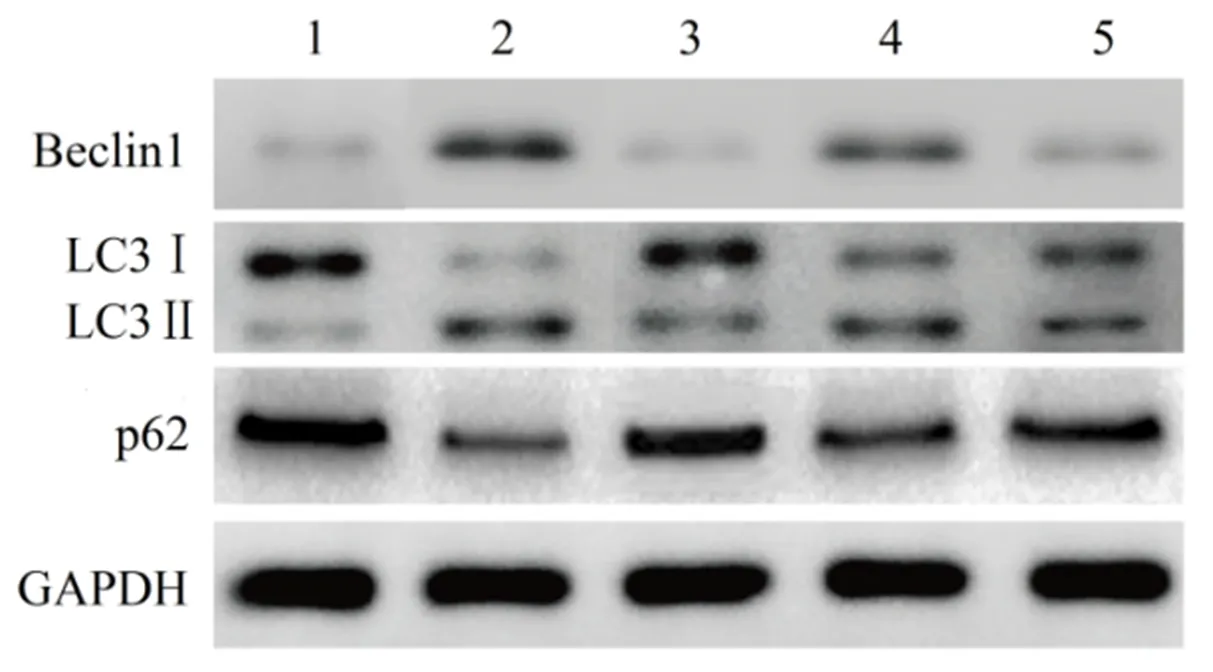
2.5 芍药苷对大鼠自噬的影响 见图6、表6。
2 结果
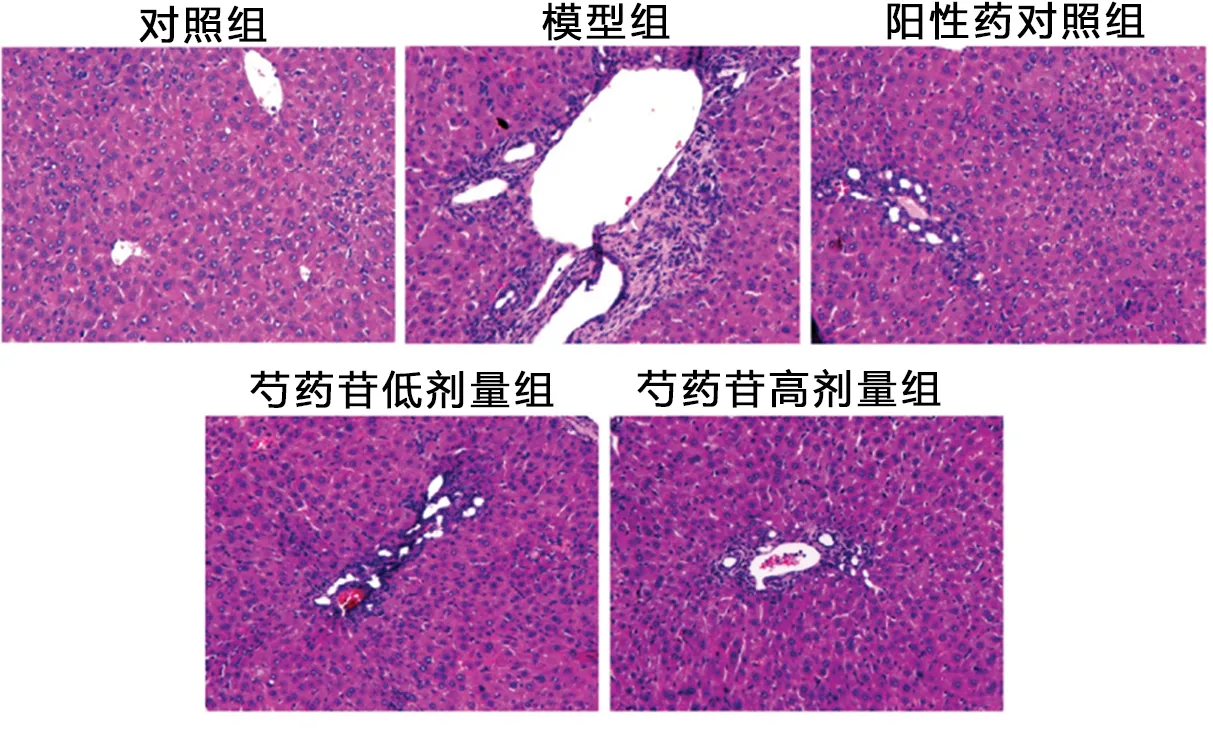
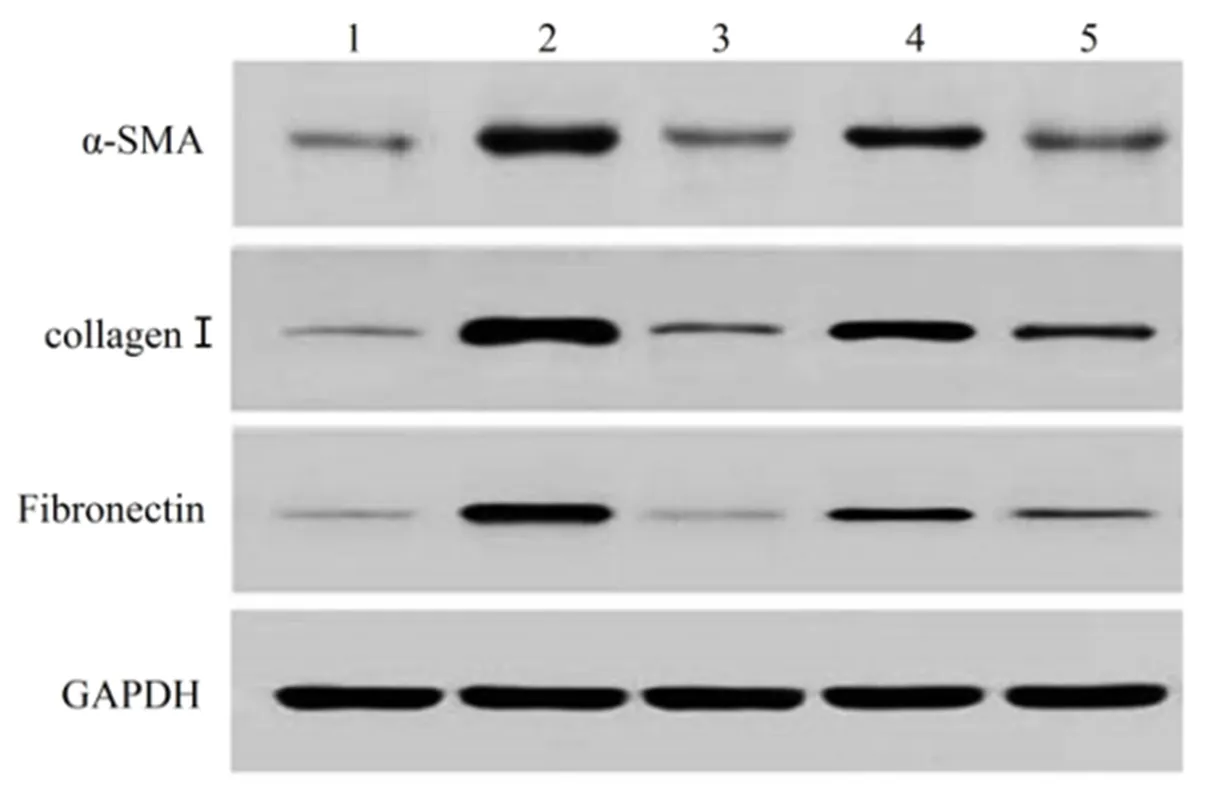
2.1 芍药苷对大鼠肝病理学变化和生化指标的影响 对照组大鼠肝组织无明显异常,肝小叶结构完整清晰,肝细胞排列整齐,呈索状分布,未见不规则血窦,汇管区无扩大,未见蓝色着染胶原沉积;与对照组相比,模型组大鼠肝细胞肿胀,胞浆疏松,放射肝索排列紊乱,肝小叶结构受损,在肝小叶中央和汇管区有大量蓝色着染胶原产生,肝脏/体重比显著升高(
<0.05),血清ALT、AST、ALP水平以及α-SMA、collagenⅠ和fibronectin蛋白表达显著升高(
<0.05);与模型组比较,阳性药对照组、芍药苷低剂量组和芍药苷高剂量组大鼠肝组织病理学变化得到明显改善,肝脏/体重比显著降低(
<0.05),血清ALT、AST、ALP水平以及α-SMA、collagenⅠ和fibronectin蛋白表达显著降低(
<0.05),其中芍药苷的作用呈剂量依赖性。见图1~ 3,表1、 2。
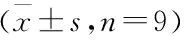
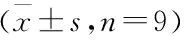
2.4 芍药苷对大鼠氧化应激的影响 见表5。
房间的顶是星空以后,刘必芒又突发奇想,说这样,要充分体现这个星空包房的的主题,不光星星是星星,明星也是星星,所以,在墙壁上要贴满明星们的脸的照片,而且要注意剪裁,只要他们的脸,这就能让人彻底感觉这个包厢星光熠熠。
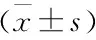
2.3 芍药苷对大鼠NOX4蛋白表达的影响 见图5、表4。
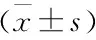
2.2 芍药苷对大鼠细胞凋亡的影响 见图4、表3。
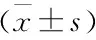
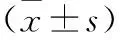
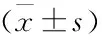
3 讨论
肝脏非实质细胞,如枯否细胞、肝窦内皮细胞和肝星状细胞是已知的放射敏感性细胞。这些细胞释放促进肝纤维化的各种物质,在放射过程中导致肝脏结构和功能扭曲
。放射性治疗还可导致肝实质细胞死亡。众所周知,肝细胞死亡是其他肝病进展以及肝纤维化、肝硬化和肝细胞癌发展的最终驱动力
。因此,阻断或逆转肝纤维化可能是阻止其发展为肝细胞癌的新方法。
在肝纤维化过程中,充满薄层通透性结缔组织的窦周间隙中肝星状细胞被激活并分化为肌成纤维细胞(其特征是α-SMA和collagenⅠ表达上调),从而促进肝纤维化
。此外,肝细胞凋亡是肝纤维化的主要特征之一。肝细胞凋亡主要受Bcl-2家族蛋白的调控,其中Bcl-2和Bax是重要的凋亡调控基因
。已有研究表明,海风藤通过减轻氧化应激、炎症反应和抑制肝细胞凋亡,改善CCl
诱导的肝损伤,抑制肝纤维化
。随着世界中医药研究的发展,传统药用植物中的保肝药物因其临床疗效好、副作用小而备受关注
。近年来的研究表明,芍药苷具有广泛的生物活性,包括保护肝脏、减轻胆汁淤积、减轻肝纤维化、预防非酒精性脂肪性肝病和多途径抑制肝癌等
。已有证据显示,芍药苷可明显降低放射性肝纤维化大鼠肝组织羟脯氨酸含量、血清转化生长因子-β1、透明质酸、collagenⅢ和fibronectin水平,减轻肝损伤和胶原沉积
。本研究结果显示,芍药苷给药处理可明显改善放射性肝纤维化大鼠肝组织病理学变化和胶原沉积,降低血清ALT、AST和ALP水平,提示芍药苷可改善放射性肝纤维化大鼠肝功能。此外,芍药苷给药处理可抑制肝组织中α-SMA、collagenⅠ和fibronectin蛋白表达,抑制肝细胞中Bax蛋白表达,促进Bcl-2蛋白表达,提示芍药苷可通过抑制肝星状细胞激活和肝细胞凋亡,改善大鼠肝纤维化。
蠹害事史遂谳、斩犯李枨审疑开释谳语、假中书高垌谳语、军犯王养禛谳语、军犯刘尧封胡咏谳语、徒犯刘维坤谳语、人命事孙述孙府谳语、杖犯张森谳语。[29](P594)
氧化应激参与纤维化疾病的发生发展。氧化应激和活性氧的产生可能是肝星状细胞激活和肝损伤的重要机制
。研究表明,NOX4是NOX家族亚型之一,抑制NOX4表达可明显改善组织氧化应激损伤,从而减轻细胞凋亡
。在肝纤维化的相关研究中,白花丹素通过下调NOX4蛋白表达抑制MDA水平,升高SOD和谷胱甘肽过氧化物酶(GSH-Px)水平,减轻CCl
诱导的肝纤维化
。同样的,虎杖苷通过下调NOX4表达来降低非酒精性脂肪性肝炎大鼠氧化应激,从而改善大鼠肝纤维化
。本研究结果显示,芍药苷可明显降低肝纤维化大鼠NOX4蛋白表达,提示芍药苷在放射性肝纤维化中的保护作用可能与改善组织氧化应激损伤有关。进一步实验结果显示,芍药苷可降低放射性肝纤维化大鼠血清中MDA水平,升高GSH和SOD水平。提示芍药苷可能通过下调NOX4蛋白表达从而抑制氧化应激反应,在肝纤维化中发挥保护作用。
自噬是哺乳动物细胞内成分降解和再循环的一种过程,在纤维化等许多病理过程中都有发现。关于肝脏,自噬被认为在急性肝损伤和各种原因引起的慢性损伤的肝内稳态中扮演着不同的角色
。一方面,自噬激活对肝脏损伤有保护作用。在体内研究中,用特异性抑制剂3-甲基腺嘌呤药理上抑制自噬可显著增加肝脏损伤
。另一方面,在大鼠模型中,炎症反应可介导自噬激活,从而促进肝纤维化过程。人参皂苷Rg3通过抑制自噬改善硫代乙酰胺诱导的亚急性和慢性肝损伤引起的肝纤维化
。同样的, Ye等
的研究也证明了自噬拮抗剂羟基氯喹通过抑制自噬和胶原沉积在肝纤维化大鼠中发挥抗纤维化作用。本研究结果显示,肝纤维化大鼠肝组织中Beclin1和LC3Ⅱ/LC3Ⅰ蛋白表达上调,p62蛋白表达下调,肝组织中自噬被激活。而芍药苷能明显下调肝纤维化大鼠Beclin1和LC3Ⅱ/LC3Ⅰ蛋白表达,上调p62蛋白表达,从而抑制自噬过程,提示芍药苷通过抑制自噬,在肝纤维化中发挥保护作用。
[1]Citrin DE.Recent Developments in Radiotherapy[J].N Engl J Med,2017,377(11):1065-1075.
[2]Koay EJ,Owen D,Das P.Radiation-Induced Liver Disease and Modern Radiotherapy[J].Semin Radiat Oncol,2018,28(4):321-331.
[3]Aydln MM,Akçal1 KC.Liver fibrosis[J].Turk J Gastroenterol, 2018,29(1):14-21.
[3]Du JJ,Sun JC,Li N,
.β-Arrestin2 deficiency attenuates oxidative stress in mouse hepatic fibrosis through modulation of NOX4[J].Acta Pharmacol Sin, 2020,28(2):321-332.
[4]Galluzzi L,Green DR.Autophagy-Independent Functions of the Autophagy Machinery[J].Cell, 2019,177(7):1682-1699.
[5]Zhang J,Jiang N,Ping J,
.TGF-β1-induced autophagy activates hepatic stellate cells via the ERK and JNK signaling pathwa-ys[J].Int J Mol Med, 2020,47(1):256-266.
[6]Abd El-Aal NF,Hamza RS,Harb O.Paeoniflorin targets apoptosis and ameliorates fibrosis in murine schistosomiasis mansoni: A novel insight[J].Exp Parasitol, 2017 Dec;183:23-32.
[7]胡宗涛,高世乐,秦峰,等.单次剂量照射制备大鼠放射性肝纤维化模型的建立与评价[J].安徽医药,2013,17(1):63-67.
[8]由淑萍,赵军,马龙,等.肉苁蓉乙醇提取物抗大鼠免疫性肝纤维化的作用及其机制[J].中国药理学与毒理学杂志,2016,30(5):504-510.
[9]Zhou HQ,Liu W,Wang J,
.Paeoniflorin attenuates ANIT-induced cholestasis by inhibiting apoptosis in vivo via mitochondria-dependent pathway[J].Biomed Pharmacother,2017,89(6):696-704.
[10]Abou-Zeid SM,El-Bialy BE,El-Borai NB,
.Radioprotective effect of Date syrup on radiation- induced damage in Rats[J].Sci Rep,2018,8(1):7423-7436.
[11]Munoz-Schuffenegger P,Ng S,Dawson LA.Radiation-Induced Liver Toxicity[J].Semin Radiat Oncol,2017,27(4):350-357.
[12]Toesca DAS,Ibragimov B,Koong AJ,
.Strategies for prediction and mitigation of radiation-induced liver toxicity[J].J Radiat Res,2018,59(suppl_1):i40-i49.
[13]Khomich O,Ivanov AV,Bartosch B.Metabolic Hallmarks of Hepatic Stellate Cells in Liver Fibrosis[J].Cells,2019,9(1):24-32.
[14]Zhang K,Zhang M,Yao Q,
.The hepatocyte-specifically expressed lnc-HSER alleviates hepatic fibrosis by inhibiting hepatocyte apoptosis and epithelial-mesenchymal transition[J].Theranostics,2019,9(25):7566-7582.
[15]Yu HH,Qiu YX,Li B,
.Kadsura heteroclita stem ethanol extract protects against carbon tetrachloride-induced liver injury in mice via suppression of oxidative stress,inflammation,and apoptosis[J].J Ethnopharmacol,2021,267(2):113-124.
[16]Li ZW,Kuang Y,Tang SN,
.Hepatoprotective activities of Antrodia camphorata and its triterpenoid compounds against CCl
-induced liver injury in mice[J].J Ethnopharmacol, 2017,206:31-39.
[17]Ma X,Zhang W,Jiang Y,
.Paeoniflorin,a Natural Product With Multiple Targets in Liver Diseases-A Mini Review[J].Front Pharmacol, 2020,11(4):531-540.
[18]Hu Z,Qin F,Gao S,
.Paeoniflorin exerts protective effect on radiation-induced hepatic fibrosis in rats via TGF-β1/Smads signaling pathway[J].Am J Transl Res,2018,10(3):1012-1021.
[19]Luangmonkong T,Suriguga S,Mutsaers HAM,
.Targeting Oxidative Stress for the Treatment of Liver Fibrosis[J].Rev Physiol Biochem Pharmacol, 2018,175(1):71-102.
[20]Liang Y,Liu H,Fang Y,
.Salvianolate ameliorates oxidative stress and podocyte injury through modulation of NOX4 activity in db/db mice[J].J Cell Mol Med,2020,17(5):324-335.
[21]Chen Y,Zhao C,Liu X,
.Plumbagin ameliorates liver fibrosis via a ROS-mediated NF-кB signaling pathway in vitro and in vivo[J].Biomed Pharmacother, 2019,116(4):108-119.
[22]Li R,Li J,Huang Y,
.Polydatin attenuates diet-induced nonalcoholic steatohepatitis and fibrosis in mice[J].Int J Biol Sci,2018,14(11):1411-1425.
[23]Tseng YJ,Dong L,Liu YF,
.Role of Autophagy in Chronic Liver Inflammation and Fibrosis[J].Curr Protein Pept Sci, 2019,20(8):817-822.
[24]Chen W,Zhang Z,Yao Z,
.Activation of autophagy is required for Oroxylin A to alleviate carbon tetrachloride-induced liver fibrosis and hepatic stellate cell activation[J].Int Immunopharmacol,2018,56(1):148-155.
[25]Liu X,Mi X,Wang Z,
.Ginsenoside Rg3 promotes regression from hepatic fibrosis through reducing inflammation-mediated autophagy signaling pathway[J].Cell Death Dis, 2020,11(6):454-466.
[26]Ye HL,Zhang JW,Chen XZ,
.Ursodeoxycholic acid alleviates experimental liver fibrosis involving inhibition of autophagy[J].Life Sci,2020,242(2):117-127.
