超声定量分析技术预测食管胃底静脉曲张出血危险度的应用
刘 伟, 王 贺, 初晓燕, 徐丽丽, 王爱民*
1. 承德市中心医院消化内科, 河北 承德 067000; 2. 承德市中心医院普外科, 河北 承德 067000
统计数据[1]显示,50%左右门静脉高压患者可发生食管胃底静脉曲张(EGV),常引发大呕血、便血,威胁患者生命安全,因此早期预测EGV患者出血危险度对临床后续治疗意义重大。尽管药物和内镜治疗EGV出血可取得良好效果,但仍无法替代外科手术的治疗作用,尤其是不宜行内镜治疗或出血停止后24 h内再次出血的患者[2]。而外科手术前了解肝脏和门静脉系统解剖学、血流动力学状况对手术方式的选择具有重要的指导意义[3]。超声是评估EGV的一种常用影像学手段,具有无创、实时、可重复等优点,可观察脾静脉、门静脉主干内径、肝脏和脾脏硬度、血流动力学特点等,但用于EGV出血危险度的预测及指导外科手术的价值尚待深入探讨[4]。基于此,本研究尝试探讨超声定量分析技术预测EGV出血危险度对外科手术的指导作用。
1 资料与方法
1.1 一般资料
选取2019年1月至2021年5月我院收治的127例肝硬化门静脉高压患者进行前瞻性队列研究,本研究经医院伦理委员会审核通过。患者均根据病情给予非选择性β-受体阻滞剂降低肝静脉压力梯度,以预防出血。随访3个月,失访2例,获访125例患者根据是否发生EGV出血分为发生组(60例)、未发生组(65例)。发生EGV出血患者酌情给予生长抑素、血管加压素、三腔二囊管压迫止血、内镜治疗等对照处理。发生组女31例,男29例,年龄45~76岁,平均年龄(61.84±6.59)岁;未发生组女30例,男35例,年龄48~77岁,平均年龄(62.55±7.13)岁。两组性别、年龄、病程、体质量指数(BMI)等资料均衡可比(P>0.05)。纳入标准:均为肝硬化门静脉高压患者;入组前2周无相关药物应用史;患者知情并签署同意书。排除标准:检测部位皮肤溃烂,无法完成检测者;既往有上消化道出血史及相关治疗史者。
1.2 方法
1.2.1EGV严重程度与Child肝功能分级评估[1]
EGV严重程度:根据入院时胃镜检查下血管形态进行评估,0级:胃镜静脉曲张;1级:小、直线形曲张;2级:屈曲、稍大状静脉,<1/3管腔隆起;3级:大、盘曲状静脉,>1/3管腔的隆起,分级越高,病情越严重。Child肝功能分级:包括肝性脑病、腹水、血清胆红素、血清白蛋白、凝血酶原时间延长项目,分别依据异常程度取1分、2分、3分,总分5~6分为A级,7~9分为B级,10~15分为C级。
1.2.2超声检查
采用彩色多普勒超声诊断仪(s2000型,西门子),探头频率3~12 MHz,经脾肋间斜切面显示脾长径,经脾肋间斜切面显示脾厚径,脾脏指数(SI)=脾长径与脾厚径之积;脾肋间横切面显示门静脉内径(PV);并采用实时剪切波弹性成像模式,检测肝脏剪切波速度(LSWV)、脾脏剪切波速度值(SSWV)。检测SSWV时,患者仰卧位,左臂上抬至头部,检测区域为腹部左上象限的脾脏;检测LSWV时,取仰卧位,右臂上抬至头部,充分暴露肋间隙,检测区域为右侧第9~10肋间的肝右叶部位,在脾脏、肝脏包膜下3.0~5.5 cm位置选择脾、肝实质,避开大血管,感兴趣区大小为10 mm×5 mm,嘱患者屏气,发射剪切波获取相应截断值,连续测量10次,取平均值。
1.3 统计学方法
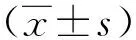
2 结果
2.1 发生组与未发生组的EGV严重程度、Child肝功能分级比较
两组EGV严重程度、Child肝功能分级比较,差异有统计学意义(P<0.05)。见表1。

表1 两组EGV严重程度、Child肝功能分级比较[n(%)]
2.2 两组超声定量分析比较
发生组LSWV、PV、SSWV、SI显著高于未发生组(P<0.05)。见表2。

表2 两组超声定量分析比较
2.3 超声定量参数与EGV严重程度、Child肝功能分级关系
相关性分析显示,LSWV、PV、SSWV、SI与EGV严重程度、Child肝功能分级呈正相关(P<0.05)。见表3。

表3 超声定量参数与EGV严重程度、Child肝功能分级关系
2.4 Logistic预测模型建立与联合预测因子的生成
因超声定量参数与EGV严重程度、Child肝功能分级相关,为避免多重共线性问题,将EGV严重程度、Child肝功能分级手动移除。以是否发生出血为二分类结局变量,以LSWV(X1)、PV(X2)、SSWV(X3)、SI(X4)作为协变量,得出联合预测因子表达式为:Logit(P)=-3.757+2.003×X1+1.989×X2+1.473×X3+1.981×X4。见表4。

表4 多参数作为协变量代入Logistic回归方程预测出血危险度的结果
2.5 联合预测因子及各原始协变量预测EGV出血危险度的ROC
LSWV、PV、SSWV、SI联合预测因子预测EGV出血危险度的曲线下面积(AUC)大于各原始协变量,联合预测的AUC为0.873,敏感度为78.33%,特异度为81.54%。见表5。

表5 联合预测因子及各原始协变量预测EGV出血危险度的ROC分析结果
2.6 个体值预测
对联合预测因子模型进行变形得到P=1/[1+e-(-3.757+2.003×X1+1.989×X2+1.473×X3+1.981×X4)],即个体预测概率方程,随机代入1名患者数据,X1=1,X2=0,X3=1,X4=1,计算可知P=0.154,大于联合预测因子的最佳临界值13.57,表明在准确率为80.00%的条件下,该患者会发生出血,临床可密切观察,及早给予对症干预。
3 讨论
EGV出血系门静脉高压的一种严重并发症,起病迅猛,病死率高,虽然内镜检查能了解EGV状态,但为侵入性检查,且难以定量预测EGV出血危险度,临床应用受限[5]。断流术、分流术等是治疗EGV出血的手术方式,但术前需掌握患者肝硬化程度、门静脉、脾静脉直径、侧支血管部位和范围等信息,所以术前进行影像学检查是必要的[6]。
本研究采用超声定量分析技术分析显示,与未发生出血患者比较,发生出血EGV患者PV、SI较高,提示PV、SI与EGV出血有关。门静脉高压患者门静脉压力较大,造成PV变宽,脾脏肿大,SI增高[7,8]。PV越宽,门静脉血流量越大,血流速度越慢,阻力越高,EGV破裂出血风险越高;SI越高,脾脏肿大越明显,可能因脾功能亢进引起血小板较少而出血,或脾脏边缘至肋弓以外,失去肋骨保护作用,易受到外力撞击而破裂出血[9,10]。EGV严重程度、Child肝功能分级是现阶段评估出血风险与选取治疗方式的重要依据[11]。本研究发现,PV、SI与EGV严重程度、Child肝功能分级呈正相关,表明PV、SI可作为预测EGV出血风险与选取治疗方式的指导性标志物。一方面若患者PV、SI较高时,提示出血危险度较高,应加强病情监测与预防;另一方面,结合笔者长期临床工作经验,通过PV增大情况,结合血流速度,可评估门静脉血流灌注情况,若门静脉血流量灌注减少量很少,采用部分门体分流术倾向较高,若PV增大不明显,门静脉血流灌注减少量中等以下,则提示选择性分流术或断流术概率较高,若门静脉血流灌注明显减少,即脾静脉成为流出道,则提示全门体分流术,因此超声定量分析PV、SI预测EGV出血危险度可对外科手术起到指导作用。
肝脏与脾脏硬度可用于判断EGV病情程度,无EGV、轻度EGV、中重度EGV患者彩色弹性图分别显示为蓝色、亮蓝色、红黄色,从而能直观评估EGV严重程度[12,13]。由于瞬时弹性成像测量肝脏、脾脏硬度结果易受体质量指数等因素影响,因此本研究采用实时剪切波弹性成像模式检测,结果显示,发生组LSWV、SSWV高于未发生组,并与EGV严重程度、Child肝功能分级呈正相关,有助于预测EGV出血风险。徐成川等[14]研究发现,脾脏硬度与静脉曲张程度呈正相关,本研究结论与之相似。Wang等[15]报道,不同EGV病情程度患者脾脏硬度不同,随着病情加重,脾脏硬度逐渐增加,检测脾脏硬度可以预测肝硬化患者食管静脉曲张和出血危险度。Stefanescu等[16]采用实时剪切波弹性成像模式对肝硬化EVG高出血风险患者脾脏进行检测发现,脾脏硬度与静脉压力有关,可作为预测EGV出血风险的一个参数,本研究观点与上述报道一致。同时在以上研究基础上,本研究以LSWV(X1)、PV(X2)、SSWV(X3)、SI(X4)作为协变量,得出联合预测因子,其预测EGV出血危险度的AUC大于各原始协变量,曲线下面积为0.873,呈现出较高的预测价值,能较准确地评估患者出血危险度,从而为外科手术提供参考。
综上所述,超声定量分析技术检测LSWV、PV、SSWV、SI,可作为预测EGV出血危险度的一个方案,对临床预防性干预及外科手术方式起到一定指导作用。

