KSZ620/43B型隧道烘箱在血液制品生产工艺中的应用
巩喜军,赵崎光,陆 麒,魏学荣,吴爱景,才 辉,杨灵通,成 魁,刘晓宇
(兰州兰生血液制品有限公司,兰州 730046)
0 引言
血液制品特指人血浆蛋白类制品,其生产包括从原料血浆接收、入库贮存、复检、血浆分离、血液制品制备、检定到成品入库的全过程[1]。血液制品属于无菌药品,其生产所用的物料、器具均需要经过灭菌处理。血液制品在配制、灌装等暴露生产时应当最大限度降低微生物、各种微粒和热原的污染。设备设施的验证、生产工艺系统的无菌是确保血液制品最终无菌的关键因素。
KSZ620/43B型隧道烘箱是一台自动化除菌除热原设备,是采用层流原理和热空气高速消毒工艺,使容器在洁净度为A级的密封隧道内完成干燥、灭菌、去热原和冷却的无菌生产工艺流程。其整个输送隧道是一个密闭的整体组合件,按结构可分为三部分,第一部分为预热段,第二部分为加热段,第三部分为冷却段[2]。该设备位于灌封机前部、洗瓶机后部,可与洗瓶机、灌封机组成一条完整的洗、烘、灌、封自动生产线。与其他隧道烘箱相比,该设备应用了风机微压差检测、风门自动升降、水冷等新技术,在干热效果的实现中,不会引入其他杂质[3],且实现了自动控温、稳压,实施条件稳定、易控,便于生产操作和维修保养,有效提高了灭菌效率。《药品生产质量管理规范(2010年修订)》规定“企业的厂房、设施、设备和检验仪器应当经过确认”,因此本文采用KSZ620/43B型隧道烘箱对中硼硅玻璃输液瓶的除菌除热原进行确认和试运行试验[4],以确保该设备符合无菌制剂生产工艺要求。
1 材料和方法
1.1 材料
KSZ620/43B型隧道烘箱购自楚天科技股份有限公司,外形尺寸为3 680 mm×1 700 mm×2 350 mm(长×宽×高),总质量4 200 kg,腔室内为A级环境,隧道宽600 mm,传送带最大传输速度160 mm/min,正常传输速度110 mm/min;预热段长580 mm,温度<100℃;灭菌段长1 320 mm,温度为(320±5)℃;冷却段1长780 mm,温度为60~120℃,冷却段2长1 000 mm,温度<25℃。2635A型多通道数据采集器购自美国福禄克公司[5]。中硼硅玻璃输液瓶(规格50 mL)购自山东药用玻璃股份有限公司。内毒素指示剂(效价1 250 EU/支)购自湛江安度斯生物有限公司。
1.2 方法
1.2.1 设计确认(design qualification,DQ)
DQ需确认KSZ620/43B型隧道烘箱的设计是否符合预定用途和《药品生产质量管理规范(2010年修订)》要求,功能要求(生产能力、电容量、微粒测试、空载热分布、热穿透、内毒素减少等)设计是否符合用户需求说明(user requirment specification,URS);检查DQ方案是否已被审核、批准;确认外形图、管道和仪表控制流程图、材料清单、电气原理图、功能说明、硬件设计说明和软件设计说明等文件是否已完成。
1.2.2 安装确认(installation qualification,IQ)
IQ是证明设备的建造和安装是否符合设计标准,确认设备安装是否符合规定,是否能满足生产的需要。检查设备的资料(设计图纸、使用说明书、技术图纸、材质证明书、电气原理及接线图、材料清单、合格证等)是否齐全并存档;确认安装是否符合设备要求,使其正常运行;检查并确认仪器仪表的校验情况;确认设备的维护计划,检查制造材料和产品接触表面的材质证明,检查水电气管路连接是否正确;对设备供应商提供的配件进行检查并记录。
1.2.3 运行确认(operational qualification,OQ)
OQ前需检查IQ是否完成,设备仪表是否校验,设备操作、清洁和维护标准操作规程(standard operation procedure,SOP)是否起草完成,操作培训是否完成。OQ主要确认安全设备、报警装置、联锁装置是否正常工作;进行设备基本操作的确认[6],在空载情况下按照使用说明书进行开机启动,确认各段温度和压差、高效过滤器的完整性、腔室内尘埃粒子是否符合要求,报警信号是否正常,运转是否平稳、无异常噪声和振动,电器的绝缘和耐压是否符合GB 5226—2008规定。
1.2.4 性能确认(performance qualification,PQ)
PQ前应确认IQ和OQ是否完成,如有偏差是否得到解决,检查仪器仪表是否都校验。按照工艺过程和质控要求,PQ分别从热分布、热穿透和细菌内毒素挑战3个方面对中硼硅玻璃输液瓶干热灭菌效果进行验证[7],确认设备是否满足生产工艺要求。
1.2.4 .1热分布试验
设定灭菌温度为320℃,网带运行速度为110 mm/min,按隧道烘箱操作程序运行设备,当温度升至设定灭菌温度后以隧道烘箱输送网带为边界,将10个温度测试探头(以下简称“探头”)依次均匀放置在网带同一截面上,探头随网带移动进入、移出烘箱灭菌段、冷却段,用检测仪直接测试各探头的温度,连续检测3次。合格标准:灭菌过程中各探头温差小于5℃。
1.2.4 .2热穿透试验
热穿透试验时隧道烘箱保持满载运行,将已清洗的中硼硅玻璃输液瓶瓶口朝上,将探头插入并用耐高温胶布固定在输液瓶内。设置自动温度记录仪每30 s记录一次温度值,设定灭菌温度为320℃,网带运行速度为110 mm/min,按隧道烘箱操作程序运行设备,当温度升至设定灭菌温度后,以隧道烘箱输送网带为边界,将10个探头依次均匀放置在网带同一截面上,探头随网带移动进入、移出烘箱灭菌段、冷却段,用检测仪直接测试各探头的温度,连续检测3次。合格标准:每个探头的灭菌FH值(干热灭菌的杀菌热力强度)>1 365[8]。
1.2.4 .3内毒素挑战试验
干热法能够实现灭菌、除热原的双重效果。在隧道烘箱灭菌、除热原的效果评价中,内毒素的衰减是重要的评价方式,其效果直接与环境温度有关,一般采用≥300℃的温度[9]。
在进行隧道烘箱满载热穿透试验的同时,做细菌内毒素挑战试验。根据指示剂应放在装载物内的数个地方(包括除菌、除热原效果最差的点位)的原则,在输液瓶内放入1 250 EU的验证用标准细菌内毒素,将装好标准细菌内毒素的输液瓶与插入温度探头的中硼硅玻璃输液瓶放在一起,并对灭菌后的各内毒素指示剂进行检验,同时做阳性对照。合格标准:经干燥灭菌后,用灵敏度为0.125 EU/mL的鲎试剂进行测定,阳性对照应为阳性,样品检验应为阴性,即内毒素下降3个对数单位以上[10]。
1.2.5 试运行试验
按照《无菌工艺模拟试验指南(无菌制剂)》对KSZ620/43B型隧道烘箱连续进行3批培养基模拟灌装试验,并对合格瓶数、污染瓶数进行统计,判定对中硼硅玻璃输液瓶的干热灭菌效果是否符合《药品生产质量管理规范(2010年修订)》的要求。
1.2.6 不同生产规模下设备运行情况
利用KSZ620/43B型隧道烘箱分别生产500、1 000、2 000瓶血液制品,通过无菌药品的无菌和热原检查是否合格考察KSZ620/43B型隧道烘箱对中硼硅玻璃输液瓶的干热灭菌情况[11]。
2 结果
2.1 DQ结果
KSZ620/43B型隧道烘箱功能要求(生产能力、电容量、微粒测试、空载热分布、热穿透、内毒素减少)设计符合URS,DQ方案已被审核、批准;外形图、管道和仪表控制流程图、材料清单、电气原理图、功能说明、硬件设计说明和软件设计说明等文件已完成。
2.2 IQ结果
所有执行确认的人员均已得到培训;设备的设计图纸、电气原理及接线图、材料清单等全部齐全,设备已按照设计图纸安装就位,安装稳固,线路连接完好,外观完整无缺损,仪器仪表校验、维护计划、润滑等均已完成。
2.3 OQ结果
IQ、设备操作、清洁和维护SOP的起草、操作培训已完成。设备报警装置、联锁装置正常工作,空载各段温度、压差、高效过滤器的完整性符合要求,腔室内符合A级洁净室要求,运转平稳无异常,且电器的绝缘和耐压符合GB 5226—2008规定。
2.4 PQ结果
确认IQ和OQ已完成,无偏差,仪器仪表已校验。稳定产能20瓶/min(50 mL/瓶),出瓶温度≤25℃。热分布试验腔体内各探头最大温差小于5℃(见表1~3);热穿透试验各探头温度FH值均>1 365(见表4~6);内毒素挑战试验所有内毒素检验结果均为阴性,阳性对照检验结果为阳性(见表7)。综上表明PQ均符合要求。
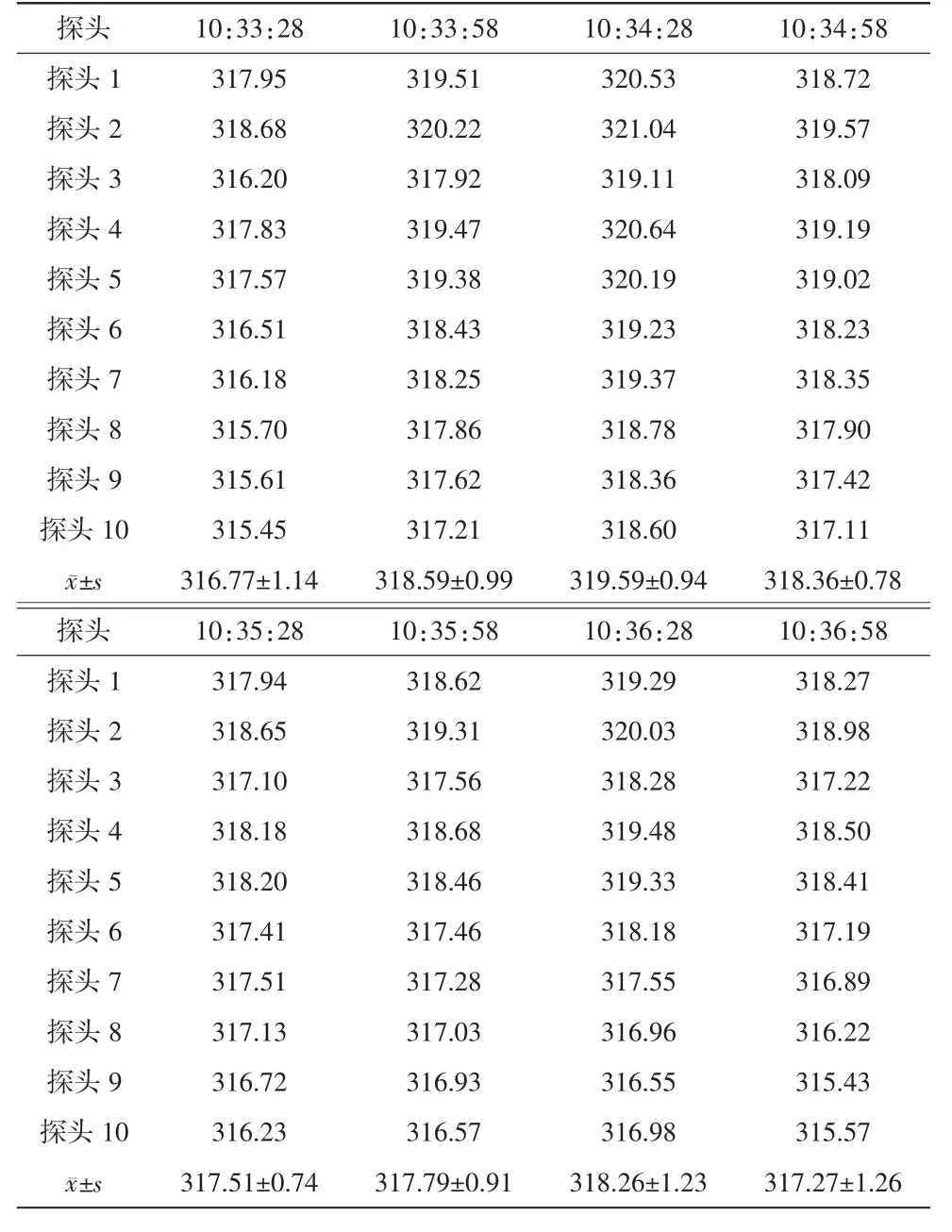
表1 第1次热分布试验结果单位:℃
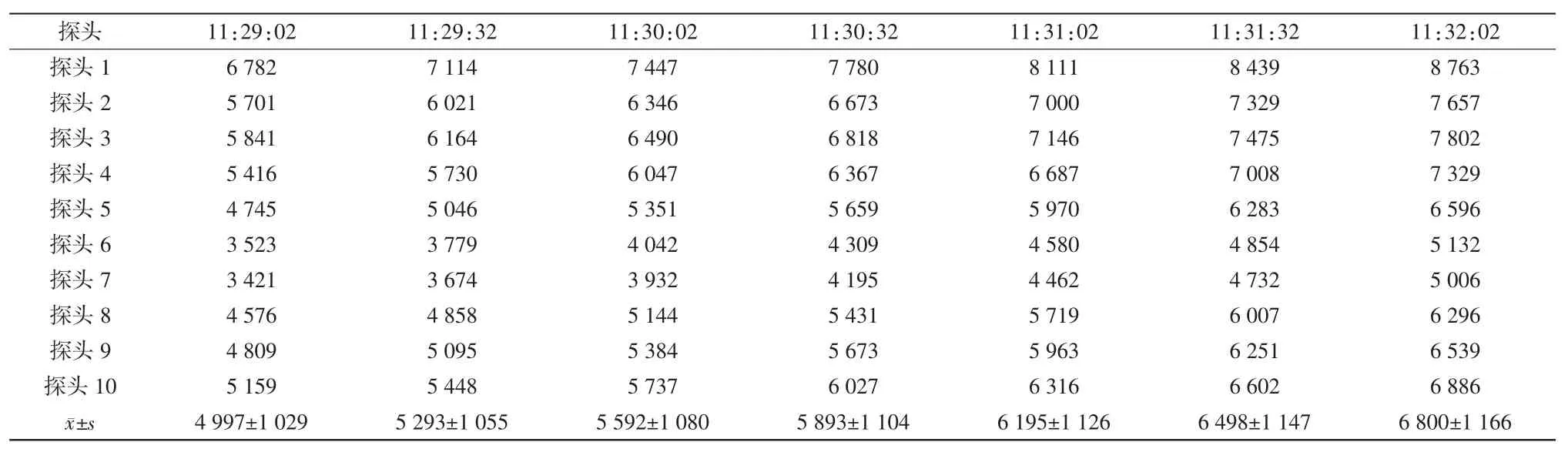
表4 第1次热穿透试验FH值
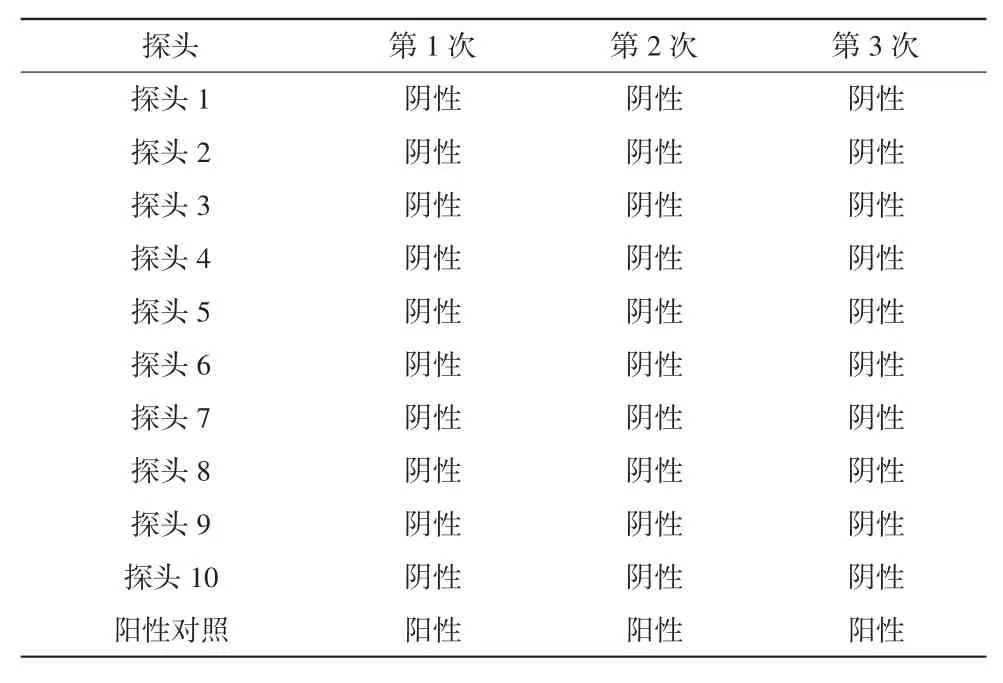
表7 内毒素挑战试验结果
2.5 试运行试验结果
按照《无菌工艺模拟试验指南(无菌制剂)》连续进行的3批培养基模拟灌装试验合格率为100%,试验零污染(见表8),判定KSZ620/43B型隧道烘箱对中硼硅玻璃输液瓶的干热灭菌效果符合《药品生产质量管理规范(2010年修订)》的要求。
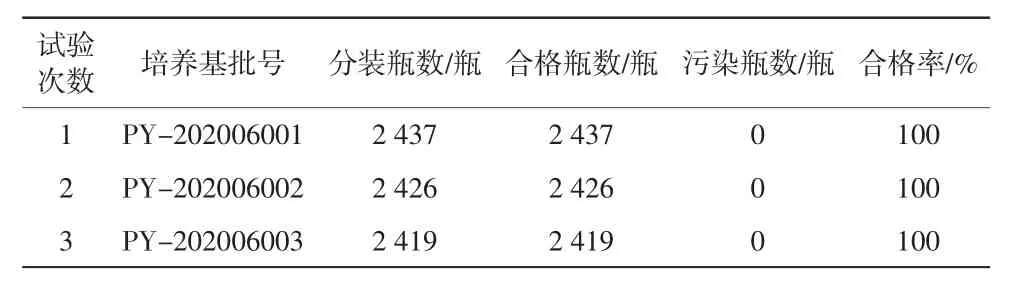
表8 试运行试验结果
2.6 不同生产规模下设备运行结果
分别生产500、1 000、2 000瓶3种规模的血液制品,无菌检查和热原检查结果显示合格率为100%(见表9),判定KSZ620/43B型隧道烘箱对中硼硅玻璃输液瓶的干热灭菌效果符合《药品生产质量管理规范(2010年修订)》的要求。

表9 不同生产规模下设备运行效果
3 结语
血液制品为静脉注射用无菌药品,在生产时应当最大限度降低微生物、各种微粒和热原的污染。而血液制品的容器中硼硅玻璃输液瓶广泛采用干热法实现除菌、除热原。本文按照《药品生产质量管理规范(2010年修订)》的要求,对KSZ620/43B型隧道烘箱进行了确认及试运行工作,确认了KSZ620/43B型隧道烘箱的设计、安装和性能均符合药品生产及工艺的要求,且对中硼硅玻璃输液瓶的干热灭菌效果符合《药品生产质量管理规范(2010年修订)》的要求,能够用于血液制品内包材中硼硅玻璃输液瓶的除菌、除热原。

表2 第2次热分布试验结果单位:℃
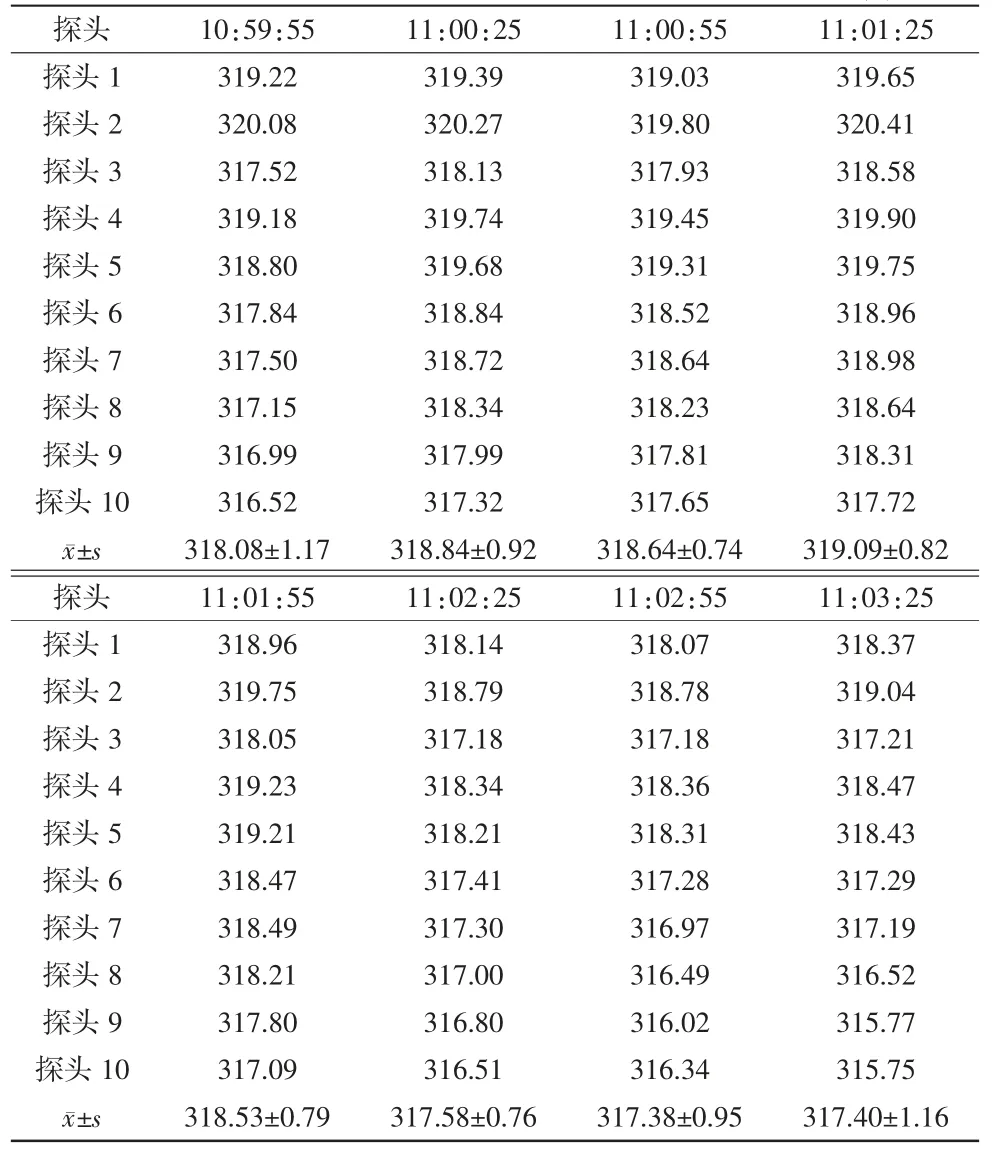
表3 第3次热分布试验结果单位:℃
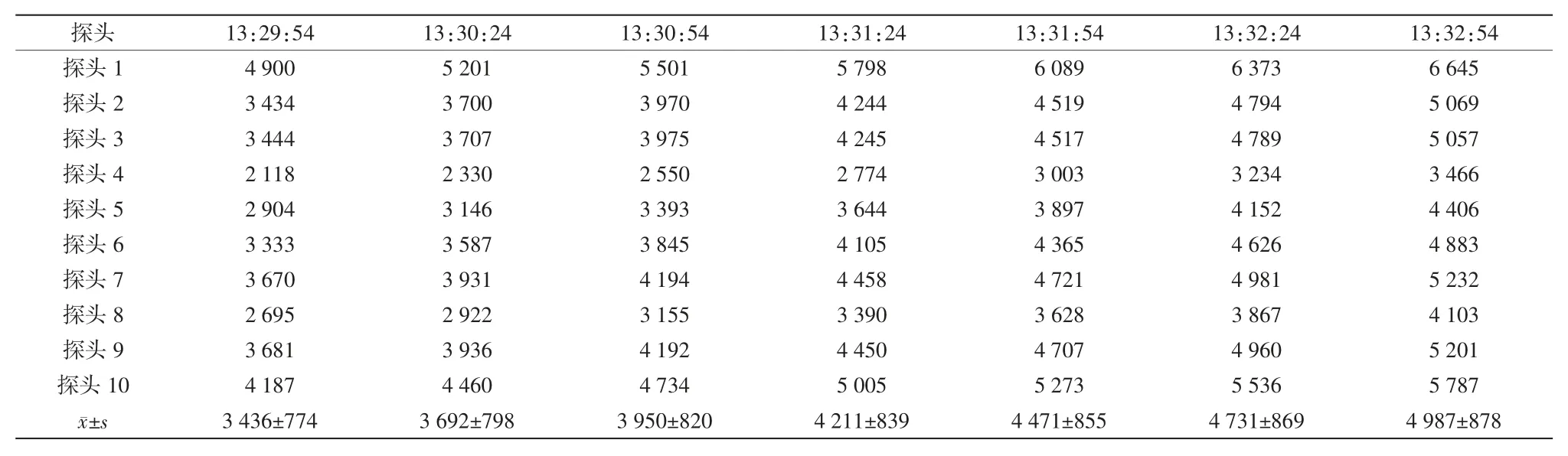
表5 第2次热穿透试验FH值
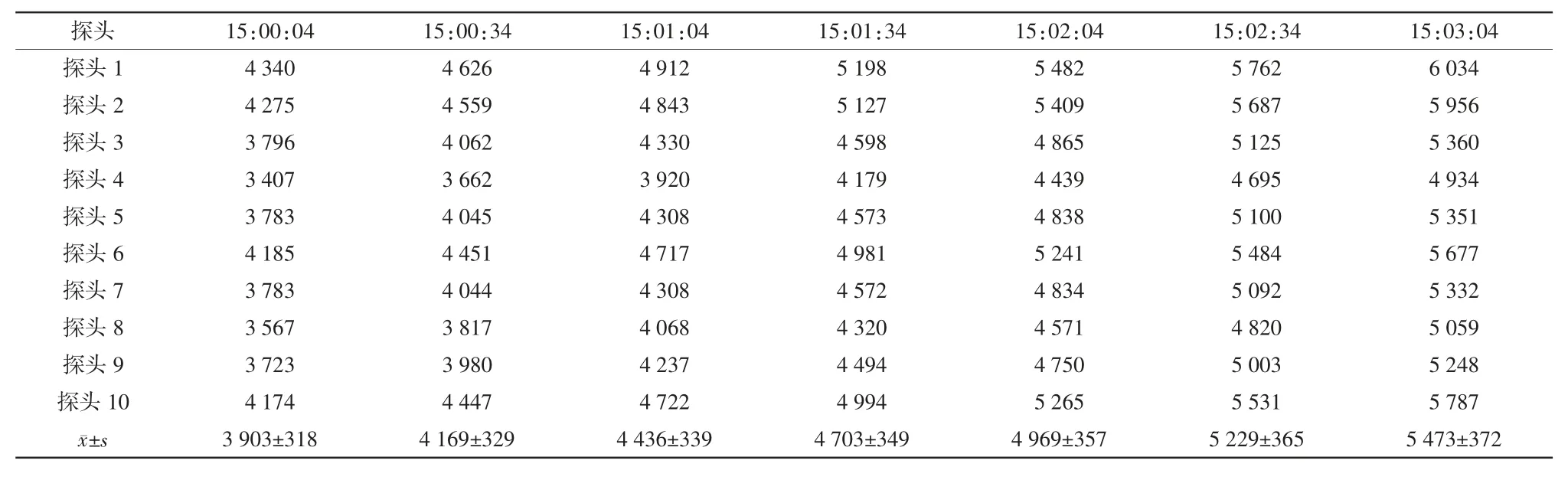
表6 第3次热穿透试验FH值

