碘化油化疗药物乳剂联合D-TACE对比cTACE治疗肝细胞癌的临床价值
王玉峰,曾 嘉,何东风
中国《原发性肝癌诊疗规范(2021年版)》将经导管肝动脉化疗栓塞术(TACE)推荐为治疗中期肝细胞癌(HCC)的一线治疗,且TACE的应用覆盖了从Ⅰb到Ⅲb期肝癌。肿瘤体积较大的HCC患者,肿瘤组织往往有多支动脉参与供血,供血动脉迂曲、增粗,并且存在血管侵犯、动静脉瘘现象,单用载药微球(DEB)治疗,往往需要不止一瓶DEB才能达到栓塞终点[1-2];若单用碘化油治疗,用量同样很大,过量应用碘化油会产生威胁生命的严重不良事件。超液态碘化油具有亲肿瘤性,可通过肿瘤内部微血管或胆管周围血管丛进入肝窦及肿瘤周围门静脉微分支,阻断其对边缘区域肿瘤供血,但是肿瘤门区域供血动脉管径粗大,血流速度快,其根部存在较多细小动脉交织供血,常规剂量碘化油不易栓塞这些细支,而直接栓塞肝动脉主干,极易形成侧支循环。且碘化油直径较小,易被血流冲刷而沉积不良。此时追加DEB,能有效减少血流对碘化油的冲刷,机械性闭塞肿瘤门区血供,同时持续缓慢释放化疗药物。两者联合使用可明显减少单独使用的剂量,增加肿瘤缺血性坏死的强度和持续时间,并以可控和持续的方式向肿瘤释放化疗药物[3]。有研究指出,常规TACE(cTACE)应用于大肝癌或巨大肝癌的作用非常有限,客观缓解率(ORR)为16%~29%,OS为6.5~9.1个月。而D-TACE治疗大肝癌或巨大肝癌,可以达到更佳的生存获益,CalliSpheres载药微球TACE治疗大肝癌,mOS为11.5~16.0个月,mPFS为6.6~7.5个月,表现出了良好的疗效和耐受性[4-9]。本研究比较碘化油化疗药物乳剂联合Callispheres载药微球TACE与cTACE在HCC患者治疗中的短期疗效、不良反应等。
1 材料与方法
1.1 患者分组
纳入2017年3月至2019年1月就诊于哈尔滨医科大学附属肿瘤医院的HCC患者146例,57例患者作为实验组,采用碘化油化疗药物乳剂联合D-TACE+cTACE治疗,89例患者作为对照组,采用cTACE治疗。
1.2 纳入及排除标准
纳入标准:①影像学和(或)病理学确诊的HCC;②年龄为18~75岁;③Child-Pugh为A级;④医疗记录保存完整并可供查阅。排除标准:①合并其他部位的原发性恶性肿瘤;②不稳定的系统性疾病或未控制的感染;③妊娠或哺乳的患者;④慢性肾功能衰竭;⑤Child-Pugh为C级;⑥患有严重的心血管疾病;⑦严重的凝血功能障碍;⑧肝性脑病,顽固性腹水。
1.3 手术过程
所有患者入院后完善血常规、凝血功能、生化系列、发光四项、尿常规、肿瘤标志物(AFP、CEA、CA199)、常规心电图、影像学等检查,影像学包括上腹部增强CT或MRI,根据需要行PET-CT。
患者仰卧于介入手术台,术区常规消毒、铺巾,于右侧腹股沟韧带下方1 cm处股动脉两侧以2%利多卡因局部浸润麻醉。采用Seldinger穿刺针穿刺右侧股动脉成功后,引入5 F导管鞘,经导管注入肝素钠盐水溶液20 mL。引入导丝以及4 F肝动脉导管,将导管插入到主动脉弓处,恢复导管形状,经导管缓慢注入地塞米松磷酸钠10 mg。将导管分别选入膈动脉、肝总动脉、肠系膜上动脉进行造影,以评估肿瘤的血供情况。见到肿瘤灶染色,将微导管分别选入肿瘤供血血管,对照组以超液化碘油、洛铂、雷替曲塞混合成乳剂,栓塞肝内病灶,然后以明胶海绵颗粒栓塞至肿瘤血管血流中断;实验组以超液化碘油、洛铂、雷替曲塞混合成乳剂,栓塞肝内病灶,然后以100~300μm CalliSpheres载药微球加载注射用吡柔比星,加载成功后注射速度为1 mL/min栓塞肝内病灶至肿瘤供血动脉血流完全停滞。当血流减慢,门静脉小分支显影或等待2~5个心动周期对比剂不排空,栓塞停止。撤出导管及导管鞘,局部压迫10 min,切口处无渗血,无皮下血肿,局部包扎压迫,返回病房。行常规保肝,抗感染,对症治疗。
1.4 随访及疗效评估
于TACE术前,术后3 d检查肝功能指标包括丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBil)、白蛋白(Alb)。记录治疗后的不良反应,包括肝脓肿、发热、疼痛和恶心呕吐。所有患者均接受住院和电话随访,中位随访时间为24.6个月。术后4~6周结合肝脏增强CT、MRI按照改良实体瘤疗效评价标准(mRECIST)评估病灶情况:完全缓解(CR)、部分缓解(PR)、疾病进展(PD)、疾病稳定(SD);ORR为CR+PR,疾病控制率(DCR)为CR+PR+SD。随访截止时间2021年6月,治疗期间实验组与对照组皆按需进行补充cTACE治疗。主要评价指标包括3个月的ORR以及DCR,次要评价指标包括术后不良反应状况、半年内需要治疗的次数、首次治疗与后续补充TACE的治疗间隔、患者首次治疗的住院时间。
1.5 统计学分析
使用SPSS22.0软件进行处理和分析。计数资料以例数(%)表示,组间比较采用卡方检验;正态分布的连续变量以±s表示,两组比较采用t检验;非正态分布的连续数据以M(P25,P75)表示,两组比较采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的基线特征
实验组与对照组患者的基线特征比较见表1,两组患者各项指标比较差异均无统计学意义(均P>0.05)。由于本研究纳入的患者包含了CNLCⅠa~Ⅲb各个分期,实验组有10例,对照组有19例患者联合了其他治疗,联合方式为“TACE+X”的二联方式,两组联合治疗的患者占比差异无统计学意义(P>0.05)。

表1 实验组与对照组患者的基线特征比较
2.2 两组患者介入治疗前实验室指标对比
介入治疗前实验组与对照组患者实验室指标比较差异均无统计学意义(均P>0.05),见表2。

表2 介入治疗前实验组与对照组患者实验室指标比较
2.3 近期疗效比较
治疗后3个月,实验组与对照组患者的CR、PR、SD、ORR比较差异均无统计学意义(均P>0.05),而实验组的DCR高于对照组,差异有统计学意义(P=0.034),见表3。
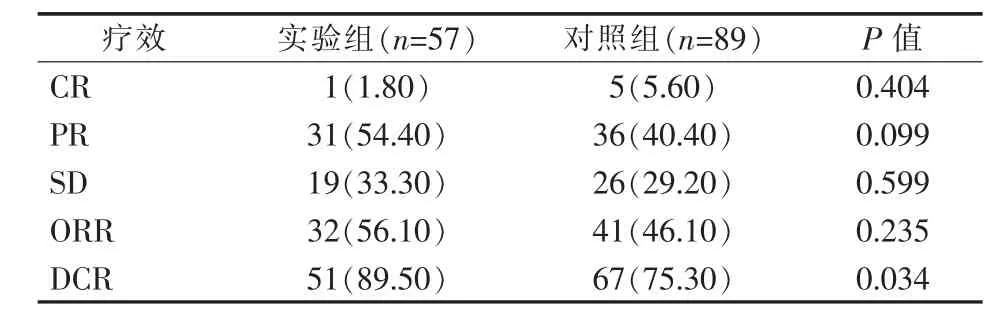
表3 治疗后3个月实验组与对照组疗效比较 [例(%)]
2.4 术后不良反应
术后不良反应发生情况,呕吐实验组有54例(94.7%),对照组有87例(97.8%);发生肝脓肿实验组有4例(7.0%),对照组有1例(1.1%);炎症反应实验组有8例(14.0%),对照组有6(6.7%);发热实验组有14(24.6%),对照组有17(19.1%),组间比较差异均无统计学意义(均P>0.05);疼痛实验组有36例(63.2%),对照组28例(31.5%),差异有统计学意义(P<0.01)。
2.5 两组患者介入治疗后实验室指标对比
治疗后实验组患者Alb低于对照组,且差异有统计学意义(P<0.01),其他指标比较差异均无统计学意义(均P>0.05),见表4。

表4 介入治疗后实验组与对照组患者实验室指标比较
2.6 住院及治疗间隔时间
实验组与对照组首次治疗的住院时间分别为(6.818±3.632)d和(7.380±3.095)d,差异无统计学意义(P=0.164);6个月内按需治疗的总次数为(2.440±1.095)次和(2.312±0.878)次,差异无统计学意义(P=0.879);首次TACE与补充TACE的时间间隔为57.0(49.0,90.0)d和55.0(49.0,64.2)d,差异有统计学意义(P=0.045)。
3 讨论
早期HCC血运不够丰富,因此并不建议在早期阶段将TACE作为首选治疗方案[10]。TACE是中晚期肝癌的一线治疗,D-TACE将载药微球和加载的化疗药注入肿瘤的供血动脉,微球以持续的方式缓慢释放加载的化疗药物,使肿瘤内药物浓度增加,而正常肝组织及全身药物浓度相对较低。
文献报道,D-TACE与cTACE比较,1年、2年生存率,PFS、OS、ORR、DCR等方面不存在明显差异,但D-TACE在改善HCC短期疗效、术后不良反应以及患者的耐受性等方面优于cTACE[11-13]。本研究中,实验组与对照组患者3个月的ORR比较,差异无统计学意义,但实验组患者3个月的DCR高于对照组。本研究中化疗药物种类、剂量、碘化油用量两组一致,所不同的是补充栓塞剂,实验组使用的DEB是永久型栓塞材料,闭塞肿瘤供血动脉的能力要强于可吸收型明胶海绵,不会在短期被代谢吸收,并且微球具有较好的载药量和稳定性,与cTACE中使用的碘油相比,药物集中释放在靶肿瘤上,更有效的杀灭癌细胞并诱导肿瘤坏死,这可能是实验组3个月DCR高于对照组的原因。实验组较对照组术后不良反应稍强,但大多是一过性的,对症处理后均可改善。术后疼痛cTACE组比D-TACE组严重,可能是载药微球的型号以及术者进行超选血管水平存在差异导致。
碘化油化疗药物乳剂为液态,更容易栓塞肿瘤的末梢血管,达到肿瘤血管的末梢栓塞,卫星灶也可以达到栓塞的目的。足量碘化油亦可以进入门静脉达到双重栓塞的作用。对于直径>5 cm的病灶,cTACE术后疗效一般,cTACE碘化油化疗药物乳剂栓塞后应用明胶海绵颗粒栓塞,明胶海绵粒径较大,形状不规则,很容易被血流冲刷,而且为可吸收材料。而载药微球为规则的球体,比明胶海绵粒径小,栓塞肿瘤血管更加致密,血管内膜损伤小,而且是永久栓塞材料不会被吸收[14]。研究表明,CalliSpheres载药微球联合碘化油TACE治疗大肝癌的短期疗效以及安全性较好[15-17]。但长期疗效仍需要更多前瞻性多中心、大样本的进一步研究。
有研究显示,cTACE与D-TACE在OS方面没有差别,但D-TACE的次数少于cTACE[18-21]。本研究中实验组首次TACE与补充TACE的时间间隔长于对照组。
本研究是单中心回顾性研究,样本量较少,纳入的患者大多是我国东北地区HCC患者,存在一定的选择偏倚;在进行疗效评价时,未检测凝血酶原、血浆游离微小核糖核酸或血清甲胎蛋白异质体,缺乏一定的说服力;根据D-TACE的标准技术推荐,应根据肿瘤大小和供血条件选择适当粒径的微球[22],本研究选择100~300μm载药微球,未对其他直径的载药微球进行评估;此外仅评估了短期疗效。因此,需要未来大样本和多中心前瞻性随机对照实验进一步验证。

