2019-2020年夏季舟山海域浮游动物优势种生态位及其生态分化
宋晨,孟周,王晓波,韩庆喜*
( 1. 宁波大学 海洋学院,浙江 宁波 315832;2. 国家海洋局宁波海洋环境监测中心站,浙江 宁波 315012;3. 禹治环境科技(浙江)有限公司,浙江 宁波 315199)
1 引言
浮游动物是海洋中的次级生产者,其种类、分布和数量均可影响海域生产力,对渔业发展意义重大[1-2]。浮游动物的群落结构、生物量和优势种分布可以反映水域环境的变化,常作为水域环境的指示动物[3]。浮游动物因其随波逐流的特性而受到诸多因素的影响。例如,王慧君等[4]发现,不同水团会对浮游动物群落结构地理分布格局产生影响;何瑞等[5]指出,浮游植物可通过食物网影响浮游动物种类组成和分布;付显婷等[6]指出,水环境变化会对浮游动物群落结构分布起主导作用。生态位是指种群在生态系统中所占据的时空位置以及它与其他种群之间的相互影响[7-8]。生态位理论常用于生物多样性、种间关系、群落的结构和演替及种群进化等方面的研究[9-10],亦广泛运用于海洋生态系统,常用于研究海域内生物的种群特征、生存状况、利用各种资源的幅度及种对间的相互关系等[11]。
舟山海域位于浙江省北部,受长江和钱塘江两大河口及台湾暖流和沿岸寒流交汇的影响,水域环境复杂,水团交汇带来大量饵料,是我国舟山渔场的主要海区。然而,由于20世纪70年代以来无节制的捕捞等原因,使舟山渔场渔业资源减少,此外,人类活动愈加频繁,海域环境质量下降[12],使该海域浮游动物生物量呈下降趋势[13]。近年来,“绿水青山就是金山银山”的呼吁深入人心,合理有效地开发海洋资源及对环境的保护越来越得到重视。
目前对舟山海域浮游动物的研究主要集中在分布特征、群落结构等方面[1,4,13-14],而该海域浮游动物优势种生态位的研究鲜有报道。此外对浮游动物的研究主要针对季节变化[3,9-10],对年际变化鲜有报道。浮游动物生态位分布在一定程度上能反映出海洋生态环境的变化现状[9],因此研究浮游动物的生态位和年际变化具有重要意义。有鉴于此,根据2019年夏季和2020年夏季对舟山海域浮游动物的采样调查,分析了舟山海域浮游动物优势种组成及生态位的主要特征,并采用冗余分析(RDA)探究环境因子变化对浮游动物优势种生态位分化的影响,该研究将加深对舟山海域浮游动物群落的认识程度,有望进一步了解该海域浮游动物群落中不同种群的相互作用关系,为阐述浮游动物应对环境变化的适应机制等研究提供数据基础和科学依据。
2 材料与方法
2.1 样品采集与分析
根据舟山海域的海域特点和本次研究目的,共设置相同采样站位12个(图1),调查范围为舟山海域(29°~31°N,122°00′~123°30′E),Z1、Z3、Z5、Z6、
Z7、Z9、Z11站位分布在舟山近岸,Z2、Z4、Z8、Z10、Z12站位分布在舟山近海,租用渔船分别在2019年7月24-28日、8月14日和2020年7月26-31日及8月7日进行浮游动物和水质参数的调查采样。采用浅水Ⅱ型浮游动物网具(网口内径为31.6 cm,网长为140 cm,网口面积为0.08 m2),从底层至表层垂直拖网采集浮游动物样品。将样品用5%的福尔马林固定之后,带回实验室去除杂质,在显微镜(奥林巴斯,SZX16,日本)和解剖镜(奥林巴斯,SZ61,日本)下进行鉴定和统计。样品采集和分析按《海洋调查规范》(GB/T 12763.6-2007)[15]进行。
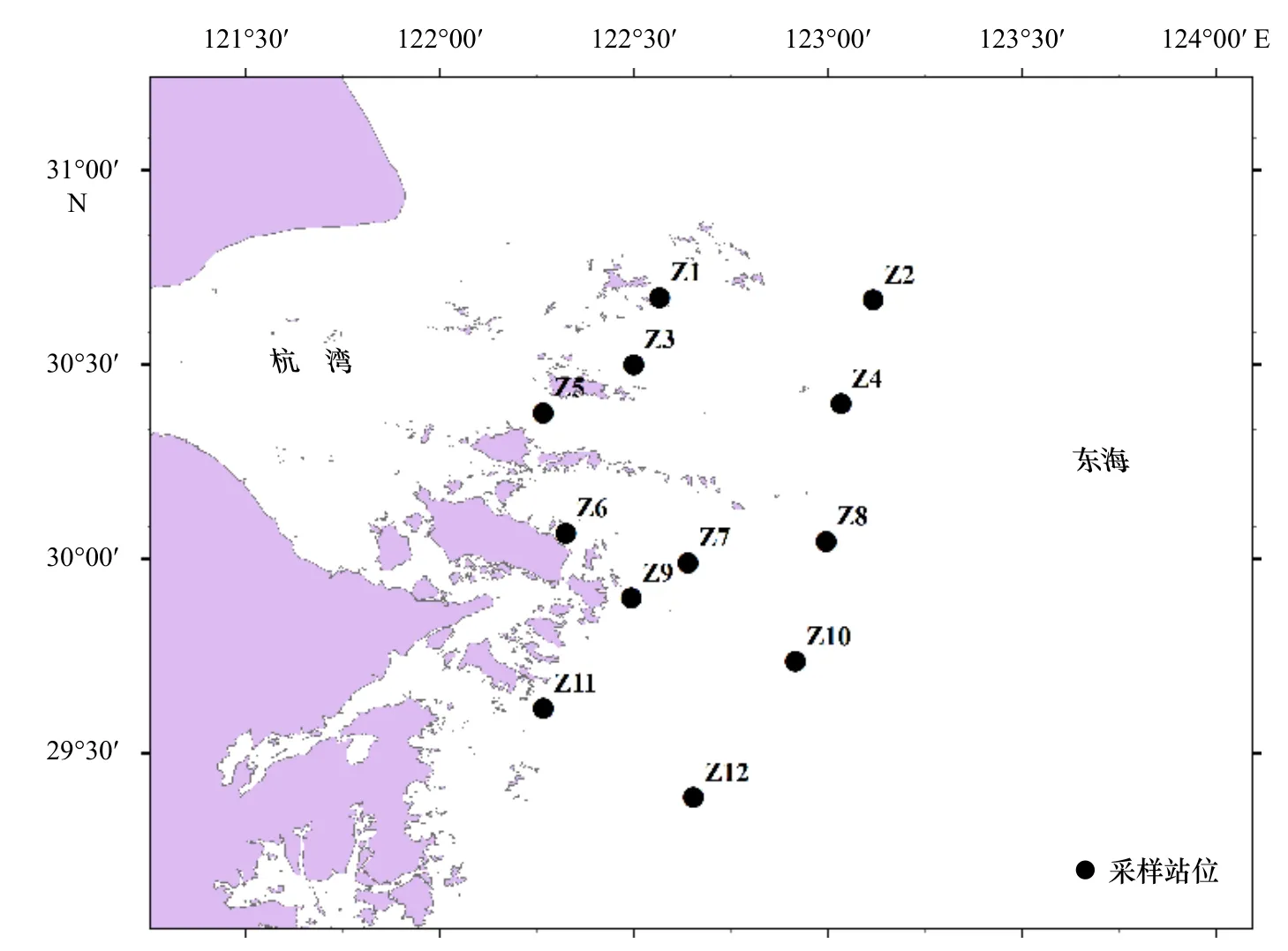
图1 2019-2020年夏季舟山海域浮游动物采样站位Fig. 1 Zooplankton sampling stations in the Zhoushan waters during the summer of 2019-2020
使用船载测深仪测量水深;使用温盐深仪CTD测量水温和盐度;使用pH计法测量pH;采用碘量法测量溶解氧(DO)浓度;采用荧光分光光度法测量叶绿素a(Chla)浓度;采用过滤物重量法测量悬浮物(SS)浓度;采用碱性高锰酸钾法测量化学需氧量(COD);采用磷钼蓝分光光度法测量活性磷酸盐(PO4-P)浓度;采用奈乙二胺分光光度法测量亚硝酸盐-氮(NO2-N)浓度;采用锌-镉还原法测量硝酸盐-氮()浓度;采用次溴酸盐氧化法测量氨-氮浓度;采用硅钼蓝法测量活性硅酸盐(SiO3-Si)浓度。此外,总无机氮(TIN)浓度等于亚硝酸盐-氮、硝酸盐-氮与氨-氮的浓度和。水样采集与分析按《海洋监测规范》(GB 17378.4-2007)[16]进行。
2.2 数据分析
2.2.1 优势种分析
采用优势度指数(Y)[17]判断浮游动物优势种:

式中,ni为 第i种浮游动物的个体数;N为所有浮游动物种类总个体数;fi为该种出现的站位数与总站位数的比值。当Y>0.02[10]时,该种为优势种。
2.2.2 优势种更替率
优势种更替率计算公式(S)[10]为
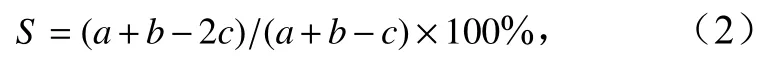
式中,a为2019年浮游动物优势种种类数;b为2020年浮游动物优势种种类数;c为两年共同优势种种类数。
2.2.3 生态位宽度
Shannon生态位宽度(Bi)计算公式[18]为
式中,Bi的取值范围为[0,R];Pij为i种在j站位的个体数与该物种总个体数的比值;R为总站位数。
2.2.4 生态位重叠
Pianka指数生态位重叠指数(Oik)计算公式[19]为

式中,Oik的取值范围为[0, 1];Pij和Pkj分别为i种和k种在j站位的个体数占该物种总个体数的比值;R为总站位数;当Oik>0.6,视为显著重叠[20],当0.3<Oik<0.6时,视为重叠有意义[11]。
2.3 数据处理
使用ArcGIS Desktop 10.6制作采样站位分布图;使用Microsoft Excel 2019计算优势度指数和优势种更替率;使用R4.2.1软件计算生态位宽度值和生态位重叠值;使用SPSS 18.0 进行两独立样本t检验;使用Canoco 5.0 进行冗余分析(RDA)。
在统计分析之前对除pH外的环境因子进行对数(lg(x+1))转换[21],使其符合正态分布,然后对浮游动物优势种数据进行去趋势对应分析(DCA)。当排序轴最大梯度小于3时,使用冗余分析;排序轴最大梯度大于4时,使用典范对应分析(CCA);当排序轴最大梯度大于3小于4时,二者均可使用。结果显示,两年排序轴最大梯度均小于3,因此选择RDA。
3 结果
3.1 浮游动物群落结构及优势种
2019-2020年夏季在舟山海域共采集到浮游动物8个大类共130种,2019年采集到浮游动物103种,其中桡足类43种(41.7%)、浮游幼虫16种(15.5%)、水螅水母类11种(10.7%)、毛颚类3种(2.9%)、多毛类3种(2.9%)、原生动物1种(1.0%)、背囊类1种(1.0%)、其他动物25种(24.3%);2020年采集到浮游动物82种,其中桡足类27种(32.9%)、浮游幼虫16种(19.5%)、水螅水母类12种(14.6%)、毛颚类5种(6.1%)、多毛类2种(2.5%)、其他动物20种(24.4%)。2019年浮游动物平均丰度为3 866.6 ind./m3,Z5站最高(10 205.8 ind./m3),Z11站最低(1 164.4 ind./m3),舟山近岸海域平均丰度为4 521.1 ind./m3,舟山近海平均丰度为2 950.4 ind./m3;2020年浮游动物平均丰度为2 269.2 ind./m3,其中Z11站最高(8 452.2 ind./m3),Z9站最低(573.8 ind./m3)舟山近岸海域平均丰度为2 397.4 ind./m3,舟山近海平均丰度为2 089.6 ind./m3。
根据优势度指数(Y>0.02),舟山海域共有浮游动物优势种12种,其中2019年有优势种6种,分别是针刺真浮萤(Euconchoecia aculeata)、针刺拟哲水蚤(Paracalanus aculeatus)、夜光虫(Noctiluca scintillans)、桡足类桡足幼体(copepoda copepodite)、桡足类无节幼体(copepoda nauplius)、强额孔雀水蚤(Parvocalanus crassirostris);2020年10种,分别是刺尾纺锤水蚤(Acartia spinicauda)、肥胖箭虫(Flaccisagitta enflata)、拟长腹剑水蚤(Oithona simills)、强额孔雀水蚤、桡足类桡足幼体、桡足类无节幼体、刷状萤虾(Lucifer penicillifer)、微驼隆哲水蚤(Acrocalanus gracilis)、针刺拟哲水蚤和中华哲水蚤(Calanus sinicus)。两年共同优势种(类)4种,分别为针刺拟哲水蚤、桡足类桡足幼体、桡足类无节幼体和强额孔雀水蚤(表1)。2019年、2020年优势种更替率为66.67%。
3.2 优势种的生态位宽度
2019-2020年夏季舟山海域浮游动物优势种的生态位宽度范围为0.45~2.34,根据生态位宽度值的大小将其划分为3段,第1段浮游动物优势种Bi≥1.60,为广生态位种;第2段浮游动物优势种 0.8≤Bi<1.60,为中生态位种;第3段浮游动物优势种Bi<0.8,为窄生态位种。
2019年夏季舟山海域浮游动物优势种的生态位宽度范围为1.47~2.27,其中针刺真浮萤(1.60)、强额孔雀水蚤(1.75)、桡足类无节幼体(2.23)和桡足类桡足幼体(2.27)为广生态位种,针刺拟哲水蚤(1.47)和夜光虫(1.55)为中生态位种,无窄生态位种(表2)。广生态位种和中生态位种分别占全部优势种的66.67%和33.33%。

表1 2019年、2020年夏季舟山海域浮游动物优势种Table 1 Dominant zooplankton species in the Zhoushan waters in summer 2019 and 2020
2020年夏季舟山海域浮游动物优势种的生态位宽度范围为0.45~2.34,其中微驼隆哲水蚤(1.61)、强额孔雀水蚤(1.73)、肥胖箭虫(1.74)、桡足类无节幼体(1.82)、中华哲水蚤(1.92)和桡足类桡足幼体(2.34)为广生态位种,刺尾纺锤水蚤(1.25)和拟长腹剑水蚤(1.41)为中生态位种,针刺拟哲水蚤(0.45)和刷状萤虾(0.76)为窄生态位种(表3)。广生态位种、中生态位种和窄生态位种分别占全部优势种的60.00%、20.00%和20.00%。
共同优势种中,除针刺拟哲水蚤外,其他3种优势种生态位宽度值变化不大,仍为广生态位种,仅针刺拟哲水蚤生态位宽度值大幅度下降,由2019年的中生态位种(1.47)变为2020年的窄生态位种(0.45)。
3.3 生态位重叠
2019-2020年夏季舟山海域浮游动物优势种的生态位重叠指数范围为0~0.98。2019年浮游动物优势种生态位重叠指数范围为0.11~0.79,其中生态位显著重叠(Oik≥0.6)有5种对,占33.33%,分别为桡足类桡足幼体和桡足类无节幼体(0.79)、桡足类桡足幼体和强额孔雀水蚤(0.60)、桡足类无节幼体和强额孔雀水蚤(0.63)、桡足类无节幼体和针刺拟哲水蚤(0.68)、针刺拟哲水蚤和强额孔雀水蚤(0.72)。生态位重叠有意义(0.3≤Oik<0.6)的有6种对,占46.67%,其中桡足类桡足幼体和针刺真浮萤(0.58)、桡足类桡足幼体和针刺拟哲水蚤(0.59)之间重叠指数均接近0.6。其余3个种对的生态位重叠指数均小于0.3,占20%(表2)。
2020年浮游动物优势种生态位重叠指数范围为0~0.98,生态位显著重叠(Oik≥0.6)有11种对,占24.45%。其中微驼隆哲水蚤和刷状萤虾(0.87)、拟长腹剑水蚤和刺尾纺锤水蚤(0.96)、拟长腹剑水蚤和针刺拟哲水蚤(0.97)、刺尾纺锤水蚤和针刺拟哲水蚤(0.98)之间的生态位重叠指数达到了0.85以上。生态位重叠有意义(0.3≤Oik<0.6)的有11种对,占24.45%,其中桡足类桡足幼体和强额孔雀水蚤(0.58)之间重叠值接近0.6。其余23个种对的生态位重叠指数均小于0.3,占51.10%,其中微驼隆哲水蚤和针刺拟哲水蚤(0)、刷状萤虾和针刺拟哲水蚤(0)生态位重叠指数为0(表3)。
3.4 生态位分化
3.4.1 舟山海域环境因子
2019-2020年夏季舟山海域主要环境因子存在显著差异(表4),其中2019年温度、pH和Chla浓度显著高于2020年(p<0.05),而2020年SS和SiO3-Si浓度则显著高于2019年(p<0.05),其余各环境因子差异不显著(p>0.05)。
3.4.2 冗余分析
利用前向选择和蒙特卡罗检验对各环境因子进行筛选(p<0.05),根据筛选结果(表5),2019年筛选出SiO3-Si浓度、COD、温度和Chla浓度进行排序分析,2020年筛选出SiO3-Si浓度和DO浓度进行排序分析(图2)。
2019年筛选出4个环境因子与6个浮游动物优势种进行RDA分析,分析结果如下:RDA1特征值为0.587 5,解释物种变量为58.75%,RDA2特征值为0.232 6,解释物种变量为23.26%,2个排序轴4个环境因子的累积解释物种变量为82.01%。2019年浮游动物生态位分化主要受SiO3-Si浓度、COD、温度和Chla浓度的影响。

表4 2019年、2020年夏季舟山海域环境因子Table 4 Environmental factors of Zhoushan waters in summer 2019 and 2020
2020年筛选出2个环境因子与10个浮游动物优势种进行RDA分析,分析结果如下:RDA1特征值为0.739 2,解释物种变量为73.92%,RDA2特征值为0.147 4,解释物种变量为14.74%,2个排序轴2个环境因子的累积解释物种变量为88.66%。2020年浮游动物生态位分化主要受SiO3-Si浓度和DO浓度的影响。

表5 环境因子筛选结果Table 5 Results of the selection on environmental factors
3.4.3 RDA排序图
由图2可知,2019年针刺真浮萤、针刺拟哲水蚤、桡足类桡足幼体、桡足类无节幼体和强额孔雀水蚤的分布主要受COD、温度、Chla浓度和SiO3-Si浓度的影响,其中针刺拟哲水蚤、桡足类桡足幼体、桡足类无节幼体和强额孔雀水蚤分布与COD、温度、Chla浓度和SiO3-Si浓度呈正相关,针刺真浮萤分布与COD、温度、Chla浓度和SiO3-Si浓度呈负相关,夜光虫分布与COD和Chla浓度呈正相关,与SiO3-Si浓度呈负相关,与温度相关性较低。

图2 2019-2020年夏季舟山海域浮游动物优势种冗余分析排序图Fig. 2 RDA ordination graphs of the dominant zooplankton species in the Zhoushan waters in summer 2019-2020
2020年,针刺拟哲水蚤、桡足类桡足幼体、桡足类无节幼体、强额孔雀水蚤、刺尾纺锤水蚤、肥胖箭虫、拟长腹剑水蚤、刷状萤虾、微驼隆哲水蚤和中华哲水蚤的分布主要受SiO3-Si浓度和DO浓度的影响,其中桡足类无节幼体、肥胖箭虫、中华哲水蚤的分布与DO浓度呈正相关,除强额孔雀水蚤的分布与SiO3-Si浓度呈正相关外,其余优势种的分布均与SiO3-Si浓度呈负相关。
4 讨论
4.1 浮游动物群落结构及优势种分析
本研究中,浮游动物群落组成均为桡足类最多,其次依次为浮游幼虫和水螅水母类,这种群落结构与孟庆超和赵淑江[22]、骆鑫等[13]的研究结果相似。2020年浮游动物物种数、平均丰度均低于2019年,该结果与许卓昀等[23]发现“舟山海域浮游生物种类逐年减少、丰度逐年上升”的研究结果不完全一致,其原因可能与2019年夜光虫暴发有关,其平均丰度远高于其他优势种,使得2019年浮游动物丰度高于2020年。两年舟山近海浮游动物平均丰度低于舟山近岸海域,这种研究结果与陈小庆等[24]研究结果相一致。
2019年舟山海域浮游动物优势种共6种,分别是针刺真浮萤、针刺拟哲水蚤、夜光虫、桡足类桡足幼体、桡足类无节幼体、强额孔雀水蚤,平均优势度约为0.08。2020年浮游动物优势种共10种,分别是刺尾纺锤水蚤、肥胖箭虫、拟长腹剑水蚤、强额孔雀水蚤、桡足类桡足幼体、桡足类无节幼体、刷状萤虾、微驼隆哲水蚤、针刺拟哲水蚤和中华哲水蚤,平均优势度约为0.07。已有的研究表明,浮游动物优势种越多且优势度越小,则群落结构越复杂、稳定[25],简单、脆弱的群落结构会给该海域海洋生态系统的稳定和健康带来威胁[26]。本研究与侯朝伟等[21]2018年夏季在烟台近海海域获得浮游动物优势种11种(平均优势度0.07)、李浩然等[27]2009年夏季在黄河口及邻近海域获得浮游动物优势种5种(平均优势度0.11)、叶文建等[2]2014年夏季在舟山岛附近海域获得浮游动物优势种6种(平均优势度0.11)相比,烟台近海海域浮游动物优势种群落结构最复杂稳定,其次为舟山海域,且随着年份增加,结构的复杂性、稳定性增加,最次为黄河口及其邻近海域,群落结构相对简单、脆弱。2019年和2020年共同优势种共4种,分别为针刺拟哲水蚤、桡足类桡足幼体、桡足类无节幼体和强额孔雀水蚤。2019年、2020年优势种的更替率为66.67%,更替率处于较高水平,说明2019-2020年舟山海域浮游动物的优势种组成存在较为明显的年际差异[21]。
4.2 生态位宽度分析
生态位宽度指物种可以利用的所有资源的总和,反映出其对生境的适应程度和对资源的利用能力[28-29]。2019-2020年舟山海域浮游动物优势种的生态位宽度范围为0.45~2.34,存在较大的差异,根据生态位宽度值的大小,可将其划分为广生态位种(Bi≥1.60),对环境有广泛适应能力;中生态位种(0.8≤Bi<1.60),对环境的适应能力稍差;窄生态位种 (Bi<0.8),对环境的要求较高[21]。2019年和2020年浮游动物优势种中,窄生态位种的占比分别为0%和20%,中生态位种的占比分别为33.33%和20%,广生态位种的占比分别为 66.67%和60.00%,表明广生态位种是舟山海域浮游动物优势种的主要组成成分,这与侯朝伟等[21]在烟台近海海域的研究结果相似。广生态位种主要对空间因素做出响应,窄生态位种主要对环境因素做出响应[6],当环境发生变化时,物种对生境的适应程度和对资源的利用能力也会发生变化[21]。在4种共同优势种中,桡足类桡足幼体、桡足类无节幼体和强额孔雀水蚤的生态位宽度值发生浮动,这3个物种生态位宽度值在2019年均占据前列,虽经历变化但仍属于广生态位种,仅针刺拟哲水蚤的生态位宽度值大幅度下降,由2019年的中生态位种(1.47)变为2020年的窄生态位种(0.45)。分析其原因,强额孔雀水蚤为近海广布种,其适合的温度为5~33℃[30],舟山近海温度的变化仍在其适合的温度范围内,夏季比较适宜浮游幼虫的生存[31];因此,它们生态位宽度变化不大。针刺拟哲水蚤为近岸暖水种,2019-2020年温度下降较为显著,对针刺拟哲水蚤造成一定的影响,使其对舟山近海环境的适应程度和资源的利用能力下降,从而使其生态位宽度下降。同样的情况发生在针刺真浮萤,其虽在2019年为广生态位种(1.60),但其为暖水种,对温度变化极为敏感[32],温度的显著下降使得该种大量减少。由此,广生态位种一般更容易适应环境的改变,使得其竞争力增强从而更容易取得优势地位,生态位宽度值在一定程度上可以判定物种的优势度大小,该研究结果与前人的研究结果[10,33]相似。
4.3 生态位重叠分析
生态位重叠指数可以衡量物种间对资源环境利用的相似度和竞争性[33]。本研究中,2019年浮游动物优势种Oik≥0.6的占33.33%,2020年Oik≥0.6的占24.44%,种对间显著重叠现象不广泛。梁淼等[10]和侯朝伟等[21]研究发现,广生态位种之间往往生态位重叠程度也较高,但本研究结果并未发现这一现象,如2020年的桡足类桡足幼体(Bi=2.34)和中华哲水蚤(Bi=1.92)之间的生态位重叠指数仅为0.56,重叠不显著。刘坤等[34]研究表明,环境资源的高异质性、物种的斑块状分布、种群生态学特性差异等因素,均会导致不同生态位宽度的物种间产生不同程度的生态位重叠。因此,仅靠生态位宽度值判断物种间的竞争性可能存在一定的偏差。
2019年生态位重叠指数最高的为桡足类无节幼体和桡足类桡足幼体(0.79),桡足类发育分为无节幼体和桡足幼体两个阶段[35],二者之间关系密切,对环境的选择重合度较高。2020年生态位重叠指数最高的为针刺拟哲水蚤和刺尾纺锤水蚤(0.98),从生态类群看,二者均为暖水近岸低盐种[36-38],生存环境相似,资源不足时种间易产生较激烈的竞争。2020年微驼隆哲水蚤和刷状萤虾(0.87)等4组种对之间的生态位重叠指数达到了0.85以上,表明这些种类在同一空间竞争共同资源的现象极其激烈。2020年微驼隆哲水蚤和针刺拟哲水蚤(0)、刷状萤虾和针刺拟哲水蚤(0)生态位重叠指数为0,表明这些种类在同一生境中既相互重叠又相互独立[39]。除2020年肥胖箭虫和中华哲水蚤、肥胖箭虫和桡足类无节幼体以及刷状萤虾和微驼隆哲水蚤之间生态位重叠显著外,两年中其余种对间生态位重叠显著的均为桡足类生物。另外,2019年针刺拟哲水蚤的生态位宽度值为1.47,到2020年时已下降为0.45,其原因亦可能是其与刺尾纺锤水蚤(0.98)和拟长腹剑水蚤(0.97)的种间竞争有密切的关系。从生态类群看,前两者均为暖水低盐种,拟长腹剑水蚤虽为广温广盐种[40],但有研究证明拟长腹剑水蚤对低盐度表现出一定的偏好,且对温度和盐度都表现出较高的耐受性[41],因此三者之间的种间竞争较为激烈,从而导致针刺拟哲水蚤的生态位宽度值下降。
4.4 浮游动物优势种生态位与环境因子的关系分析
浮游动物体积较小,游泳能力微弱,其移动通常靠水的流动,浮游动物的生态位分布主要受环境因子的影响[4,6]。舟山海域位于长江及钱塘江两大河口的交汇处,大量营养物质随河水流入,同时受台湾暖流和沿岸寒流的影响,使得该海域环境因子复杂多样[42],因此浮游动物种类及分布也呈多样化。冗余分析能很好地考虑环境因子对物种的影响,反映浮游动物对不同生境的适应性特征[34]。根据RDA结果分析, 2019年浮游动物优势种生态位分化主要受SiO3-Si浓度、COD、Chla浓度和温度的影响,2020年浮游动物优势种生态位分化主要受SiO3-Si浓度和DO浓度的影响。
本研究发现,SiO3-Si浓度是影响舟山海域2019-2020年浮游动物优势种变化的主要因素之一,2019年有多种浮游动物优势种与SiO3-Si浓度成正相关,2020年多数与SiO3-Si浓度成负相关,存在一定的差异,姜会超等[43]和卞少伟等[44]均发现浮游动物丰度与硅酸盐浓度呈正相关,但庞碧剑等[26]发现浮游动物丰度与硅酸盐浓度呈负相关,朱旭宇等[45]发现浮游生物群落参数与硅酸盐浓度等具有较强相关性,但因物种的不同而存在差异。氮∶磷∶硅比值为16∶1∶16是浮游植物生长过程中吸收营养盐的最佳比值[45],且营养盐浓度及结构不同,对浮游动物群落结构调控作用不同。本研究中,2019年氮∶磷∶硅比值为25∶1∶30,2020年氮∶磷∶硅比值为78∶1∶230,可见本海域存在严重的营养盐比例失调现象。而SiO3-Si是许多海洋浮游植物尤其是硅藻必需的营养盐之一,舟山海域浮游动物优势种多为桡足类,喜食硅藻[46],一方面硅酸盐等营养盐通过影响硅藻等浮游植物的分布间接影响浮游动物分布[1],与浮游动物之间并非简单的线性关系,另一方面舟山海域捕捞、开发和航行等繁密人类活动也可能对浮游动物产生影响,应在今后的研究中增加对浮游植物的测定及研究,进一步探讨浮游动物群落变化机理。
本研究发现,舟山海域2019年多数浮游动物优势种与COD、Chla浓度和温度呈正相关,该结果与俞存根等[47]、骆鑫等[13]、边佳胤等[14]和叶文建等[2]在舟山海域夏季所得结果相似。COD可反映出水体中有机物污染的程度和水体溶解氧的交换平衡,是评测有机物相对含量的重要指标,Chla浓度可评估海域初级生产力和浮游植物生物量,与浮游植物丰度相关性高[48],COD和Chla浓度均可通过影响浮游植物的分布间接影响浮游动物分布[49];海水温度一方面可影响浮游动物的新陈代谢强度直接影响浮游动物分布[50-51],另一方面可影响浮游植物的生长分布间接影响浮游动物分布[52],2019年舟山海域存在厄尔尼诺现象,使得海水温度较高,优势种多为暖水种,如针刺拟哲水蚤等;2020年舟山海域多数浮游动物优势种与DO浓度成负相关,该结果与卞少伟等[44]在辽东湾夏季及叶文建等[2]在舟山海域夏季所得结果相似,但也有一些浮游动物优势种与DO浓度成正相关,边佳胤等[14]发现舟山海域夏季浮游动物丰度与DO浓度成正相关。水中DO浓度是浮游动物生活和分布的重要因素,其浓度高低可以直观表征生物的环境状况[28]。叶文建等[2]监测时间、范围为2014年7月舟山岛附近,边佳胤等[14]监测时间、范围为2016年8月舟山及邻近海域,时空分布不同,可能会导致结果存在一定的差异,可见浮游动物与溶解氧之间的关系比较复杂,存在一定的相关性,但这种相关性可能会因时空分布及人为因素等存在差异。
4.5 舟山海域浮游动物历史变化及人类活动的影响
参考近年来舟山海域夏季浮游动物研究报道(表6),2011年与2014年相比,2019年与2020年相比,舟山海域浮游动物种类数和丰度均下降。2016年的研究范围主要为舟山各岛近岸海域,分布在近海的站位相对较少,因此导致种类数、丰度及生物量均偏高。2019-2020年的研究中,采集浮游动物使用的是浅水Ⅱ型浮游动物网具,网口面积小,因此导致物种数、丰度偏高,但这种情况下下降趋势仍较为明显。
舟山作为重要的港口城市和中国最大的渔场,人口繁密,人为干扰会对浮游动物造成巨大的影响。浮游动物是海洋水质监测的重要指标,且可以作为渔业资源的重要饵料,对舟山渔场渔业资源的维持具有重要意义。叶文建等[2]发现人类活动对舟山西部海域的生物群落干扰显著;陆延等[53]发现舟山电厂排水口海域浮游动物种类数、密度、生物量高于对照点海域;骆鑫等[13]发现石油污染加剧会导致浮游动物丰度和生物量偏低。2020年舟山市生态环境状况公报显示:一、二、三、四类海水比例均上升,劣四类海水比例下降,保护环境政策初具成效,但是富营养化仍较为严重,下一步可针对舟山海域浮游生物和生态环境进行长期、多次检测和评估,以期为恢复舟山渔场的海洋生态提供一些参考资料。

表6 不同年份夏季舟山海域浮游动物统计Table 6 Statistics of zooplankton in summer of different years in the Zhoushan waters
5 结论
(1)2019年和2020年夏季调查共采获浮游动物8大类130种,桡足类是浮游动物主要类群。2019年浮游动物优势种6种,2020年浮游动物优势种10种,两年共有优势种4种,两年浮游动物优势种年际差异明显,更替率为66.67%。
(2)2019年夏季浮游动物优势种的生态位宽度范围为1.47~2.27,生态位重叠指数范围为0.11~0.79,广生态位种占浮游动物优势种的66.67%;2020年夏季浮游动物优势种的生态位宽度范围为0.45~2.34,生态位重叠指数范围为0~0.98,广生态位种占浮游动物优势种的60.00%;两年夏季广生态位种物种是舟山海域浮游动物优势种的主要组成成分,但未呈现出广生态位种之间生态位重叠程度均较高的现象。
(3)根据RDA结果,2019年浮游动物优势种生态位分化主要受SiO3-Si浓度、COD、温度和Chla浓度的影响。2020年主要受SiO3-Si浓度和DO浓度的影响。
——以“不同咖啡因饮料对水蚤心率的影响”为例

