MIL-101-SO3H/海藻酸复合物对水体中锶的吸附性能研究
刘淑娟, 吴志能, 吴骁凯, 孟利娜, 李 松
(东华理工大学 核资源与环境国家重点实验室,江西 南昌 330013)
锶-90(90Sr)是高放废液中半衰期较长的高释热核素,它是铀和钚的裂变产物,其半衰期可达到29年。它的存在加大了放射性废液处理的难度。在环境化学中90Sr的化学行为与钙类似,容易通过饮食进入人体,因此90Sr是环境监测与评价中重点关注的核素之一。2011年日本福岛核事故中产生了大量的放射性污染水,其中主要污染环境的放射性核素就有90Sr(Nabeshi et al.,2015)。因此,去除放射性废液中的90Sr是关系到核能可持续发展的重要课题之一。
锶的去除方法目前主要有溶剂萃取法、离子交换法、吸附法、化学沉淀法,膜分离法、蒸发浓缩法、生物处理法等。其中,吸附法因具有成本低、二次污染少、操作方法简便、有机溶剂使用少等特点,是最受关注的方法之一(袁定重等,2020; 王云等,2018)。 MOFs材料是一类由有机配体和金属离子或金属簇自组装而成的多孔材料,具有很高的孔隙率和比表面积。相比传统的多孔材料,MOFs材料可以通过变换金属离子和配体来调节孔径和孔道结构。这些优点使得MOFs在金属离子吸附方面更具优势。Yaghi 等(1995)在Nature上报道了第一个金属有机骨架的MOFs材料之后,MOFs就因其优异的理化性能在分离、催化、储能等诸多方面呈现巨大的发展潜力(Li et al., 2012;Nandasiri et al., 2016;Wang et al., 2016)。但MOFs材料本身多以纳米粉末状态存在,固液分离较为困难,操作不易。为了克服固液分离难的缺点,人们将MOFs材料功能化为磁性材料(Boroujeni et al., 2016)、复合薄膜(Gong et al., 2020)或粒径更大的复合球体等,以扩展它的实际应用。MIL-101-SO3H是一种具有三维MTN型沸石结构的MOFs材料,具有两种类似的介孔笼型。磺酸基均匀分布在MOFs中,使其易于进行阳离子交换,MIL-101-SO3H已经被用于锶、铯(Aguila et al., 2016)、碘(Zhao et al., 2015)及有机物等的吸附研究。 海藻酸钠是一种天然多糖,其分子链上含丰富的羟基和羧基,为金属离子的吸附提供了大量的活性位点(郭成等, 2021)。但海藻酸钠的机械强度、稳定性、耐热性、力学性能等较差,通过表面嫁接、交联、改性等手段制备的海藻酸钠基吸附材料对重金属离子吸附容量大、去除彻底,拥有较好的工业应用前景。笔者基于MOFs材料和海藻酸钠的特性,采用水热法制备了MIL-101-SO3H材料,再通过后修饰制备了MIL-101-SO3H/海藻酸球状复合材料,用于研究其对水溶液中锶的吸附性能。
1 实验
1.1 主要试剂和仪器
均苯四甲酸、海藻酸钠、三氧化铬和硝酸锶购自阿拉丁试剂股份有限公司,2-磺酸基对苯二甲酸单钠盐购自梯希爱(上海)化成工业发展有限公司,以上试剂均为分析纯。
Nova Nano 450型扫描电子显微镜(美国FEI公司);NiCOLETiS5型傅里叶变换红外光谱仪(美国Thermo Fisher Scientific公司);比表面积及孔径分析仪(北京中科晖玉科技有限公司);TAS-990原子吸收光谱仪(北京普析通用仪器有限责任公司)。
锶标准溶液:称取2.42 g硝酸锶,用去离子水溶解后定容于1 000 mL容量瓶中,得到1 mg/mL的锶储备液,使用时根据需要按比例稀释后获得不同浓度的锶溶液。
1.2 MIL-101-SO3H的合成
按照文献方法(Zhou et al.,2014),将1.25 g氧化铬,3.35 g 2-磺酸对苯二甲酸单钠盐和0.8 mL浓盐酸,加入到25 mL去离子水中,然后将溶液转入带有聚四氟乙烯内衬的不锈钢高压反应釜内,在温度180 ℃下反应6 d,反应产物依次用去离子水和甲醇洗涤,室温自然干燥后加入DMF,在120 ℃加热24 h以纯化产物,再将产物用20%甲醇溶液处理后在120 ℃反应24 h,得到绿色晶体粉末MIL-101-SO3Na。将MIL-101-SO3Na加入20%甲醇溶液中,加入稀盐酸,在120 ℃反应24 h,再将产物用20%甲醇溶液进行洗涤以除去多余的HCl,最后所得产物于120 ℃下真空干燥过夜,得到绿色粉末即为MIL-101-SO3H。
1.3 MIL-101-SO3H/海藻酸复合球体的合成
按照文献(Zhuo et al.,2017)准确称取2 g MIL-101-SO3H和2 g海藻酸,将其置于100 mL去离子水中,搅拌均匀。将1 g氯化钙溶于100 mL去离子水中,再将海藻酸和MOFs的混合物溶液滴入氯化钙溶液中形成小球,静置30 min,然后用去离子水清洗3次,将复合球冷冻干燥,得到MIL-101-SO3H海藻酸球,球体直径约2~3 mm(图1)。

图1 MIL-101-SO3H/海藻酸复合物Fig.1 MIL-101-SO3H/alginate composite
1.4 吸附实验
称取一定量的MIL-101-SO3H/海藻酸复合球体于聚乙烯振荡瓶中,加入20 mL的锶标准溶液,震荡一定时间,吸附达平衡后移取适量溶液到20 mL容量瓶,用盐酸调节酸度后定容,在选定的仪器条件下,用火焰原子吸收光谱仪进行锶含量测定,锶的平衡吸附容量用下式计算:
(1)
式中,qe为吸附平衡时MIL-101-SO3H/海藻酸复合物对锶的吸附量(mg/g),C0为溶液中锶的初始浓度(μg/mL),Ce为吸附达平衡时溶液中锶的浓度(μg/mL),V为溶液的初始体积(mL);m为吸附剂的质量(g)。
2 结果与讨论
2.1 材料表征
对制备的吸附材料进行了SEM表征与EDS分析(图2)。由图2a可见,MIL-101-SO3H粉体是不太规则的球状颗粒,直径约为2.5 μm。但从MIL-101-SO3H/海藻酸复合物球体的剖面SEM图(图2b)中已经看不到明显的MIL-101-SO3H的纳米颗粒,这是因为MOFs纳米颗粒被包裹在海藻酸胶体中。通过对吸附锶的复合物材料进行EDS能谱分析,由图2c可以清晰地看到锶特征峰的存在,证实了复合物对锶的吸附性能,被扫描区域锶的含量约为18.81%。

图2 MIL-101-SO3H的SEM图(a)及吸附锶后的MIL-101-SO3H/海藻酸剖面SEM图(b)和EDS图谱(c)Fig.2 SEM of MIL-101-SO3H (a), SEM (b) and EDS (c) images of MIL-101-SO3H/alginate composite after adsorpted Sr2+
2.2 FT-IR表征
图3为MIL-101-SO3H/海藻酸复合物的FT-IR谱图,图中1 592 cm-1是芳环上 C═C 的伸缩振动,1 401 cm-1是O─C─O特征振动吸收带,1 015 cm-1是O═S═O的伸缩振动(Boroujeni et al., 2016)。744 cm-1是芳环上C─H的振动,589 cm-1是Cr─O的振动(Zhuo et al., 2017)。
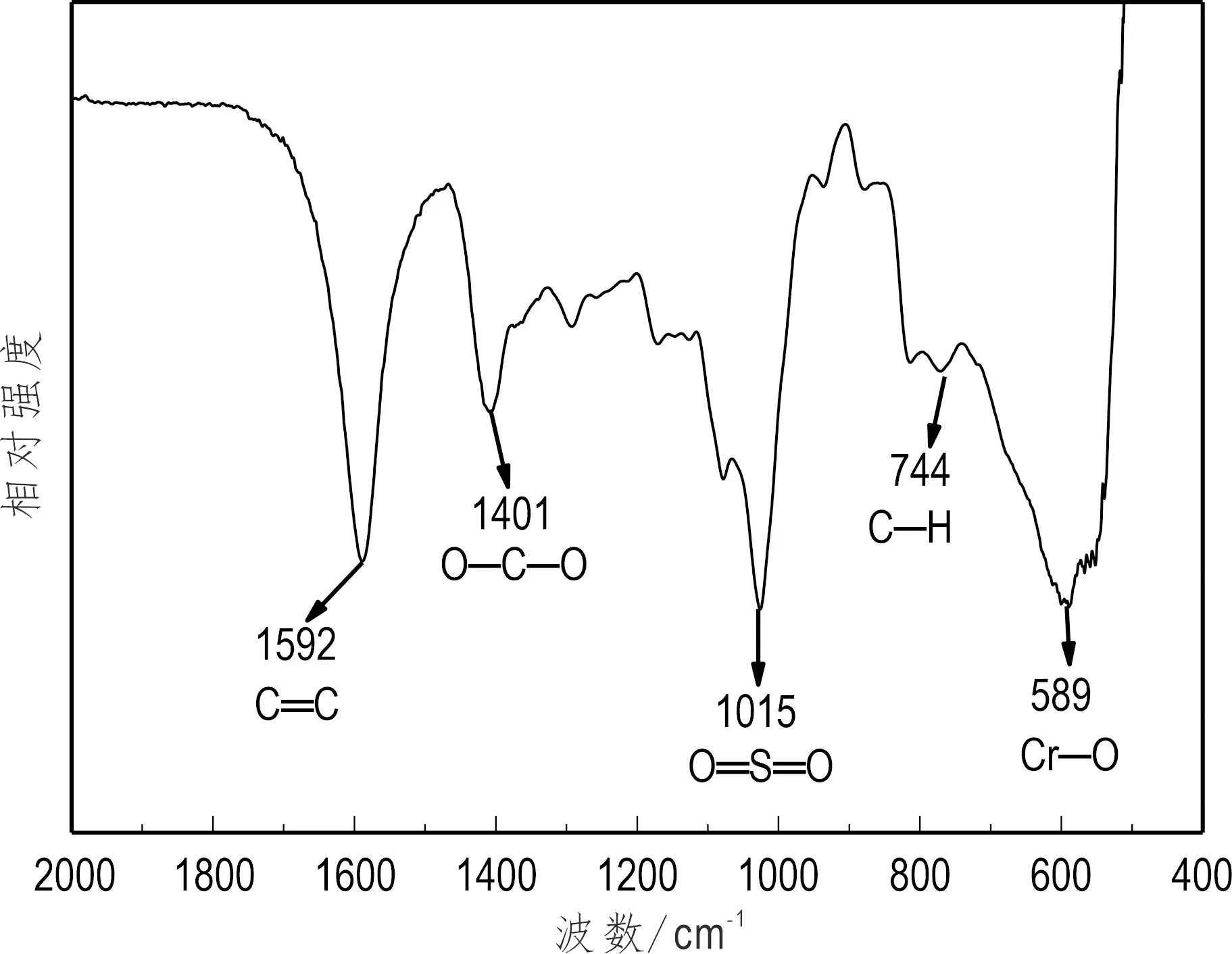
图3 MIL-101-SO3H/海藻酸复合物FT-IR谱图Fig.3 FT-IR spectrum of MIL-101-SO3H/alginate composite
2.3 N2吸附-脱附表征
采用N2吸附-脱附对样品的孔结构进行了表征,MIL-101-SO3H/海藻酸复合材料的孔径分布见图4,可以看出合成的复合材料多为介孔,存在3个峰说明材料孔径分布不是很集中,其中大部分孔径分布于2.5 nm,12 nm和40 nm左右。40 nm处孔径分布图的峰很宽,说明孔径不均一,多级的孔径有利于反应物在孔道内扩散速率的提升,并有利于其进入孔道与反应活性位点接触(周帆, 2017)。

图4 MIL-101-SO3H/海藻酸复合物孔径分布Fig.4 Pore size distribution of MIL-101-SO3H/alginate composite
2.4 pH对吸附性能的影响
溶液的pH对吸附性能有重要的影响,它会影响溶液中金属离子和吸附剂的表面电荷,同时也与氢离子和金属离子之间的竞争吸附有关。根据锶的水解常数(Cole et al., 2000),在pH为1~9时,锶在水溶液中的存在形式主要是Sr2+和很少量的Sr(OH)+。由图5可见,在pH为3至5之间,MIL-101-SO3H/海藻酸复合物对锶的吸附量随pH的增加而增加。MIL-101-SO3H是带有两个介孔笼的三维分子筛结构,磺酸基团均匀地分布其中,磺酸基上的质子可以与水溶液中的Sr2+和Sr(OH)+发生阳离子交换(Zhou et al., 2014)。当pH较低时,溶液中氢离子浓度高,吸附竞争大。另外,海藻酸的羧基和羟基基团质子化,也难于和锶离子发生离子交换,所以吸附量较低(Hong et al., 2016)。随着pH的增加,MIL-101-SO3H孔道中的负电荷逐渐增加,吸附剂对Sr2+具有更强的静电吸引力,在pH为5时吸附效果最好。在pH>5以后,可能由于Sr(OH)+的形态会发生改变,其较大的离子半径使其进入吸附剂孔道中的速度减慢,造成吸附性能稍有下降。

图5 pH对吸附性能的影响Fig.5 Effect of pH on adsorption C0=50 mg/L, m=20 mg, t=80 min
2.5 吸附剂用量对吸附性能的影响
在锶初始浓度保持不变的情况下,考察了吸附剂用量在5~60 mg变化时,吸附剂对锶的吸附性能影响(图6)。吸附剂用量较小时吸附容量较高,随着吸附剂用量的增加,吸附位点增多,在锶溶液初始浓度不变的情况下,吸附容量逐渐下降,但吸附剂对锶的吸附率显著增大,在实验条件下,当吸附剂用量为20 mg时,吸附率可达90%以上。
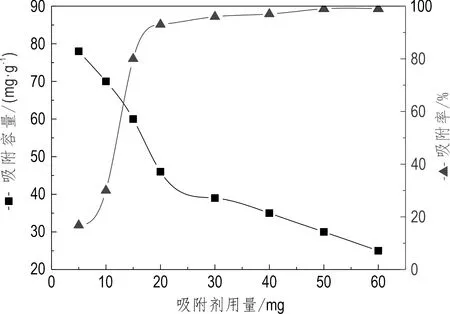
图6 吸附剂用量对吸附性能的影响Fig.6 Effect of adsorbent amount on adsorptionpH=5,C0=50 mg/L,t=80 min
2.6 初始浓度对吸附性能的影响
研究了Sr2+初始浓度在10~200 mg/L范围内变化时对吸附性能的影响(图7)。随着Sr2+初始浓度的增高,吸附量增加较快,当Sr2+初始浓度大于100 mg/L时,吸附容量的增加趋于缓慢;当Sr2+初始浓度为200 mg/L时,吸附达平衡,其最大吸附量为53.24 mg/g。另一方面,吸附率会随着初始浓度的增加而减小,在浓度为50 mg/L时吸附率达94.7%,表明在较低浓度下MIL-101-SO3H/海藻酸复合材料对锶的去除率更高。

图7 初始浓度对吸附的影响Fig.7 Effect of initial concentration on adsorptionpH=5, m=20 mg, t=80 min
吸附等温线被广泛用来表征吸附系统的平衡状态,常用的吸附等温模型有Langmuir和Freundlich模型。Langmuir模型假设吸附质之间是没有相互作用的,固体表面所有吸附位相同。Freundlich模型描述的是吸附质从液相到达不均匀表面的吸附,吸附剂表面有不同的吸附位。两种吸附等温线的线性拟合方程见式(2)和(3)。
(2)
(3)
式(2)中,Ce是吸附平衡时溶液中吸附质的浓度(mg/L),qe和qm分别为平衡吸附容量和最大吸附容量(mg/g),KL为吸附常数(L/mg)。Ce/qe-Ce呈线性,由直线斜率1/qm和截距1/(qmKL)可分别求出qm和KL的值。式(3)中,参数qe和Ce与Langmuir等温方程式中的参数意义相同,1/n表示吸附容量随被吸附物质平衡浓度的变化程度。lnqe-lnCe呈线性,由直线斜率1/n和截距lnKF可分别求出1/n和KF的值。
采用Langmuir模型和Freundlich模型对吸附数据进行了拟合(图8,表1)。可以看出Langmuir拟合条件下线性相关系数R2=0.990 7,比Freundlich模型拟合的相关系数更大,这表明MIL-101-SO3H/海藻酸球对锶的吸附更符合Langmuir模型,说明吸附过程主要为单分子层吸附,也存在少量多分子层吸附,而单分子层的吸附占主导(Wang et al., 2011),Langmuir线性拟合的最大吸附容量为49.36 mg/g。n代表吸附剂的吸附强度,当直线的斜率1/n在0.1~0.5,则表示吸附容易进行;1/n超过2时,则表示吸附难进行。

图8 MIL-101-SO3H/海藻酸复合物吸附Sr2+的Langmuir(a)和Freundlich(b)等温线Fig.8 Langmuir (a) and Freundlich (b) isotherms

表1 MIL-101-SO3H/海藻酸复合物吸附Sr2+的Langmuir和Freundlich拟合参数
2.7 时间对吸附性能的影响
研究了不同吸附时间对吸附性能的影响(图9)。在吸附起始阶段,MIL-101-SO3H/海藻酸复合物对锶的吸附量增加较快,说明吸附剂在初始阶段吸附速率较快,这是由于在初始阶段吸附剂上存在更多的吸附位点。随着吸附的进行,吸附位点逐渐被占据,70 min后吸附速率变得平缓,直到吸附达到平衡,吸附量基本不再增加。
吸附动力学主要研究吸附速率随时间变化的规律和各种因素对吸附速率的影响。采用准一级和准二级动力学模型对吸附数据进行拟合,相应的线性拟合方程如式(4)和(5)所示:
ln(qe-qt)=lnqe-k1t
(4)
(5)
式中,qe为平衡时的吸附容量(mg/g),qt为t时刻的吸附容量(mg/g),k1、k2为准一级和准二级动力学方程的吸附速率常数。以ln(qe-qt)和t/qt分别对t作图,得到准一级和准二级动力学拟合曲线(图10),相关的动力学参数见表2。

表2 Sr2+吸附的准一级和准二级吸附动力学参数
实验数据和模型的理论值之间的相关性越高,表明该模型能更好地描述金属离子的吸附动力学。由实验结果可知,准二级动力学模型的相关性(R2=0.9898)比准一级动力学模型的相关性更高,平衡吸附容量的理论计算值和实验值吻合较好,而准一级动力学的理论计算值与实验值相差较大,所以采用准二级动力学模型能更好地描述复合材料对锶的吸附动力学过程,吸附主要为化学吸附过程(Wang et al., 2015)。

图9 时间对吸附性能的影响Fig.9 Effect of time on adsorptionpH=5, C0=50 mg/L,m=20 mg
2.8 温度对吸附性能的影响
温度是吸附反应的重要参数,提高温度会提高吸附质分子穿越外部边界层和进入吸附剂颗粒空隙内的扩散速率,温度的改变也会改变吸附质的平衡吸附容量。本研究在15~55 ℃之间考察了不同温度对吸附的影响。由图11可见,温度从15 ℃升高到35 ℃,吸附容量从38.25 mg/g增加到44.26 mg/g,温度升高时Sr2+的迁移速率更快,所以随温度上升,吸附容量有所增加。35 ℃以后稍微有所下降。考虑到操作方便,本实验选择在室温下进行。
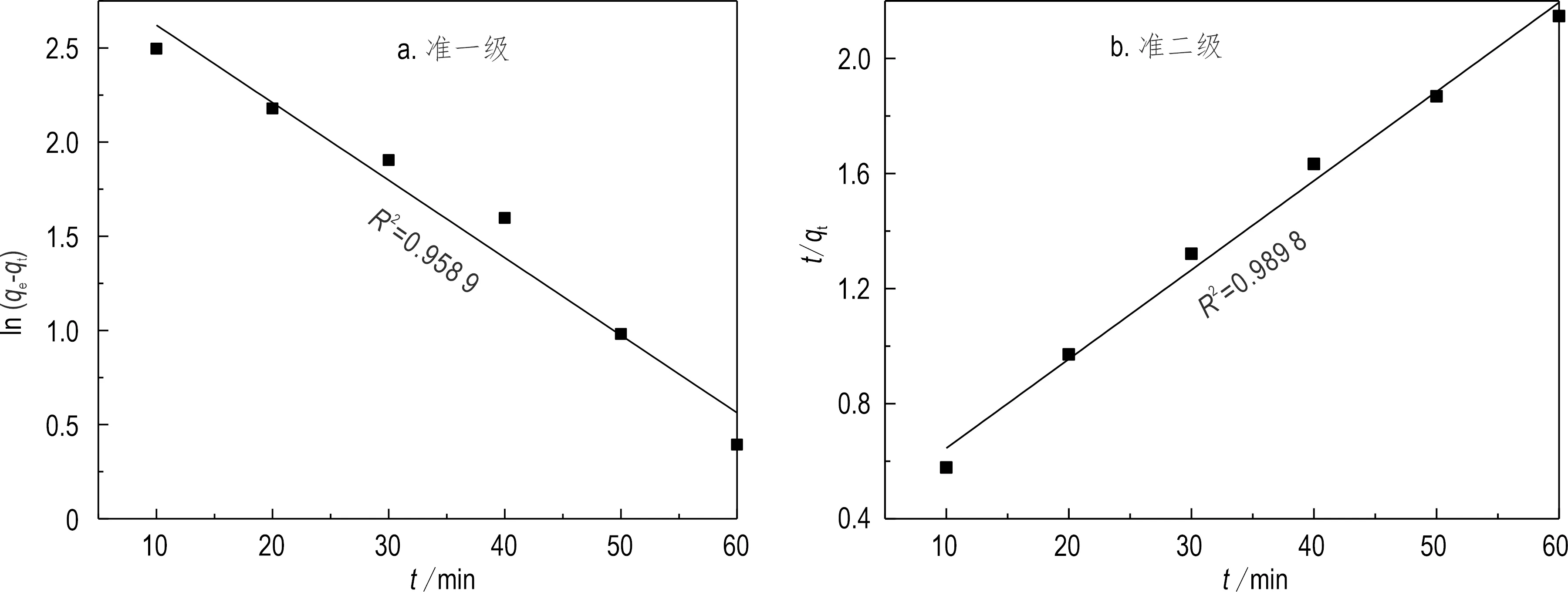
图10 Sr2+吸附的准一级(a)和准二级(b)动力学拟合曲线Fig.10 Pseudo-first-order kinetic plot (a) and Pseudo-second-order kinetic plot (b) for the Sr2+ adsorption

图11 温度对吸附性能的影响Fig.11 Effect of temperature on adsorptionpH=5,C0=50 mg/L,m=20 mg,t=80 min
2.9 干扰离子对吸附性能的影响
核工业废水中,除了锶之外,还有各种干扰离子存在,这些离子的存在可能会对吸附造成影响。本实验在pH为5的吸附体系中,研究了K+、Na+、Ca2+、Mg2+等溶液中常见的金属离子浓度为1 mmol/L 时,对Sr2+吸附性能的影响(图12)。由图12可见,Na+、K+、Mg2+的影响较小,Ca2+对于锶的吸附存在较大负干扰,这主要可能是Ca2+的离子电荷与Sr2+相同,且离子半径与Sr2+更为接近,与Sr2+竞争吸附比其他离子更为显著。
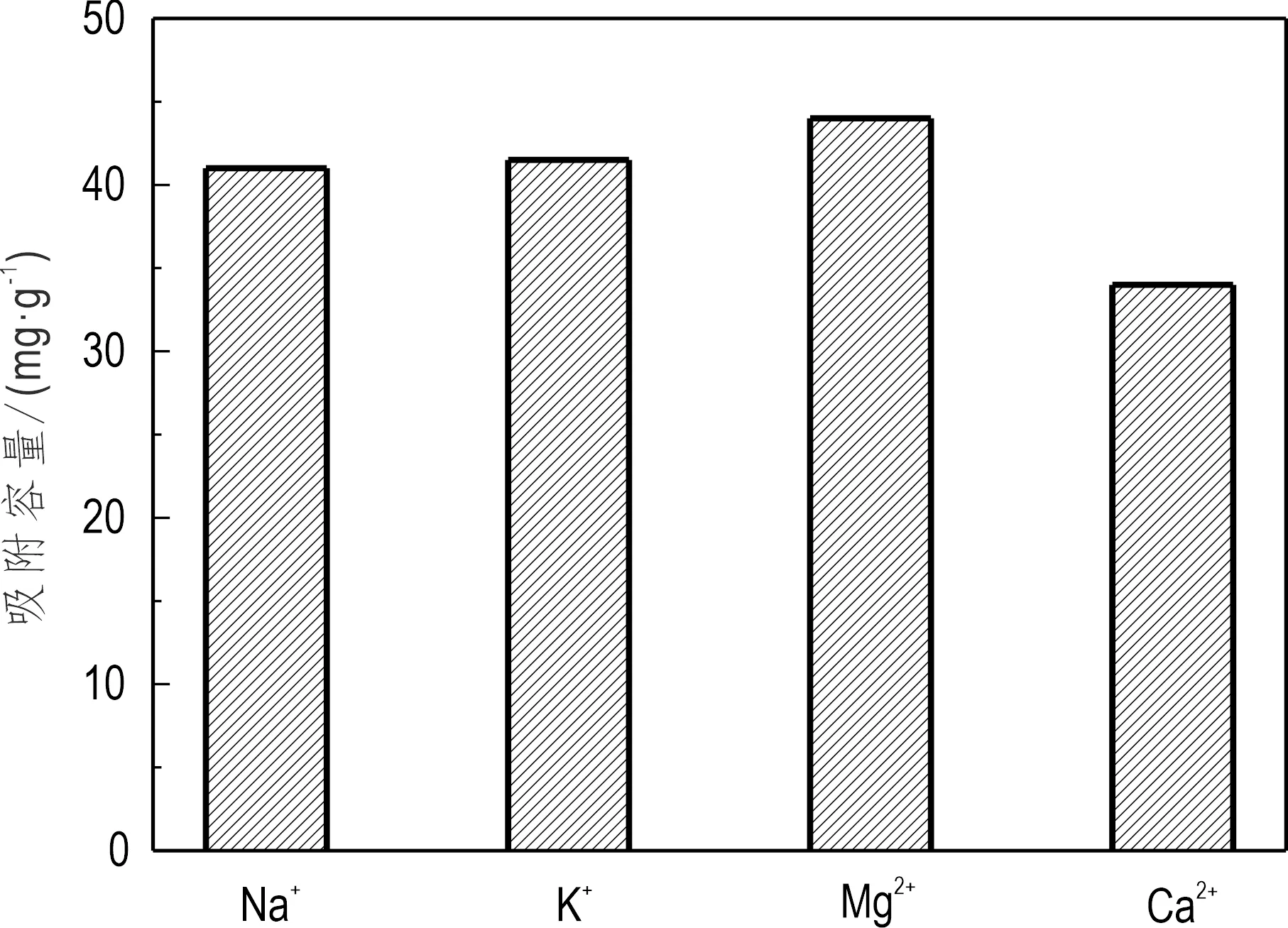
图12 干扰离子对吸附的影响Fig.12 Effect of interference ions on adsorptionpH=5,C0=50 mg/L,m=20 mg,t=80 min
3 结论
通过对粉末状的MOFs纳米材料MIL-101-SO3H进行后修饰,制备了MIL-101-SO3H/海藻酸复合球体,球体直径约2~3 mm,克服了纳米材料吸附固液分离难的缺点。对其进行了一系列表征,并详细研究了该复合物对水体中锶的吸附性能。结果表明,在pH为5时,MIL-101-SO3H/海藻酸复合球体对Sr2+的吸附符合Langmuir模型,最大理论吸附量为49.36 mg/g,动力学研究表明其对Sr2+的吸附符合准二级动力学方程。干扰离子对吸附性能的影响实验表明,Ca2+影响最大,K+、Na+影响较小,Mg2+影响最小。MIL-101-SO3H/海藻酸复合球体对水溶液中锶的吸附具有操作方便、吸附容量大,吸附速率较快等优点,对于处理放射性废液中的锶具有潜在的应用价值。

