外源壳聚糖对干旱胁迫下生姜幼苗光合特性及水分代谢的影响
秦曼丽,朱永兴,刘续立,刘 燃,李姗蓉,张中华,袁继荣,刘奕清
(1.长江大学园艺园林学院 湖北荆州 434025; 2.重庆市田沅农业科技有限公司 重庆永川 402160;3.重庆市农业技术推广总站 重庆渝北 401121; 4.山东省潍坊市安丘农业农村局 山东潍坊 262199)
生姜(Roscoe)又名百辣云、勾装指、因地辛等,起源于热带、亚热带雨林地区,是姜科姜属多年生草本植物。因其在食品、药品、保健及其他方面的巨大应用价值,在世界各地广泛种植。近十年间,我国生姜种植规模增长较快,种植面积增长70%,2018 年生姜种植面积达到29.3 万hm,约占世界种植面积的40%,产量约为950 万t,占世界总产量的75%以上,居世界第一位。生姜属于浅根系作物,根系部分布在地下20~30 cm 土壤层,对水分十分敏感。生姜是食用地下茎的作物,在水分亏缺条件下其叶尖、叶边枯黄,甚至干枯死亡,地下根茎难以膨大,产量品质下降,且生姜的根茎膨大期在盛夏高温季的7-8月,易受到干旱胁迫的影响。因此,提高生姜的抗旱性对保证生姜植株生长、品质和产量尤为重要。
干旱是制约植物生长发育的重要因子之一,近年来随着全球气温变暖,干旱问题也越发严重。目前全球约1/3 地区处于干旱或半干旱状态,每年由干旱导致的作物减产超过50%。干旱主要通过影响植物表型特征、生理代谢和相关基因表达的变化,从而抑制作物产量的提高。国内外研究人员从形态特征、解剖结构、生理生化、细胞代谢、分子生物学等方面对植物适应干旱生境的机制进行了多方面的探索。研究表明,植物受到干旱胁迫时,会破坏植物体内的水分平衡,造成植物根系生长、气孔开合周期、光合系统、叶绿体结构、基因表达等发生一定程度的紊乱,抑制植物正常生长,造成植株生长缓慢、产量降低、品质下降,形成经济损失。因此,探索植物的抗旱性,研究植物的抗旱机制,缓解干旱胁迫对植物的影响极为重要。
近年来,随着绿色农业的不断发展,植物生长调节剂凭借着低毒、高效、环保等优势在农业上得到了广泛应用。壳聚糖(Chitosan,CTS)也称脱乙酰甲壳素,是甲壳素的重要衍生物,由甲壳素通过水解或者特定的方法酶解脱乙酰化达到70%的直链高分子化合物组成,含有丰富的C、N 元素,是唯一的碱性多糖。近年来的研究发现,壳聚糖可作为一种植物调节剂,促进植物生长,增强植物的抗逆性。目前在小麦、大豆、苜蓿、玉米等作物的抗旱研究方面,已经被证实可促进生长,提高叶片数、株高,增加产量,缓解干旱胁迫。但有关壳聚糖诱导生姜响应干旱胁迫的光合特性及水分代谢的研究未见报道。
笔者以盆栽凤头姜幼苗为材料,对生姜叶面喷施10 mg·L的CTS,通过测定干旱胁迫下生姜幼苗的根系构型、光合参数及水分代谢等相关指标,探讨CTS 缓解生姜幼苗干旱胁迫的生理应答机制,为合理利用CTS 调节生姜栽培干旱胁迫提供理论依据。
1 材料与方法
1.1 材料
试验选用凤头姜为试材,是湖北主栽品种。生姜种质由长江大学香辛作物研究院提供,壳聚糖(CHNO),脱乙酰度80.0%~95.0%,购自上海市国药集团化学试剂有限公司。
1.2 试验设计
试验于2020 年8 月在长江大学香辛作物研究院人工气候室(温度26 ℃、光照度10 000 lx、湿度70%~80%、光周期为12 h 光照/12 h 黑暗)进行。挑选健壮、整齐一致、无病害的姜种进行消毒、晒种,于26 ℃黑暗条件下催芽1 周,待姜种均长出壮芽后种植于花盆(底部有孔,上径×底径×高为24 cm×20 cm×27 cm),每个花盆放置一个姜种,种植基质为∶∶=6∶3∶1 的混合基质。每间隔3 d 浇水,当盆栽种植50 d,株高60~70 cm 时进行试验。试验共设4 个处理:(1)正常水分管理(CK);(2)正常水分管理下喷施质量浓度10 mg·L壳聚糖溶液(CK+CTS)(为前期试验筛选最优浓度);(3)干旱胁迫,土壤相对持水量低于40%(DS);(4)干旱胁迫喷施质量浓度为10 mg·L壳聚糖溶液(DS+CTS)。每个处理为1 个小区,每个小区重复30 盆,共计120 盆,采用随机区组排列。CTS 采用叶面喷施的方式处理,在凤头姜幼苗的叶面喷施质量浓度为10 mg·L的CTS,对生姜叶片正面和背面均匀喷施,以叶面滴液滴为适,于10:00 进行喷施,10 d喷施1 次。
1.3 试验方法
1.3.1 植株生长及根系构型分析 试验处理25 d
时收集其根系,用于根系构型分析。将地下根系取出洗净擦干,对其块茎部对半剖开,使用Epson Perfection V700 Photo Dual Lens System 根系扫描仪(J221A,Indonesia)扫描根系图片,利用WinRHIZO professional software 2007 version(Regent Instruments Inc,Quebec,Canada)测定分析根长、根系投影面积、根系表面积、根直径和根尖数,每个处理3 株,3 次重复。
1.3.2 水分含量测定 根据侯福林和刘向莉等的方法略作调整。试验处理25 d 时取生姜幼苗叶片(取中间部位)迅速用天平称质量(G1),即初始叶片质量,然后快速转入4 ℃的蒸馏水中(借助抽真空使其完全浸泡于水中),黑暗条件下放置4~6 h,取出后用干燥洁净的吸水纸快速吸去叶片表面水分后快速称质量(G2),即饱和叶片质量。此叶片转入65%的蔗糖溶液中(完全浸泡),黑暗条件下放置4~6 h,期间摇动溶液多次。4~6 h 后,取出叶片,先用镊子夹住叶片在几个装有蒸馏水的小桶中依次快速洗涤叶片,每桶洗涤2~3 s,洗涤时间控制在10 s左右,再用洁净湿纱布和滤纸快速吸去表面残留的水分,立即用天平称质量(G3),即蔗糖溶液浸后叶片质量。此叶片称质量后转入纸袋,编号后置于烘箱,于80 ℃下烘干2 d 至恒质量,随后天平称质量(G4),即烘干叶片质量。样品中自由水含量(gHO)=(G1-G3)/G4;总含水量(gHO)=(G1-G4)/G4;束缚水含量(gHO)=总含水量(gHO)-自由水含量(gHO);相对含水量/%=(G1-G4)/(G2-G4)×100。每个处理3 次重复。
1.3.3 叶片水势及根系水力学导度测定 叶片水势的测定参考Zhu 等压力室法。取生姜幼苗从顶端往下数第3 片叶倒置于压力室内,用橡皮塞夹紧叶柄,向压力室加压,至叶柄刚刚形成水膜时读数,记录为该叶片的水势值ψ(MPa)。每个处理3 次重复。
根系水力学导度(水导)的测定参照Trubat等的方法。试验处理25 d 时,将生姜幼苗从根基部4 cm 处剪断。然后将整株根系置于压力室中,使切口露出密封圈0.2~0.4 cm,密封后慢慢加压。每次加压0.12 MPa,共加压5 次。每个压力梯度下等达到出流稳态后(约1 min)用预先准备好的10 mL 塑料离心管放入吸水纸吸取汁液,吸水时间统一为1 min,然后用万分之一天平(Sartrtorus BAS 124-CW,Goettingen,Germany)迅速准确地称量所吸水的质量。之后将根系取出,使用Epson Perfection V700 Photo Dual Lens System 根系扫描仪(J221A,Indonesia)扫描根系表面积。根据以下公式计算:=/(×)=/。公式中(10·m·s·MPa)为根系水导;(m·s)为水流通量;(m)为 根 系 表 面 积;为 外 界 所 加 压 力(MPa)。每个处理3 次重复。
1.3.4 叶绿素及类胡萝卜素相关指标测定 试验处理25 d 时,取完全展开的第一片叶,采取丙酮浸
提法提取生姜幼苗叶片中的叶绿素及类胡萝卜素。避开主叶脉,称取叶肉组织约0.2 g,放入离心管中,加入∶∶=4.0∶4.5∶1 的提取液10 mL,避光提取3 h,叶片完全褪色后,用分光光度计测定A、A和A波长下的吸光值,参照Arnon的方法计算叶绿素a、b 和a+b 的含量,每个处理3 次重复。
1.3.5 叶绿素荧光参数测定 处理25 d 时测定各处理的生姜幼苗从顶端往下数第3 片叶的叶绿素荧光参数,将剪切的叶片放入FluorCam 封闭式叶绿素荧光成像仪(PSI 公司,Czech Republic)中,在黑暗中适应20 min,测定最大光化学效率(/)、光化学淬灭系数()、实际光量子效率()、非光化学淬灭系数(NPQ)。每个处理5 次重复。
1.3.6 叶片光合参数测定 处理24 d 时,于晴天09:00-11:00 选取不同处理的生姜幼苗从顶端往下数第3 片叶,采用Yaxin-1102 便携式光合蒸腾仪(北京雅欣理仪科技有限公司)测定叶片的净光合速率()、蒸腾速率()、气孔导度()、胞间CO浓度()。测定时采用LED 红蓝光源,光强设置为1000 μmol·m·s。每个处理4 次重复。
1.3.7 根系水通道蛋白(AQP)基因表达测定 处理第5、25 d 时采集不同处理的生姜幼苗根系,测定基因表达。把采集的根系样品洗净擦干,置液氮速冻放入超低温冰箱保存。使用诺唯赞(Vazyme,Nanjing,China)试剂盒提取RNA,具体步骤参考试剂盒说明书,取1 μL RNA 样品,使用核酸仪测定浓度,其余样品放入超低温冰箱保存;提取的RNA 使用诺唯赞(Vazyme,Nanjing,China)反转录试剂盒合成cDNA,具体步骤参考试剂盒说明书;cDNA 稀释至400 ng·μL后作为模板,使用表1 中的引物进行实时荧光定量PCR(RT-qPCR)分析。实时荧光定量PCR 使用SYBR qPCR MasterMix 试 剂(Vazyme,Nanjing,China),反应总体系为20 μL,其中SYBR Premix10 μL、上下游引物各1 μL、cDNA 2 μL,加水至最终体积20 μL,充分混匀后于Bio-Rad CFX96 实时定量PCR 仪(Bio-Rad,Hercu les,USA)上扩增。每个样品3 次重复,以基因作为内参。采用2法计算基因的相对表达量。每个处理4 次重复。

表1 生姜AQP 基因引物序列
1.4 数据处理
利用Excel 2010 整理数据,采用SPSS 19.0 软件进行单因素方差分析,采用Duncan’s 多重极差检验进行单向ANOVA 分析,采用OriginPro 2021 绘图。
2 结果与分析
2.1 外源CTS 对干旱胁迫下生姜幼苗生长及根系构型的影响
由图1-a~b 可知,试验处理25 d 时,在正常水分管理下对生姜幼苗喷施10 mg·LCTS,其植株生长正常,CK+CTS 处理与对照无明显差异。连续干旱胁迫25 d对生姜幼苗生长有抑制作用(图1-c),株高明显低于CK(图1-a)。DS+CTS(图1-d)处理25 d 后,株高明显高于DS(图1-c)处理,表明CTS 对干旱有缓解作用。

图1 外源CTS 对干旱胁迫下生姜幼苗根系构型的影响
由表2 可知,试验处理25 d 时,与CK 相比,CK+CTS 处理生姜幼苗总根长、根系投影面积、根系表面积、根系直径和根尖数无显著差异,表明喷施CTS 对生姜幼苗正常水分管理下的根系生长构型无显著影响。干旱胁迫下,5 个指标均呈不同程度的下降趋势,同CK 相比,DS 处理生姜幼苗的总根长、根系投影面积、根系表面积、根尖数分别显著降低47.86%、49.04%、48.12%和40.75%,根系平均直径略有下降,但差异不显著。干旱胁迫下喷施壳聚糖5 个指标均有提高,与DS 相比,DS+CTS 处理生姜幼苗的根系投影面积、根系表面积和平均直径略有升高但差异不显著,分别提高36.89%、29.86%、1.54%;总根长、根系根尖数分别显著提高31.10%、34.39%。结果表明,干旱抑制了生姜幼苗根系的生长,喷施CTS 对干旱胁迫下生姜幼苗侧根生长有显著促进效应,缓解了干旱对生姜幼苗生长的胁迫。

表2 外源CTS 对干旱胁迫下生姜幼苗根系构型的影响
2.2 外源CTS 对干旱胁迫下生姜幼苗叶片水分含量的影响
由表3 可知,与CK 相比,CK+CTS 处理生姜幼苗叶片的自由水含量、束缚水含量、总含水量、相对含水量均无显著差异。干旱胁迫下,这4 个水分指标均呈下降趋势,同CK 相比,DS 处理显著降低了生姜幼苗叶片自由水含量、束缚水含量、总含水量相对含水量,分别下降51.94%、36.56%、44.39%、9.32%。与DS 相比,干旱胁迫下喷施壳聚糖,显著增加了生姜幼苗叶片的自由水含量、束缚水含量、总含水量、相对含水量,分别增加30.30%、13.56%、20.64%、2.01%。结果表明,干旱条件下喷施CTS可以缓解生姜幼苗的失水。
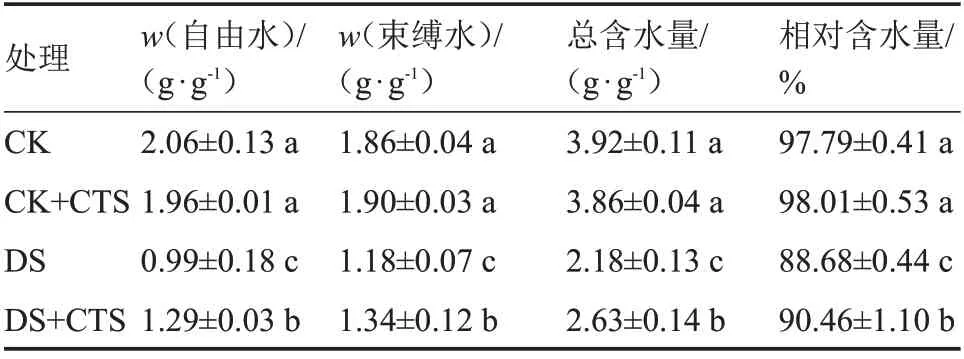
表3 外源CTS 对干旱胁迫下生姜幼苗叶片水分含量的影响
2.3 外源CTS 对干旱胁迫下生姜幼苗根系水力学导度及叶片水势的影响
由图2 可知,正常水分管理下喷施CTS 对生姜幼苗根系水力学导度(根系水导)没有显著影响。干旱胁迫下生姜幼苗根系水导显著降低,同CK 相比,DS 处理根系水导下降了68.44%;干旱胁迫下喷施CTS,生姜幼苗根系水导较DS 显著升高了100.63%。结果表明,干旱胁迫下喷施CTS 可以提高根系水导度,缓解干旱胁迫。
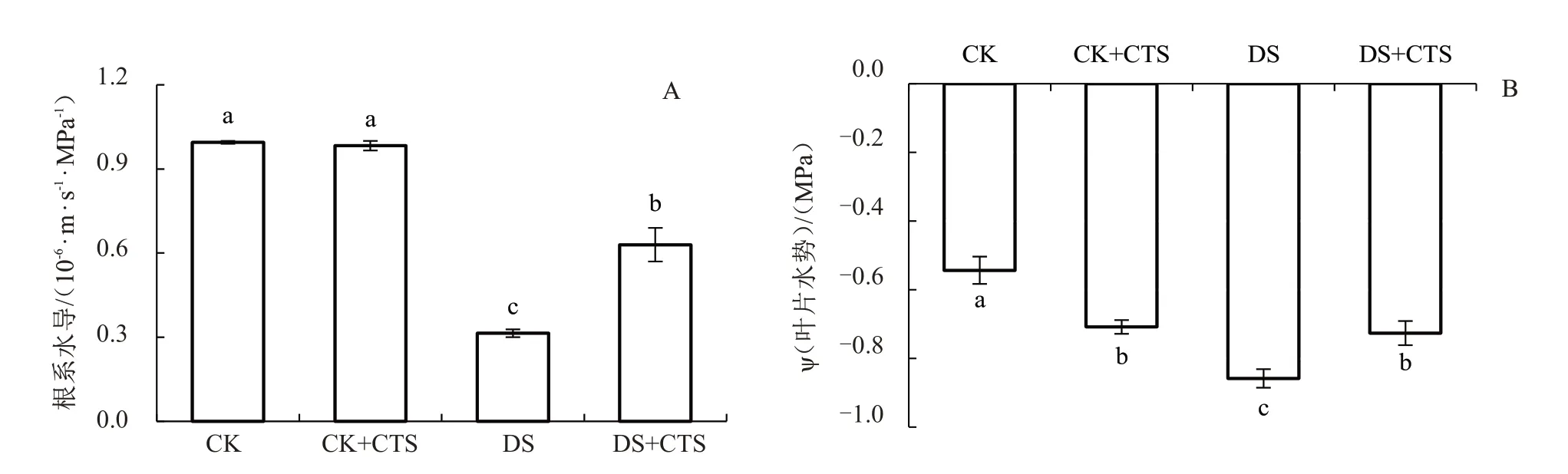
图2 外源CTS 对干旱胁迫下生姜幼苗根系水导(A)和叶片水势ψ(B)的影响
试验处理25 d 时,与CK 相比,CK+CTS 处理和DS 处理生姜幼苗叶片水势分别显著降低了30.39%、57.98%;与DS 相比,DS+CTS 处理叶片水势上升了15.38%,且差异显著。结果表明,干旱胁迫下喷施CTS 可以显著提高叶片水势,缓解干旱影响。
2.4 外源CTS 对干旱胁迫下生姜幼苗叶片叶绿素及类胡萝卜素含量的影响
由表4 可知,在试验处理25 d 时,与CK 相比,正常水分管理下喷施CTS 生姜幼苗叶片的叶绿素a、叶绿素b、叶绿素a+b 和类胡萝卜素含量无显著差异。同CK 相比,DS 处理生姜幼苗叶片的4 个指标均呈现下降趋势,分别显著降低了21.37%、34.27%、26.59%、21.44%。而喷施CTS 的生姜幼苗叶片的叶绿素含量降低幅度较小,同DS 相比,DS+CTS 处理叶绿素b 和类胡萝卜素含量分别上升了10.26%、13.79%,而叶绿素a、叶绿素a+b 含量则分别显著上升了9.23%、9.62%。结果表明,喷施CTS有助于缓解干旱胁迫下生姜幼苗叶片中叶绿素的降解。
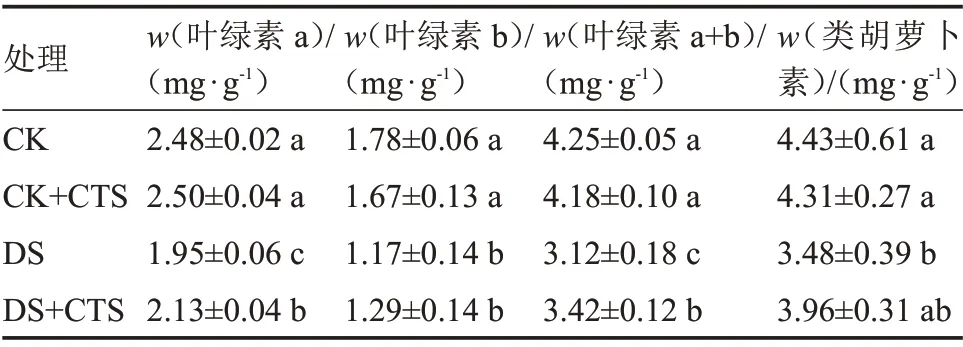
表4 外源CTS 对干旱胁迫下生姜幼苗叶片叶绿素及类胡萝卜素含量的影响
2.5 外源CTS 对干旱胁迫下生姜幼苗叶片叶绿素荧光参数的影响
由表5 可知,试验处理25 d 时,与CK 相比,CK+CTS 处理叶片、/、、NPQ 均无显著差异,表明正常水分管理条件下喷施CTS 对生姜幼苗叶片叶绿素荧光参数无显著影响。与CK 相比,DS处理叶片、/、分别显著降低40.63%、29.41%、25.76%,NPQ 显著升高48.00%;与DS 相比,DS+CTS 处理叶片、/、分别显著升高36.84%、12.50%和12.24%,而NPQ 显著降低了17.12%,表明干旱胁迫影响了生姜幼苗叶片叶绿素荧光参数,而喷施CTS 可以缓解干旱胁迫对叶片叶绿素含量的影响。

表5 外源CTS 对干旱胁迫下生姜幼苗叶片叶绿素荧光参数的影响
2.6 外源CTS 对干旱胁迫下生姜幼苗叶片光合参数的影响
由表6 可知,与CK 相比,CK+CTS 处理叶片、、、无显著变化,表明正常水分管理条件下喷施CTS 对生姜幼苗叶片光合参数无显著影响;与CK 相 比,DS 处 理 叶 片、、分 别 显 著 降 低65.72%、53.92%、63.64%;但其值显著升高34.51%;与DS 相比,DS+CTS 处理叶片显著升高78.95%,、也分别上升了16.36%、13.89%,但无显著差异,而降低了9.18%,且达显著差异水平。表明干旱胁迫影响了叶片的光合作用,而喷施CTS 可以缓解干旱胁迫对叶片光合作用的影响。
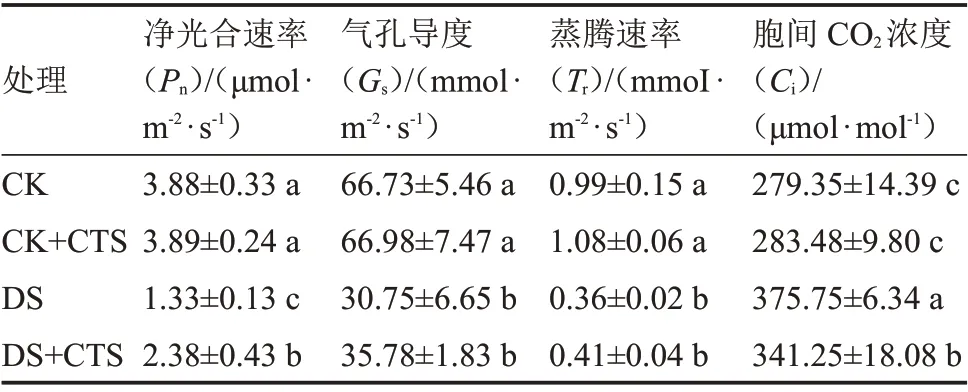
表6 外源CTS 对干旱胁迫下生姜幼苗叶片光合参数的影响
2.7 外源CTS 对干旱胁迫下根系AQP 基因表达影响
由图3 可以看出,处理5 d 时,与CK 相比,DS处理的植物、、、基因的相对表达量显著上调,分别上调了350.09%、397.37%、284.19%、629.98%。与DS 相比,DS+CTS 处理的、基因表达分别下调了15.72%、59.03%,且差异显著。处理25 d 时,与CK 相比,DS 处理的植物、基因表达显著下调,分别下调了38.09%、31.41%。与DS 相比,在干旱胁迫下施加CTS,植物中、、、、基因的表达均上调,其中、、、基因的相对表达量分别上调43.49%、18.89%、18.35%、64.18%,且差异显著。

图3 外源CTS 对干旱胁迫下生姜幼苗根系5 d(A)和25 d(B)AQP 表达的影响
3 讨论与结论
干旱胁迫会降低植物对水分、养分的吸收及水分利用效率,抑制植物正常生长,导致作物根长、根质量降低,根系总吸收面积减少,影响根系的功能。张洁等研究发现,干旱胁迫会导致苹果幼苗根系的长度、表面积及根尖数下降。李付伸等认为,干旱胁迫不仅会造成根尖数和根系长度的降低,还会造成根系直径的下降。水分调亏对小麦、烟草、豌豆等植物根系的形态特征也有显著的影响。笔者研究表明,干旱胁迫下,生姜幼苗的总根长、根系投影面积、根尖数均显著降低,喷施CTS处理则缓解了降低趋势。由此可见,喷施CTS 可有效促进干旱胁迫下生姜幼苗根系的生长,改变根系构型来适应干旱胁迫。
植物组织的总含水量、自由水含量及束缚水含量等水分特征对干旱胁迫非常敏感,可反映逆境条件下植物叶片水分状况。水分在植物细胞内通常以自由水和束缚水两种形式存在。一般情况下,当植物体内自由水含量较高时,植株代谢活动较强,对逆境的抵抗能力较弱。反之,当束缚水含量较高、自由水比例相对减少时,植株生长速率减缓,抗逆性增强。孙君艳等研究表明,干旱胁迫显著降低花生叶片的相对含水量,但喷施壳寡糖会显著减缓相对含水量的降低和干旱胁迫对植物的伤害。笔者研究表明,干旱胁迫下生姜幼苗的总含水量低于非胁迫条件,并且叶片的自由水在总含水量中的占比低于非胁迫下的占比,表明干旱胁迫下生姜幼苗代谢缓慢,生长速率低,而喷施CTS 缓解了这一现象,增加了自由水的占比,总含水量也呈上升趋势。表明喷施CTS 可提高干旱胁迫下生姜幼苗叶片水分含量,提高自由水和束缚水比值。
根系水导是植物吸水能力的重要水力学参数。忽雪琦等研究发现,干旱胁迫显著降低玉米幼苗根系水导,而外源施硅则能缓解干旱胁迫造成的根系水导降低。笔者研究表明,生姜幼苗在干旱胁迫下根系水导显著降低,而喷施CTS 则显著延缓降低的趋势。一般叶片水势可反映植物体内水分状况,反映植物水分调节能力。笔者研究表明,干旱胁迫下生姜幼苗叶片水势显著降低,而喷施CTS 则显著缓解降低的趋势,提高生姜叶片的水势和生姜对水分调节能力,这与杨明凤等对棉花的研究结果一致。表明喷施CTS 增强生姜体内水分代谢能力,维持胁迫下植物体内正常生理活动,缓解干旱胁迫。鉴于植物体内的水分平衡受到蒸腾失水和根系吸水的共同作用,因此笔者随后对植株的光合和蒸腾速率进行了研究。
叶绿素是植物进行光合作用的主要色素,参与植物对光能的吸收、传递和转化,其含量与光合能力呈正相关,是反映叶片生理活性变化的重要指标之一。类胡萝卜素可以把自身吸收的光能传递给叶绿素进行光化学反应,又可以在强光时对叶绿素分子、类囊体和叶绿体起到保护作用。陈娟研究表明,干旱胁迫显著降低生姜叶片的叶绿素含量,而喷施50 μmol·LABA 可以增加干旱胁迫下生姜叶片的叶绿素含量,缓解干旱胁迫造成的生姜光合效率的降低。笔者也获得了类似的结果,干旱胁迫下喷施壳聚糖可显著提高生姜幼苗的叶绿素及类胡罗卜素含量,有利于光合作用的正常进行。
光合作用是植物生长发育和产量形成的基础,对水分较为敏感,通常植物在遭受干旱胁迫时,光合效率会显著降低。王允研究表明,喷施外源物ABA 延缓了生姜叶片最大光化学效率(/)、光化学猝灭系数()、实际光量子效率()的降低,缓解了干旱胁迫对生姜叶片光合器官的损害。笔者研究发现干旱胁迫下,喷施CTS 可显著提高生姜幼苗叶片的、/、,降低其NPQ。表明在干旱胁迫下,喷施CTS 可促进光合电子传递和提高光化学速率,使叶片吸收的光能充分地用于光合作用,提高叶绿素荧光产额,增加PSII 的天线色素对光能的捕获量,一定程度上减轻干旱胁迫下对生姜叶片光合器官的伤害。植物遭受干旱胁迫时,会通过调节植物的气孔关闭,减缓蒸腾作用,减低水分散失,从而提高其抗旱性。笔者研究亦表明干旱胁迫下,生姜幼苗叶片和显著降低,但喷施CTS 较好地缓解了降低的趋势。表明干旱胁迫下喷施CTS 可能通过改善胁迫条件下植株的光合作用,一定程度上保证胁迫下生姜幼苗的正常生长。此外,由于同单独干旱胁迫相比,干旱下喷施CTS后植株并没有通过降低来提高植株的保水性,因此笔者推测可能还有其他机制在发挥作用。
除了根叶渗透调节、根系构型以外,植物在干旱下的水分吸收能力受到水通道蛋白(aquaporins,AQPs)活性的影响。AQPs 作为植物主要的水分通道,在植物根系的水分运输过程中发挥着重要作用。流经根中70%~90%的水分都是通过细胞膜上的AQPs 来传输的,AQPs 的数量和活性在一定程度上决定了水分传导率。大量研究发现,水通道蛋白基因上调表达有利于植物的抗旱、抗盐。Li 等研究发现番茄在遭受环境胁迫时,;,;和;基因表达量上调以促进根系水分吸收,提高植株水分含量并维持渗透平衡。在高粱中,Liu 等研究报道,外源硅通过显著上调根系的表达,缓解渗透胁迫对植株的伤害。在大多数植物中,和分别是植物细胞质膜和液泡膜中最丰富的水通道蛋白,根部的水分吸收和跨细胞的水分流动主要由和介导。因此,笔者选取了生姜中3 个、1 个和1 个基因,对其表达水平进行了研究。结果表明,在干旱胁迫下,第5 天时生姜根系、、、基因的表达显著上调。同单独干旱相比,干旱胁迫下施加CTS 可以显著上调3 个基因的表达。虽然和的表达水平低于单独干旱胁迫,但是仍高于对照,这与前人研究结果类似。前人研究表明,野生毛葡萄短时间干旱胁迫下;的表达量呈迅速上调趋势,可以促进根系通过共质体途径吸收周围的水分;当根系周围的水势高于根系组织水势时,基因及基因的上调表达能够促进植株通过水通道蛋白介导的共质体途径吸收根系周围的水分,维持生长所需的水分稳态。本研究中,在干旱胁迫第25 天时,施加CTS 后生姜根系基因、、、的相对表达水平均显著高于干旱胁迫,这与之前短期干旱的结果类似,即干旱胁迫下喷施CTS 可以增强植物的吸水能力。因此笔者推测,干旱胁迫下,生姜幼苗通过调控基因的表达来促进干旱条件下根系水分的吸收,而喷施CTS 可以进一步促进根系基因的表达,从而更好地维持生姜幼苗体内的水分代谢。但不同的基因对生姜植株水分吸收和转运的贡献率仍需进一步明确,从而更好地解释逆境条件下生姜水分转运机制以及喷施CTS 提高干旱胁迫下生姜水分状况的分子机制。
综上所述,喷施10 mg·L外源壳聚糖可提高生姜幼苗在干旱胁迫下对水分的吸收和利用率,显著提高生姜幼苗叶片在干旱胁迫下的光合效率,缓解干旱对植物生长的抑制。

