电针对抑郁症大鼠海马齿状回亚颗粒区小胶质细胞活化和学习记忆能力的影响
黄文韬李朵朵*李冰陈恒李武
(1.湖南中医药大学第二附属医院,长沙 410005;2.湖南中医药大学,长沙 410208)
抑郁症(depression)已经成为最普遍、最致残和最昂贵的神经精神疾病之一,影响着全球3亿多的患者[1]。其病理生理学发病机制涉及多个方面,慢性神经炎症已成为目前的研究热点,可通过作用于神经发生、血清素代谢、多巴胺能系统等影响抑郁症的发作以及严重程度[2]。现有的抗抑郁症的药物治疗作用仅能促使1/2的患者得到持续性缓解,约1/5的患者存在治疗无效的情况[3]。成年海马神经发生是大脑学习记忆、认知和情绪反应的关键过程,海马齿状回亚颗粒区(SGZ)是神经发生的主要部位,而SGZ中小胶质细胞是神经炎症反应的主要介质,参与神经发生和神经保护[4]。炎性小体NOD样受体3(NOD-like receptor 3,NLRP3)是一种胞质模式识别受体,常结构性表达于小胶质细胞中,可促发一系列免疫炎症反应,抑制神经发生[5]。大量报道证实,抑制NLRP3炎性小体及其信号通路的激活可发挥明显的抗抑郁作用,NLRP3已经成为抑郁症神经炎症发生的重要靶点[6-8]。电针作为中医学特色治疗方法,已经被证实在临床治疗抑郁症方面有较好的疗效,但是具体作用机制仍有待研究。因此,本研究以NLRP3阻断剂为对照,采用免疫荧光双标法观察小胶质细胞的活化状态,联合RT-PCR法探讨电针刺激对抑郁症大鼠SGZ中NLRP3/含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase1,Caspase-1)/白 细 胞 介 素-1β(interleukin-1,IL-1β)信号通路表达的影响,为临床电针治疗抑郁症提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
选取32只8周龄SPF级SD雄性大鼠,体重约180 ~ 220 g,由湖南斯莱克景达实验动物有限公司提供【SCXK(湘)2019-0004】。饲养环境:在恒定温度、湿度和光暗循环(20 ~ 25℃;55% ± 10%;7:00 ~ 19:00光照循环)下自由饮水和摄食,饲养于湖南省中医药研究院实验动物中心【SYXK(湘)2020-0008】。实验程序根据湖南省中医药研究院实验动物中心管理规定进行(IACU2021-0106)。
1.1.2 主要试剂和仪器
MCC950(批号:CP-456773,Selleckchem),HRP标记山羊抗大鼠(批号:GB23302,Servicebio),Anti-Iba-1(批号:ab178847,Abcam),Anti-NLRP3(批号:19771-1-AP,Proteintech),Caspase-1、IL-1β和GAPDH引物(上海生物工程有限公司)。SDZ-ⅡB型华佗牌电子针疗仪(苏州医疗用品厂有限公司,中国),动物行为学习记忆系统(Viewpoint,法国),Eclipse Ti-E型激光共聚焦显微镜(Nikon,日本);PANNORAMIC型全景切片扫描仪(3DHISTECH,匈牙利);D3024R台式高速冷冻离心机(DRAGONLAB,中国);T10+S5N型电动匀浆器(IKA,德国);实时荧光定量PCR仪(Thermo,美国)。
1.2 方法
1.2.1 动物分组与造模
将SD大鼠按旷场实验随机分为对照组、模型组、NLRP3阻断剂(MCC950)组、电针(EA)组,每组8只。除对照组,其余各组皆采用孤养联合慢性不可预知性温和应激(CUMS)复制大鼠抑郁模型。应激方法包括:昼夜颠倒12 h/12 h、4℃冰水浴5 min、禁食24 h、禁水24 h、夹尾1 min、潮湿垫料24 h、热板52℃ 5 min,各组大鼠每天采用同1种刺激方式,每种刺激方式使用3 ~ 4次,且同种刺激不连续出现。
1.2.2 干预治疗
在大鼠每天应激后1 h,给予NLRP3阻断剂MCC950和电针组干预治疗。MCC950组[9]:将MCC950粉末溶解在无菌生理盐水中,制成3 mg/kg的MCC950溶液,大鼠放置于固定装置中,用乙醇擦拭鼠尾,使用1 mL的注射器将MCC950溶液缓慢注射入侧尾静脉,给药体积为1 mL/kg。电针组:参考《实验针灸学》[10],选择“百会”和“印堂”穴,将SD大鼠固定在鼠板上,采用华佗牌针(0.25 × 13 mm)向后平刺4 ~ 6 mm,针柄处连接华佗牌SDZ-ⅡB型电子针疗仪,电流输出强度1 ~ 2 mA,疏密波型,刺激20 min,每日1次,连续21 d。对照组给予相同时长的固定。
1.2.3 旷场实验
分别于造模前和治疗结束后,进行旷场实验,将大鼠放入黑色敞箱(80 cm × 80 cm× 40 cm)角落,观察4 min,记录各组大鼠后3 min内水平运动格子数(四爪皆入记1次)和垂直竖立次数(两爪腾空放下记1次),以总运动量判断大鼠自主活动能力。
1.2.4 Morris水迷宫实验
在治疗结束后,第1 ~ 4天进行定位航行实验检测大鼠学习能力,每天将大鼠从4个不同象限面向池壁放入,观察60 s内大鼠爬上平台的逃避潜伏期(escape latency,EL)。第5天进行空间探索实验检测大鼠记忆能力,移除平台后大鼠从对立象限放入,记录90 s内大鼠在目标象限的空间探索时间(space exploration time,SET)。
1.2.5 样本采集
行为学检测结束后,各组中部分大鼠采用戊巴比妥(2 mg/kg)麻醉后,固定在解剖台上,剖开胸腔,从左心室插入灌注针并剪破右心耳,灌注生理盐水快速冲洗至液体澄清后,慢速灌注4%多聚甲醛溶液(4℃)直至四肢僵硬后,解剖出脑组织,放入4%多聚甲醛溶液固定,备用。各组剩余大鼠麻醉后,解剖出全脑后,分离海马组织齿状回亚颗粒区,放入液氮中速冻,待下一步检测。
1.2.6 免疫荧光双标检测
采用免疫荧光双标法检测海马齿状回亚颗粒区小胶质细胞NLRP3和Iba-1蛋白表达情况。取固定好的全脑组织,石蜡包埋,制备成8 μm切片,0.3% Triton X-100室温破膜,3% H2O2灭活内源性过氧化物酶,血清封闭,分别加入小胶质细胞表面标记物兔抗Iba-1(1∶500)和鼠抗NLRP3(1∶200),4℃过夜后,加入对应种属生物素二抗(1∶100),室温避光孵育1 h,封片,激光共聚焦显微镜观察并拍照,每张切片任选3个视野阳性的累积光密度值以及对应的组织像素面积,并计算出阳性表达率,取平均值作为测量值。
1.2.7 实时荧光定量PCR检测
采用RT-PCR法检测海马齿状回亚颗粒区Caspase-1和IL-1β mRNA表达,取上述冻存的海马组织,加入1 mL TRIzol,低温下匀浆,裂解5 min,提取样本总RNA,核酸蛋白测定仪定量。按照逆转录反应试剂盒说明书将RNA逆转录成cDNA,反应条件为2 × SYBR Mix 10 μL,ddH2O 8 μL,上下游引物(10 μmol/L)各1 μL,cDNA 1 μL。扩增条件为95℃预变性3 min,95℃ 10 s,60℃ 30 s,72℃ 2 min,40个循环。以GADPH为内参,反应结束后以2-ΔΔCt法计算分析目的基因Caspase-1和IL-1β相对表达水平,以基因/内参吸光度比值的平均值 ± 标准差(±s)表示。引物序列见表1。
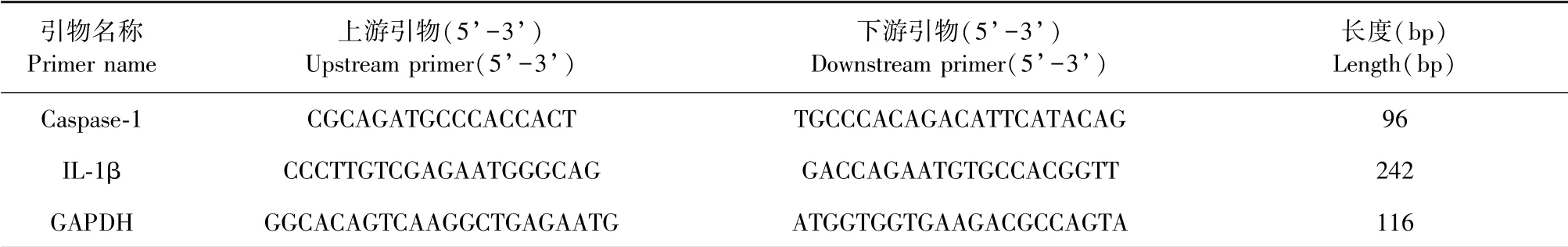
表1 Caspase-1和IL-1β引物序列Table 1 Caspase-1 and IL-1β primer sequences
1.3 统计学分析
采用统计软件SPSS 17.0进行统计分析,计量资料以平均值 ± 标准差(±s)表示,组间比较采用单因素方差(One-way ANOVA)分析,不服从正态分布采用非参数检验,P< 0.05为具有统计学意义。
2 结果
2.1 造模前后自主活动变化
旷场实验结果如图1所示,造模前各组间大鼠自主活动次数无明显差异(P> 0.05);给药后,与对照组比较,模型组大鼠活动量明显下降,电针刺激或药物干预后,大鼠的自主活动能力明显增加(P< 0.05,P< 0.01),具有显著性差异,表明电针可明显改善抑郁症大鼠的抑郁样行为。
2.2 学习记忆能力变化
Morris水迷宫实验检测结果如图2,3所示,给药结束后前4 d进行逃避潜伏期测试,第5天进行空间探索时间测试,与对照组比较,模型组大鼠逃避潜伏期明显增加,空间探索时间显著减少;与模型组比较,电针组和NLRP3阻断剂组大鼠的逃避潜伏期相对减少,空间探索时间有所增加(P< 0.05,P< 0.01),差异具有显著性;提示,电针应激可以加强抑郁大鼠的学习记忆能力。
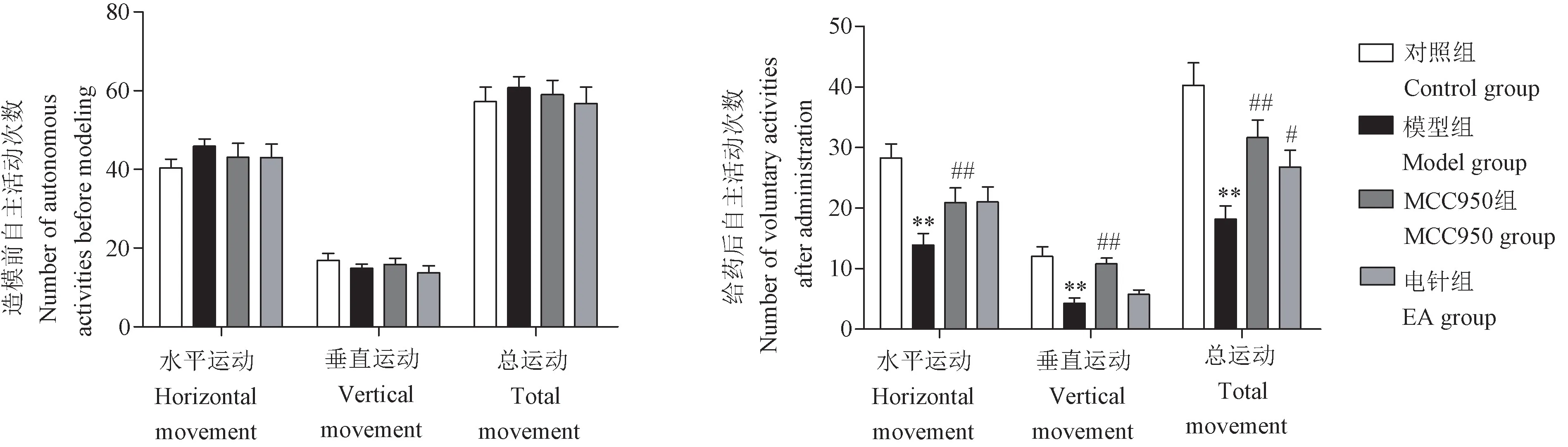
注:与对照组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。(下图同)图1 各组大鼠造模前和给药后自主活动变化Note.Compared with control group, **P < 0.01.Compared with model group, #P < 0.05, ##P < 0.01.(The same in the following figures)Figure 1 Changes in autonomous activities of each group of rats before modeling and after administration
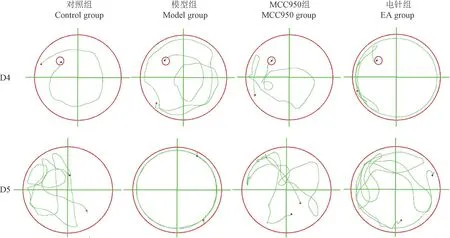
图2 各组大鼠第4天逃避潜伏期和第5天空间探索期运动轨迹图Figure 2 Movement trajectories of rats in each group during the 4th day escape latency and the 5th day space exploration period
2.3 海马齿状回亚颗粒区小胶质细胞NLRP3和Iba-1蛋白表达变化
免疫荧光双标法进行定位和定量检测结果如图4所示,激光共聚焦显微镜下观察发现,与对照组比较,模型组海马齿状回亚颗粒区小胶质细胞NLRP3和Iba-1蛋白荧光强度增强,阳性表达率明显增加,差异具有统计学意义(P< 0.01);与模型组比较,电针组大鼠海马齿状回亚颗粒区小胶质细胞NLRP3和Iba-1蛋白荧光强度减弱,阳性表达率减少,这与NLRP3阻断剂组干预趋势一致;提示,电针可明显减少抑郁症模型大鼠亚颗粒区小胶质细胞中炎性小体NLRP3蛋白的表达。
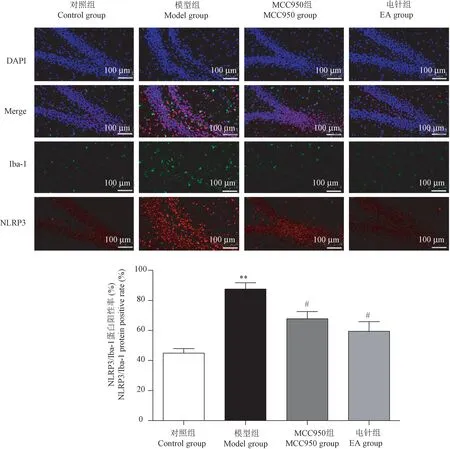
图4 海马齿状回亚颗粒区小胶质细胞NLRP3/Iba-1蛋白荧光和阳性表达率Figure 4 NLRP3/Iba-1 protein fluorescence and positive expression rate of microglia in the subgranular region of the hippocampal dentate gyrus
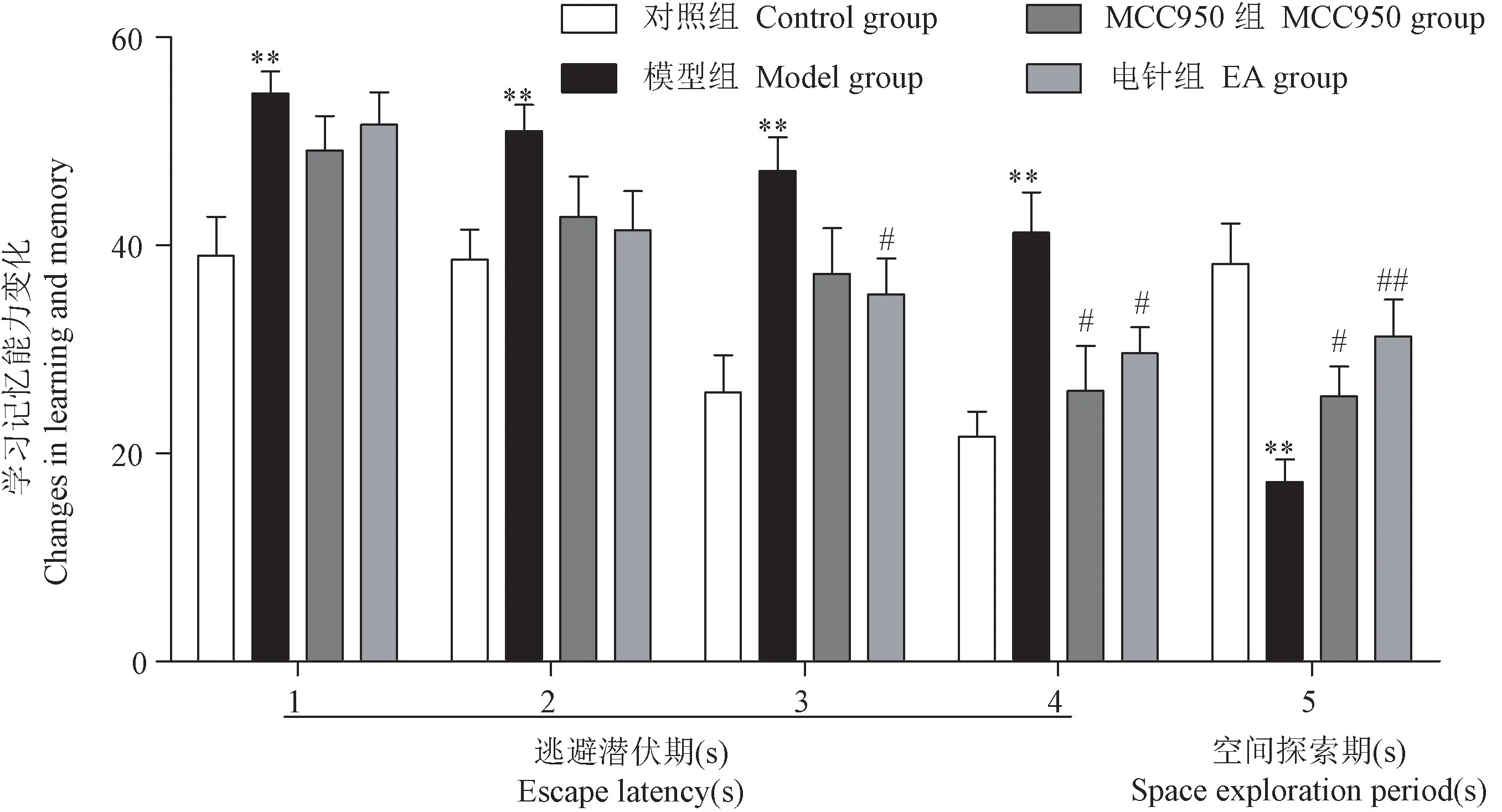
图3 各组大鼠学习记忆能力变化Figure 3 Changes in learning and memory ability of rats in each group
2.4 海马齿状回亚颗粒区Caspase-1和IL-1β mRNA变化
RT-PCR法定量检测结果如图5所示,与对照比较,模型组大鼠海马齿状回亚颗粒区Caspase-1和IL-1β mRNA相对表达量显著增加;与模型组比较,电针组和NLRP3阻断剂组大鼠海马齿状回亚颗粒区Caspase-1 mRNA相对表达量显著减少(P< 0.05,P< 0.01),电针组齿状回亚颗粒区IL-1βmRNA相对表达量有减少趋势,但无显著性差异。
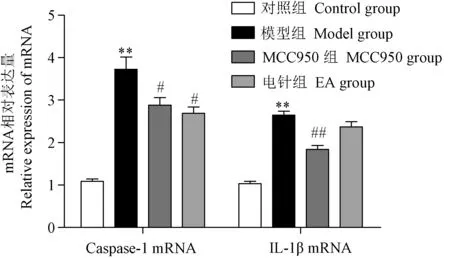
图5 海马齿状回亚颗粒区Caspase-1和IL-1β mRNA相对表达量Fi gure 5 Relative expression of Caspase-1 and IL-1β mRNA in the subgranular region of the hippocampal dentate gyrus
3 讨论
抑郁症主要因情志不达、脑神失养所致,归属于中医“郁证”的范畴,脑为元神之府,而督脉通脑络,针刺隶属督脉之中的“百会”,并配伍精神元气汇聚之处的“印堂”穴,二者作为临床治疗抑郁症的常用腧穴,可通过调节机体的神经内分泌、神经可塑性、免疫等多方面发挥抗抑郁作用[11]。免疫应激、炎症反应以及细胞因子活化所致的神经炎症发生是抑郁症发病的重要因素,其神经炎症的发生机制被认为可能是传统传统抗抑郁药治疗无效的原因之一,物理治疗如针灸可通过抑制神经炎症的产生来达到抗抑郁的作用[12-13]。本研究采用行为学评价系统检测证实,电针抑郁症大鼠的百会和印堂穴位可明显改善其抑郁样行为,以及学习记忆能力。
海马是抑郁症发病中的关键区域,海马齿状回亚颗粒区(SGZ)中的神经干细胞是神经元和胶质细胞产生的起源,与大脑正常生理条件下的认知过程如学习记忆等密切相关[14]。其中,小胶质细胞是中枢神经系统固有免疫细胞,被激活后可从静息的分支状变成激活的杆状,分泌炎症介质,诱导神经炎症发生,导致SGZ结构和功能完整性缺失[15]。文献报道,SGZ中小胶质细胞密度的增加和形态的改变与抑郁症的发生密切相关[16]。我们的研究同样发现,抑郁模型大鼠小胶质细胞的标志物离子钙结合衔接分子Iba-1明显增加。NOD样受体蛋白3(NLRP3),是大脑中先天免疫的传感器,慢性应激状态下,小胶质细胞上NLRP3与半胱天冬酶募集结构域(ASC)和前半胱天冬酶-1(pro-Caspase-1)分子组成NLRP3炎性小体并被激活,引起认知功能和神经病理学变化[17]。NLRP3炎性小体被激活后可介导自身催化裂解,释放大量活化的半胱天冬酶-1(Caspase-1),Caspase-1是白细胞介素-1β(IL-1β)的转化酶,可特异性的将前体IL-1β(pro-IL-1β)裂解为成熟活化的IL-1β,通过不完整的细胞膜外释,引起相邻神经细胞炎症[18]。大鼠脑室注射IL-1β会显著降低海马齿状回细胞增殖数量,IL-1β受体抑制剂可有效逆转这种作用[19]。
有研究发现,抑郁症海马中存在明显的炎性小体NLRP3激活现象,已经成为重要的潜在抗抑郁治疗靶点[6-7]。小分子化合物MCC950是一种有效的选择性NLRP3抑制剂,可以特异性抑制NLRP3诱导的ASC寡聚,从而防止IL-1β裂解为其活性形式[9]。在我们的研究中,通过免疫荧光双标法,给予抑郁症大鼠MCC950后,可明显减少小胶质细胞的活化,而且NLRP3蛋白表达明显降低。同时,海马SGZ中Caspase-1基因表达明显减少。电针组表现出相同的趋势,因此,我们推测,电针改善大鼠抑郁样行为和学习记忆能力,可能是通过调控海马齿状回亚颗粒区小胶质细胞活化,和影响炎症信号通路NLRP3/Caspase-1表达有关。电针作为一种绿色疗法已经在临床抗抑郁的治疗效果中被肯定,本研究为其提供一定的更加科学和深入的理论支撑。

