牛血红蛋白β亚基片段衍生抗菌肽的分子设计及其抗菌活性分析
邓 丽,李 杰,刘保国,杭柏林,3
(1.河南科技学院动物科技学院,新乡 453003;2.新乡市农业农村局畜产品质量监测检验中心,新乡 453003;3.扬州大学兽医学院,教育部禽类预防医学重点实验室,江苏省动物预防医学重点实验室,扬州 225009)
抗生素是一把“双刃剑”,在对人类健康和动物养殖行业作出巨大贡献的同时也诱导细菌产生耐药性,增加治疗难度,同时其固有的副作用亦危害人与动物的健康[1]。动物养殖行业中抗生素的使用量巨大,且兽用抗生素的不合理使用较为常见,极易导致病原菌耐药。而耐药性可通过食物链直接或间接地传递给人类[2-3],从而威胁人类健康。规范动物养殖过程中抗生素的合理使用是解决耐药性传播的一种重要措施。因此,世界各国逐渐采取不同措施遏制细菌耐药。其中一个重要措施就是禁止在饲料中添加任何抗生素[4-5]。为保障动物高效健康养殖,可使用抗生素替代物[6]。抗生素替代物有很多种类,其中抗菌肽被认为是抗生素的最佳替代物。
抗菌肽(antimicrobial peptides,AMPs)是生物机体先天免疫系统的重要组成部分,具有广谱抗“菌”(包括细菌、真菌、病毒、寄生虫)、免疫调节、抗肿瘤等多种生物学活性[7]。天然抗菌肽存在生物活性低、毒性大、稳定性差、不易获得、应用成本高等缺陷,限制了其转化应用[8-10]。随着生物技术的发展,分子设计和优化策略为开发新型抗菌肽提供了理论基础[10]。血红蛋白降解后的某些片段具有抗菌活性,被称之为血红蛋白源杀菌肽(hemocidins)[11]。来自牛血红蛋白的杀菌肽已有许多,但多是通过酶解后分离鉴定或直接从体内或血液中分离鉴定的,还没有以其氨基酸序列为基础直接进行分析得到的抗菌肽。两亲性α-螺旋结构被认为是阳离子型抗菌肽发挥抗菌作用的重要基础。本研究根据抗菌肽的这一结构-功能理论,从牛血红蛋白β亚基中初步筛选了一个可能为血红蛋白源杀菌肽的新片段,并以其为基础,采用氨基酸替换方法设计了3条新多肽,测定其抗菌活性,评价其稳定性和溶血性,以期为研究和开发新型抗菌肽提供参考。
1 材料与方法
1.1 材料
1.1.1 设计多肽的人工合成 本研究设计的多肽均由18个氨基酸残基构成,由无锡亚肽生物科技有限公司合成,通过高效液相色谱进行纯化,纯度高于95%。
1.1.2 测试菌株 奇异变形杆菌临床株[12]和大肠杆菌临床株[13]均从临床病猪肠道中分离并鉴定;鸡白痢沙门菌CVCC1791和大肠杆菌AE1均由林州市中农颖泰生物肽有限公司惠赠;大肠杆菌CVCC1568、猪霍乱沙门菌CVCC3776、鸡白痢沙门菌CVCC533、绿脓假单胞菌CVCC2087和金黄色葡萄球菌CVCC6538均购自中国兽医微生物菌种保藏管理中心;大肠杆菌CMCC44103购自中国医学细菌保藏管理中心;大肠杆菌CVCC8099、金黄色葡萄球菌ATCC 25923、白色念珠菌ATCC 10231均由河南科技学院动物检疫实验室惠赠。
1.1.3 主要试剂及仪器 胰酪大豆胨液体(TSB)培养基购自青岛海博生物技术有限公司;硫酸铜和氯化钙均购自天津市致远化学试剂有限公司;磷酸盐缓冲液(PBS,pH 7.2)购自北京索莱宝生物科技有限公司;浓盐酸、氢氧化钠、三氯化铁、氯化钠、氯化钾、氯化镁均购自国药集团化学试剂有限公司。
pH计(型号:PHS-3C)购自上海仪电科学仪器股份有限公司;酶标分析仪(型号:INFINITEPRO)购自Tecan公司;恒温培养箱(型号:GNP-9270)购自上海精宏实验设备有限公司;高压蒸汽灭菌器(型号:LDZX-30KAS)购自上海申安医疗器械厂;纯水仪(型号:ZYTEST-I-10T/20T)购自四川卓越水处理设备有限公司。
1.2 方法
1.2.1 多肽的设计及其生物信息学分析 将牛血红蛋白β亚基的氨基酸序列输入HeliQuest在线工具(https:∥heliquest.ipmc.cnrs.fr/),运行后得到许多18个氨基酸残基构成的多肽及其螺旋轮、带电荷数、总疏水率和疏水力矩等相关信息,根据“两亲性、带正电荷和α-螺旋”的特征进行多肽筛选;利用APD3数据库(https:∥aps.unmc.edu/)对设计多肽与库内收集的抗菌肽进行相似性分析;利用ProtParam在线工具(https:∥web.expasy.org/protparam/)分析多肽的理化性质;利用SOPMA在线工具(http:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析多肽二级结构;利用PEP-FOLD3在线工具(https:∥mobyle.rpbs.univ-paris-diderot.fr/cgi-bin/portal.py#forms::PEP-FOLD3)对多肽进行3D作图;利用HeliQuest在线工具绘制改造多肽的螺旋轮模型,计算其疏水力矩。
1.2.2 抑菌活性分析 通过测定最小抑菌浓度(minimum inhibitory concentrations,MIC)来反映多肽的抑菌活性。当MIC≤400 μg/mL时,认为多肽有抑菌活性。将不同菌株用TSB培养基于37 ℃过夜培养,转接种后继续培养3~5 h,10 000 r/min离心5 min,用灭菌PBS(pH 7.2)洗涤3次,用TBS培养基将细菌浓度调整至2×106CFU/mL,取菌液加入96孔板中,100 μL/孔。同时用TSB培养基倍比稀释设计多肽,取不同稀释度的多肽加入96孔板的对应孔中,100 μL/孔。混匀后,置于37 ℃培养箱中培养24 h。以没有菌体生长的最高稀释度的多肽浓度为抑制该菌生长的MIC。肉眼观察孔中溶液,如浑浊,则有菌体生长;如澄清,则没有菌体生长。
1.2.3 稳定性分析 在TSB培养基中加入琼脂糖,使其浓度为2%,灭菌,冷却至50 ℃左右时,加入按1.2.2中配制的大肠杆菌CVCC8099菌液,使菌液终浓度为1×106CFU/mL,混匀,立即倒平板,凝固,打孔,封底,备用。将筛选出的有抑菌活性的抗菌肽进行不同处理,加入平板的相应孔中,20 μL/孔,静置3 h,置于37 ℃培养箱中培养24 h,取出,用直尺测量抑菌圈直径。
1.2.3.1 热稳定性分析 将抗菌肽溶液分别置于0、20、40、60、80和100 ℃处理15 min,测定抗菌肽的抗菌活性。
1.2.3.2 盐离子稳定性分析 将抗菌肽置于不同盐离子溶液(1×PBS、150 mmol/L NaCl、5 mmol/L KCl、1 mmol/L MgCl2、5 mmol/L CaCl2、4 μmol/L FeCl3、25 μmol/L CuSO4)中处理15 min,然后测定抗菌肽的抗菌活性。
1.2.3.3 酸碱稳定性分析 将抗菌肽溶液置于pH 4.0、5.0、6.0、7.0、8.0、9.0和10.0的TSB培养基中处理15 min,测定抗菌肽的抗菌活性。
1.2.3.4 反复冻融稳定性分析 将抗菌肽溶液反复冻融4、6、8、10、12、14次,测定抗菌肽的抗菌活性。
1.2.4 溶血性分析 无菌采集健康大耳白母兔(3月龄左右,约1.5 kg,购自新乡市洪门镇菜市场)血液,用3.8%柠檬酸钠溶液抗凝,3 000 r/min离心10 min,沉淀用灭菌PBS缓冲液(pH 7.2)洗涤3次,配制成1%兔红细胞悬液,加入灭菌离心管中,100 μL/管。将抗菌肽用灭菌PBS(pH 7.2)进行倍比稀释,不同浓度的抗菌肽溶液加入相应离心管中,100 μL/管。将离心管置于37 ℃作用1 h,3 000 r/min离心5 min,取上层液体加入相应的96孔板中,用酶标分析仪于波长540 nm处测定各孔溶液的吸光度值(D540 nm值)。用1% Triton X-100作为阳性对照,用PBS缓冲液作为阴性对照。
溶血率(%)=(D540 nm肽-D540 nm阴性对照)/(D540 nm阳性对照-D540 nm阴性对照)×100%
2 结 果
2.1 多肽的一级结构
在牛血红蛋白β亚基中筛选了1条多肽,然后采用氨基酸替换方法新设计了3条多肽。设计多肽的氨基酸序列见表1。其中YKK-18是牛血红蛋白β亚基中第64-81位氨基酸残基构成的多肽,有18个氨基酸残基,而DLK-3、LJ-1和LJ-2是替换了YKK-18序列中部分氨基酸后得到的多肽,分别替换了8、7和15个氨基酸。

表1 设计多肽的一级结构
2.2 多肽的相似性分析
将设计的4条多肽与APD3数据库中收集的抗菌肽进行氨基酸序列相似性比对,记录最高的相似性,结果见表2。由表2可知,4条多肽与APD3数据库中已收录抗菌肽的氨基酸序列相似性均不超过50%。表明设计的4条多肽均是新的多肽。

表2 设计多肽与APD3数据库中抗菌肽的相似性比对
2.3 多肽的理化特性
通过在线工具对设计的4条多肽进行理化特性分析,结果见表3。由表3可知,4条多肽的等电点均>7;4条多肽均带正电荷,其中YKK-18所带电荷数较少,DLK-3所带电荷数较多,而LJ-1和LJ-2所带电荷数中等;总平均亲水性(GRAVY)值均<0,表明4条多肽均为亲水性多肽,推测溶于水;YKK-18为稳定的多肽,其他3条多肽为不稳定多肽;LJ-2的热稳定性最高,其次是DLK-3和LJ-1,YKK-18较差;YKK-18的总疏水率和疏水力矩均低于其他3条多肽,DLK-3、LJ-1和LJ-2的疏水力矩值依次降低,表明DLK-3、LJ-1和LJ-2的两亲性程度逐渐降低。

表3 设计多肽的理化性质
2.4 设计多肽的二级结构、3D模型及螺旋轮结构
在线工具分析设计多肽的二级结构预测结果见表4。由表4可知,YKK-18有2种二级结构类型,即α-螺旋和β-转角,且螺旋度较高;而改后的3条多肽(DLK-3、LJ-1和LJ-2)只有1种二级结构类型,即α-螺旋。

表4 设计多肽的二级结构预测结果
对设计多肽进行3D模型模拟,结果见图1。由图1可知,YKK-18为全α-螺旋结构,而DLK-3、LJ-1的中间为α-螺旋结构,DLK-3的氮端和LJ-1的羧基端为延伸链结构,LJ-2的两端为α-螺旋结构,中间有个无规则卷曲结构,这与二级结构预测结果有差异。但3D模型均表明4条多肽中均存在高含量的α-螺旋结构。
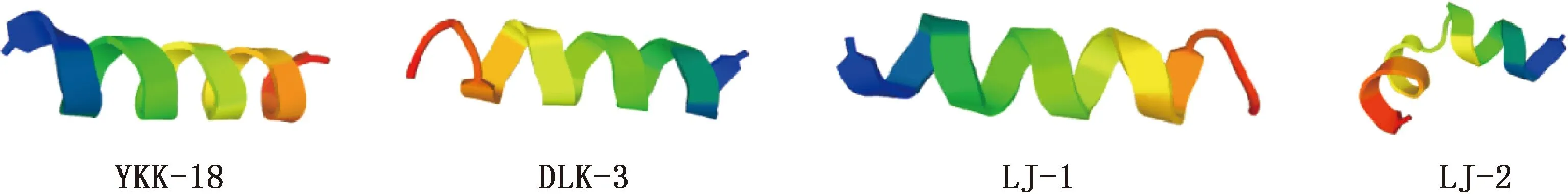
图1 设计多肽的3D模型
设计多肽的螺旋轮模型见图2。由图2可知,4条设计多肽均呈两亲性结构,其中,DLK-3的两亲性最好,其次依次为LJ-1和LJ-2,而YKK-18的两亲性较差。

①黄色,非极性疏水性氨基酸残基;蓝色,极性带正电荷氨基酸残基;淡红色,极性不带电荷中性酰胺类氨基酸残基;紫色,极性不带电荷中性含羟基类氨基酸残基;灰色,极性不带电荷疏水性氨基酸残基;淡蓝色,极性不带电荷碱性氨基酸;红色,极性带负电荷酸性氨基酸。②数字表示氨基酸残基的位置;箭头长短表示疏水力矩大小,疏水力矩指示多肽的两亲性程度
2.5 多肽的抑菌活性
通过倍比稀释法测定了4条设计多肽对不同菌株的MIC以反映设计多肽的抑菌活性,结果见表5。由表5可知,YKK-18对测试的13种菌株均没有抑菌活性,但DLK-3、LJ-1和LJ-2对这13种测试菌株中的12种(除了奇异变形杆菌)均具有抑菌活性,其中DLK-3的抑菌活性比LJ-1和LJ-2强,LJ-1和LJ-2对革兰阴性菌的抑菌活性强于对革兰阳性菌的抑菌活性,总体上LJ-2的抑菌活性低于DLK-3和LJ-1。表明设计的3条多肽DLK-18、LJ-1和LJ-2是具有不同抑菌活性的抗菌肽。

表5 设计多肽对部分菌株的最小抑菌浓度
2.6 抗菌肽的抑菌稳定性
2.6.1 抗菌肽热稳定性分析 由图3可知,随着温度的升高,抗菌肽DLK-3、LJ-1和LJ-2的抑菌活性逐渐降低,但仍有较高的抑菌活性,表明这3条多肽的抑菌活性具有热稳定性。

图3 温度对设计抗菌肽抑菌活性的影响
2.6.2 抗菌肽盐离子稳定性 由图4可知,在7种不同的盐溶液(生理性浓度)中,3条抗菌肽仍有抑菌活性,表明3条抗菌肽的抑菌活性具有盐离子稳定性。

1,pH 7.2 PBS;2,150 mmol/L NaCl,3,5 mmol/L KCl;4,1 mmol/L MgCl2;5,5 mmol/L CaCl2;6,4 μmol/L FeCl3;7,25 μmol/L CuSO4
2.6.3 抗菌肽酸碱稳定性 由图5可知,在pH 4.0~6.0或pH 8.0~10.0时,3条抗菌肽的抑菌活性比pH 7.0时有所降低,但抑菌活性仍较高,表明3条抗菌肽的抑菌活性具有酸碱稳定性。

图5 pH对设计抗菌肽抑菌活性的影响
2.6.4 抗菌肽反复冻融稳定性 由图6可知,随着冻融次数的增加,3条抗菌肽的抑菌活性逐渐降低,但仍有较高抑菌活性,表明3条抗菌肽的抑菌活性具有反复冻融的稳定性。

图6 反复冻融对设计抗菌肽抑菌活性的影响
2.7 抗菌肽的溶血性
由图7可知,抗菌肽DLK-3在25 μg/mL时的溶血率已超过5%,而抗菌肽LJ-1和LJ-2在200 μg/mL的高浓度时溶血率仍低于5%,表明抗菌肽DLK-3有较高的溶血性,而抗菌肽LJ-1和LJ-2有较低的溶血性。

图7 设计抗菌肽的溶血性
3 讨 论
抗菌肽作为抗生素替代物被广泛开发和应用,但其也存在一些缺点[14]。因此,对天然抗菌肽进行改造或分子设计以获得性能更佳的抗菌肽成为研究热点。抗菌肽分子设计中常以天然抗菌肽序列为模板进行氨基酸替换及肽段截短、拼接或杂合[14-15]。本研究以动物天然蛋白序列为基础,根据抗菌肽的构效关系筛选潜在抗菌肽序列,并以此为基础,通过氨基酸替换,设计新的多肽序列并验证其抗菌活性,最终获得2条性能较佳的抗菌肽。
生物机体蛋白的一级结构是由氨基酸残基经排列组合后形成的长短不一的多肽,其中某些肽段含有抗菌肽构成的3个要素,即α-螺旋、带正电荷和两亲性结构。本研究从牛血红蛋白β亚基中初筛潜在抗菌肽时即以上述3个要素为依据,同时为方便应用,以亲水性为参考,筛选了1条多肽YKK-18。本研究设计的多肽的二级结构预测结果与3D模型预测结果有差异,可能与不同在线工具的算法有关。多肽成为抗菌肽的首要条件是有抗菌活性,而多肽YKK-18没有抗菌活性。为此,以YKK-18的氨基酸序列为基础,通过氨基酸替换,改变多项性能参数(如增加正电荷数,提高两亲性程度、螺旋含量、疏水率等),重新设计了3条多肽,经验证,3条多肽对不同测试菌株有不同程度的抗菌活性。
抗菌肽抗菌活性受自身电荷数、疏水性、两亲性、二级结构的影响[10]。目前,虽然存在不带电荷或带负电荷的抗菌肽,但绝大多数抗菌肽均带有不同数量的正电荷[16]。两亲性对抗菌肽破坏细菌细胞膜非常重要[17],是设计抗菌肽时亦要考虑的因素。两亲性程度高的抗菌肽具有较好的抗菌活性。绝大多数抗菌肽具有螺旋结构,且抗菌谱广[18-19]。增加多肽的疏水性亦能提高抗菌肽的抗菌活性[20]。本研究设计的3条新多肽所带正电荷数、两亲性程度、螺旋含量、疏水率等均高于模板肽,是新设计多肽具有抗菌活性的重要基础。增加多肽的电荷数是提高抗菌肽抗菌活性的重要手段[18]。本研究中多肽LJ-1和LJ-2均带5个正电荷,多肽DLK-3带8个正电荷,这亦可能是多肽DLK-3的总体抗菌活性优于多肽LJ-1和LJ-2的原因。
溶血性是影响抗菌肽应用的一个重要因素[21]。一般认为,影响抗菌肽溶血性的因素主要包括带正电荷数目、疏水性、两亲性程度、二级结构等。其中,数量较多的正电荷会提高抗菌肽的溶血性[22]。因此,在抗菌肽设计过程中,在保证较好抗菌活性的基础上,降低多肽的正电荷数,改变多肽的其他理化特征,可降低溶血率[21]。本研究结果显示,多肽DLK-3带较多的正电荷,其溶血率也较高,而多肽LJ-1和LJ-2所带正电荷数少于DLK-3,溶血率也低。以多肽DLK-3为模板,可继续进行新抗菌肽的分子设计,以期获得性能更佳的抗菌肽。
抗菌肽应用于生物机体时受多种因素作用,进而影响使用效果。影响抗菌肽使用效果的理化因素主要包括温度、酸碱环境、盐离子等[14]。因此,测定抗菌肽在这些理化因素作用下的稳定性可评价抗菌肽的应用潜力。热稳定性是影响抗菌肽保存和使用的重要因素。某些抗菌肽抗菌活性在受热和反复冻融后会下降,如丝光绿蝇抗菌肽[23]、海南沼洼皮肤抗菌肽[24]、BSN-37[25]等,但仍保留有抗菌活性。经分析,抗菌肽DLK-3、LJ-1和LJ-2经高温(100 ℃)处理及反复冻融14次后抗菌活性虽仍较高但也有所下降。这提示,在使用抗菌肽DLK-3、LJ-1和LJ-2时应低温保存,同时要避免多次反复冻融。pH和盐离子是抗菌肽在生物体内应用时的重要影响因素[26]。在生物体生理性pH与盐离子条件下有较好的抗菌活性,是抗菌肽开发应用的前提。本研究结果显示,抗菌肽DLK-3、LJ-1和LJ-2在生理性pH与盐离子条件下仍能保留有较高的抗菌活性,值得继续深入开发。
4 结 论
本研究从牛血红蛋白β亚基筛选的1条多肽没有抗菌活性,但以其序列为模板设计的3条新肽(DLK-3、LJ-1和LJ-2)对革兰阳性菌(金黄色葡萄球菌)、革兰阴性菌(大肠杆菌、沙门菌、铜绿假单胞菌)和真菌(白色念珠菌)均有抗菌活性,抗菌肽DLK-3、LJ-1和LJ-2为亲水性的阳离子型α-螺旋多肽,具有较好的热稳定性、酸碱稳定性、盐离子稳定性、反复冻融稳定性,抗菌肽DLK-3的溶血性较高,而抗菌肽LJ-1和LJ-2的溶血性极低。抗菌肽LJ-1和LJ-2具有作为抗生素替代物的极高潜力,值得进行深入研究。

