定量磁化率成像评估高原人脑氧代谢的可行性
张永海,杨 林,黄尚勇,张晓敏,张 勇,大旺堆,孟庆宁,史 纲
(1.青海省第五人民医院放射科,青海 西宁 810000;2.青海省人民医院放射科,青海 西宁 810000;3.青海大学研究生院,青海 西宁 810000;4.福建医科大学附属第二医院放射科,福建 泉州 362000;5.兴宁市人民医院超声科,广东 梅州 514500;6.郑州大学第一附属医院放射科,河南 郑州 450000;7.拉萨市人民医院放射科,西藏 拉萨 850000)
与平原相比,高原地区海拔高、气压低而氧含量少。高原医学研究以低压缺氧环境中人体生理适应和损伤机制为主要内容,缺氧是贯穿主线的重要因素。大脑是人体最依赖氧的器官,脑氧代谢率(cerebral metabolic rate of oxygen, CMRO2)是反映脑组织氧摄取和消耗的最直接指标,研究高原人群脑氧代谢对于探索大脑缺氧适应机制具有重要意义。现有测定脑氧代谢方法包括近红外线光谱仪(near infrared spectrum instrument, NIRS)、PET/CT、MRI及直接颈静脉球部采血检测氧饱和度等。利用近红外光在人脑组织的传导和吸收,NIRS可无创、实时监测大脑局部氧饱和度和血流动力学变化,但准确率有限。15O PET/CT为测量脑氧代谢的“金标准”,但15O放射性核素半衰期短,不易制备。MR脑氧代谢技术可利用氧合血红蛋白(逆磁性)与脱氧血红蛋白(顺磁性)间磁化率的差异,无创评估脱氧血红蛋白含量及定量静脉血氧饱和度(venous oxygen saturation, SvO2)。氧摄取分数(oxygen extraction fraction, OEF)是反映氧摄取的主要指标[1]。MRI测量OEF的主要技术包括T2弛豫自旋标记技术、以R'加权数据的定量血氧水平依赖技术及定量磁化率成像(quantitative susceptibility mapping, QSM),其中QSM定量的OEF与PET结果具有良好的一致性[2],但OEF理论计算公式是基于平原人群的平均血红蛋白(hemoglobin, Hb)及动脉血氧饱和度(arterial oxygen saturation, SaO2)而拟定。本研究基于高原志愿者个体生理参数校正计算偏差,观察QSM测量高原人脑氧代谢的可行性。
1 资料与方法
1.1 研究对象 2019年3月—2020年10月于西藏自治区拉萨市(高原组,海拔3 650 m)及郑州市(平原组,海拔110 m)各招募健康志愿者34名,年龄21~50岁;高原组男18名、女16名,中位年龄32.0(42.8,28.0)岁;平原组男17名、女17名,中位年龄38.5(46.3,30.8)岁,其年龄及性别分布见表1。纳入标准:①年龄21~50岁;②汉族;③高原组均移居当地5年以上;④体质量指数(body mass index, BMI)18.50~24.90 kg/m2;⑤无器质性病变及血管疾病;⑥检查前24 h内无饮酒及咖啡、吸烟或剧烈运动。排除标准:①贫血;②高原红细胞增多症;③呼吸系统疾病;④心血管疾病;⑤颅脑外伤史;⑥MR检查禁忌证。本研究经院伦理委员会批准,所有志愿者均签署知情同意书。
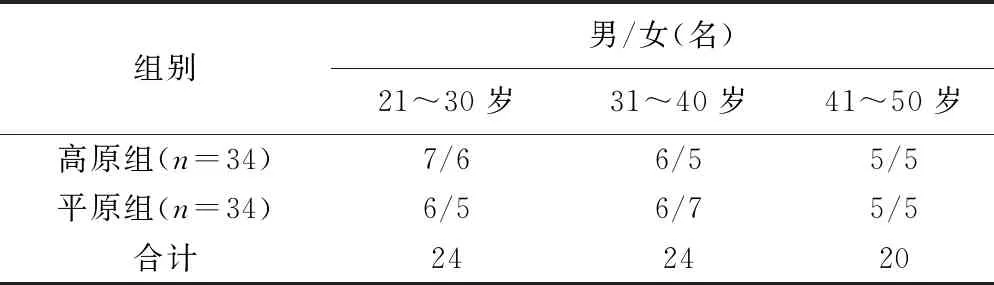
表1 高原地区及平原地区受试者性别及年龄分布
1.2 仪器与方法
1.2.1 临床指标 检查前1 h经肘静脉采血,以Beckman Coulter UniCel DxH 800血液分析仪测量Hb及红细胞计数(red blood cell count, RBC)检查前半小时采用Gladstone YK-83C指夹式脉搏血氧仪测量SaO2。
1.2.2 MR检查 采用GE Discovery MR750W Silent 3.0T MR扫描仪(32通道头部线圈),由工程师统一安装扫描序列并进行系统校正。嘱受试者双耳塞棉球,仰卧、闭目、保持清醒,尽量抬高下颌,固定头部线圈,行全脑扫描,使轴位定位线平行于胼胝体;参数:T1-3D序列,TR 8.5 s,TE 3.2 s,FOV 256 mm×256 mm,层厚1.0 mm,FA 12°,矩阵256×256,NEX 1;3D-动脉自旋标记(arterial spin labeling, ASL)序列,TR 4 854 s,TE 10.7 s,FOV 240 mm×240 mm,层厚4.0 mm,FA 12°,矩阵512×512,NEX 3,标记后延迟(posted labeling delay, PLD)2 s;QSM,TR 28.1 s,TE 1.9 s,FOV 240 mm×240 mm,层厚1 mm;层数140层,FA 20°,矩阵320×320,带宽62.5 Hz。
1.3 数据处理 采用STI-Suite Toolbox,经过初始处理相位图、去除背景场及磁化率反演而生成QSM图。以Laplacian法进行相位展开,以V-SHARP法去除相位的谐波伪影,以迭代最小二乘法最终重建QSM图。
1.3.1 OEF 参照文献[3]方法于QSM图像中生成OEF图,以局部阈值法创建静脉掩模,感兴趣容积(volume of interest, VOI)包括32×32×24个体素。因脱氧Hb升高致静脉易感性高于脑实质,以均值+2标准差(SD)的局部阈值对VOI中的静脉体素进行分割,计算每个VOI中静脉与周围组织的平均磁敏度之间的磁敏度差异(Δχ)。OEF估计值计算方式见公式(1)。
(1)
式中,Δχdo为完全脱氧血液与完全氧合血液之间每单位血细胞比容(hematocrit, HT)的敏感性差异[4],HT假设为0.45;Ya为SaO2。pv为以部分体积(partial volume, pv)效应校正的系数,约为6.0[5]。经上述每个VOI计算而来的血管OEF代表VOI的平均OEF。通在X和Y方向以13.7 mm的增量滑动VOI,将上述VOI用于全部图像,逐层生成OEF图。
1.3.2 脑血流量(cerebral blood flow, CBF) CBF计算公式[6]见公式(2)。
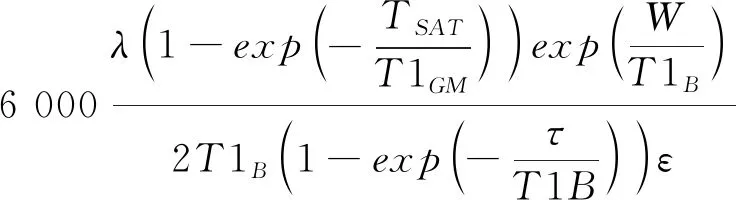
(2)
式中,标记后延迟W为2 s,τ为1.5 s,分配系数λ为0.9,标记效率ε为0.8×0.75,T1B为3.0T下估计的动脉驰豫为1.6 s,质子密度加权图像饱和恢复时间TSAT为2 s、饱和恢复校正时间T1GM为1.2 s,NEX 2;ASLdiff为ASL差分图像,PDref为质子密度加权参考图像。
1.3.3 CMRO2将Hb和SaO2结果录入后处理软件,计算动脉血氧含量(oxygen content in arterial blood, CaO2):CaO2=(Hb×SaO2×1.34)/(1-1.5%)。以SPM8软件对OEF和CBF图像数据进行预处理[7],采用仿生变换和非线性扭曲对蒙特利尔神经研究所(Montreal Neurological Institute, MNI)空间进行归一化处理,分辨率为3 mm×3 mm×3 mm。计算每个体素的CMRO2及全脑灰质和白质的平均CMRO2:CMRO2=OEF×CBF×CaO2,并生成CMRO2图;以各向同性高斯核对所有方向的图像进行平滑处理,半高全宽为6 mm。
1.4 统计学分析 采用SPSS 26.0统计分析软件。以±s表示符合正态分布的计量资料,组间比较采用t检验;采用中位数(上下四分位数)表示不符合正态分布的计量资料,组间比较采用非参数检验;以χ2检验比较组间性别差异。P<0.05为差异有统计学意义。
2 结果
2组受试者性别(χ2=1.515,P=0.218)及年龄(Z=-1.522,P=0.121)差异均无统计学意义。
2.1 临床指标 高原组Hb及RBC均大于平原组(P均<0.05)而SaO2小于平原组(P<0.05);组间CaO2差异无统计学意义(P>0.05),见表2。

表2 高原地区及平原地区受试者临床指标比较
2.2 脑氧代谢指标 高原组脑白质及脑灰质OEF高于平原组(P均<0.05);组间CBF及CMRO2差异均无统计学意义(P均>0.05),见图1及表3。
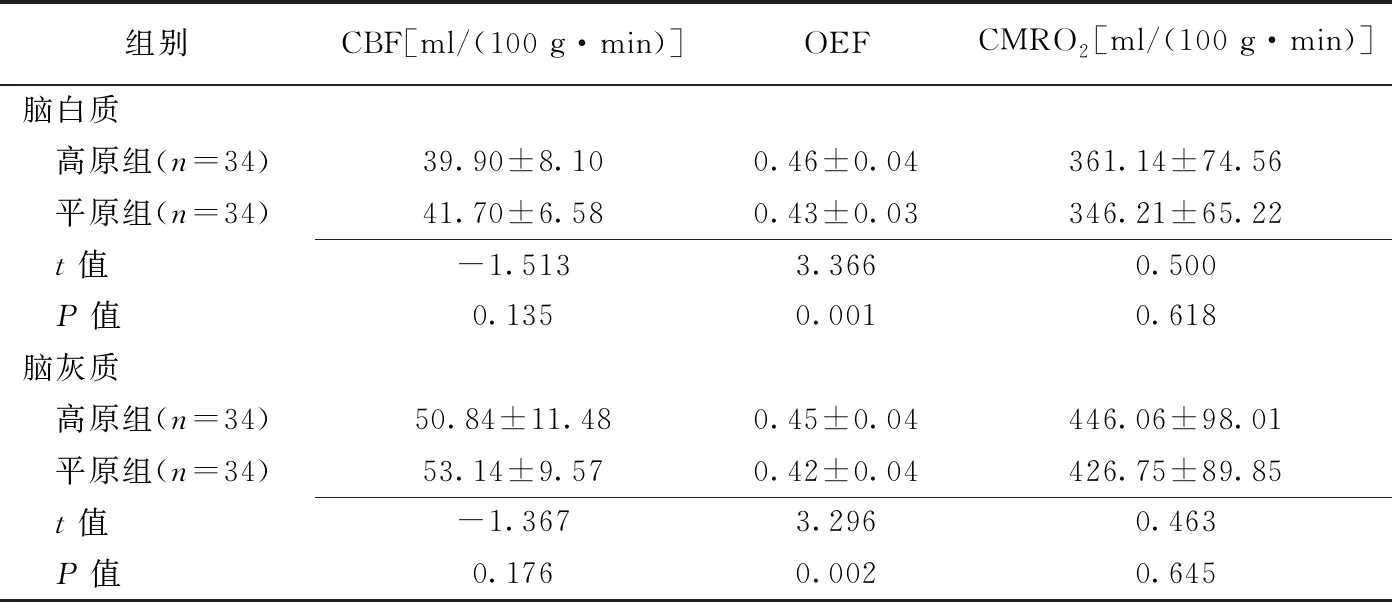
表3 高原地区及平原地区受试者脑氧代谢指标比较
3 讨论
近年来,运用功能MRI研究脑氧代谢方兴未艾。QSM技术测定CMRO2的理论公式为CMRO2=OEF×CBF×CaO2,其中OEF=1-SvO2,CaO2=(Hb×SaO2×1.34)/(1-1.5%),并假设平原地区SaO2=100%、Hb=2.48 μmol/ml、CaO2=7.377 μmol/ml进行计算[8];但高原人群长期生活于低压、低氧环境中,SaO2低使体内Hb代偿性增加,依上述SaO2和Hb估值计算OEF和CMRO2易高估结果而难以真实反映缺氧状态下脑组织氧代谢。本研究对上述公式中的相关参数进行校正,将34名拉萨地区志愿者的Hb和SaO2分别录入后处理软件,计算个体OEF及CMRO2,并与郑州地区志愿者相关参数进行比较。
本研究高原组全脑OEF高于平原组,与既往文献[9]相符。OEF增加代表脑组织对氧的摄取增加,可能是为适应缺氧环境、保持CMRO2稳定而发生的代偿。汉族人群长期移居高原后红细胞生成增多,血液运氧能力增强;氧解离曲线右移,有利于氧的释放、提高组织氧合;血管内皮生长因子1及其受体高表达可促进血管新生,缩短氧弥散距离,以提高组织供氧[10];以上因素均促使脑组织对氧的摄取增加。慢性缺氧状态下,机体通过增加通气量、心输出量、Hb等一系列机制进行代偿,同时在组织细胞层面发生适应性代偿反应,组织细胞对氧的摄取和储存能力增强,故高原地区汉族人全脑CMRO2接近于平原地区。本研究中,长期移居高原的汉族人CBF与平原人无显著差异甚至低于平原人,与既往文献[11]报道相符。
CaO2包括血液中呈化学结合状态的氧和物理溶解的氧两部分,计算公式为CaO2=(Hb×SaO2×1.34)+(动脉血氧分压×0.003 1)。通常情况下,氧气在血液中的物理溶解仅占动脉氧含量的约1.5%,故可对上述公式进行简化。本研究结果提示高原与平原汉族受试者间CaO2无明显差异,可能与高原人群通过增加Hb来增加携氧量、进而使CaO2稳定在一定水平有关。
综上,经Hb和SaO2校准后,QSM技术能更准确反映高原人低压、缺氧环境下脑氧代谢情况,结果较为可靠,可作为功能MRI研究高原环境下组织器官氧代谢的方法学依据,并为临床准确判断低张性缺氧疾病患者组织器官氧代谢提供借鉴。但本研究纳入受试者均为中青年,可能存在选择偏倚,且脑氧代谢相关参数结果未经“金标准”——15O PET/CT验证,有待后续进一步完善。

