磁共振弥散加权成像在食管癌新辅助放化疗早期效果评估中的价值
李晓倩 张 凤 傅奕铖 余 烨 吴华伟
弥散加权成像(DWI)是一种基于组织中水质子布朗运动的功能性磁共振成像技术,可通过表观弥散系数(ADC)进行量化。ADC测量的是水分子在组织内的自由弥散程度,主要受细胞、组织大小及密度的影响。肿瘤细胞坏死和纤维化后,细胞膜丧失完整性、密度降低,在DWI表现为低信号、ADC值升高。多项研究[7-8]表明,磁共振DWI在评价食管癌nCRT治疗效果方面具有广阔潜力。
本研究目的在于探究磁共振DWI特征与食管癌nCRT效果之间的关系,并探讨nCRT治疗开始前、治疗早期及治疗结束后ADC值的变化是否对局部进展期食管癌nCRT效果具有早期预测价值。
方 法
1. 临床资料
1.1 研究人群
本次研究已获得本院伦理审查委员会批准并由患者签署知情同意书。2017年12月至2020年8月期间,共42例患者经食管活检确诊为局部进展期食管癌(临床分期cT3-4N0M0或cT1-4N1-2M0)并于我院接受nCRT。其中,8例因疾病未缓解或拒绝手术、2例因未定期接受磁共振扫描而被排除在统计分析之外,剩余32例(男28例,女4例,平均年龄63岁,年龄范围48~75岁)符合分析条件。
1.2 治疗方案
所有患者新辅助化疗在以下两种方案内择其一:①紫杉醇135 mg/m2+顺铂75 mg/m2,每3周1次,共2个周期;②紫杉醇45 mg/m2+顺铂25 mg/m2,每周1次,共5个周期。放疗肿瘤靶区(包括食管原发灶及可疑阳性淋巴结)通过胸部增强CT及PET-CT选定。同步放疗共23次,总剂量为41.4 Gy。所有患者均于化疗结束后4~6周再次行胸部增强CT及18F-FDG PET/CT,并重新进行临床分期。nCRT早期若患者疾病缓解,则于nCRT结束后6~8周进行手术,术式为微创McKeown或Ivor Lewis食管切除术+2组或3组淋巴结清扫。治疗早期疾病未缓解或无法手术者,改为二线或根治性放化疗方案。
2. 疗效评估
根据实体肿瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST) 评 估nCRT的 治 疗 效 果[9]: ① 完 全 缓 解 (complete response,CR):原发病灶消失,所有病理性淋巴结短轴缩小至<10 mm;②部分缓解(partial response,PR):以肿瘤基线直径作为参考,原发病灶直径至少减少30%。在本次研究中,食管原发病灶的直径定义为食管壁的最大厚度。CR具体表现为在CT增强影像中原发肿瘤完全消失,表现为食管形态正常或管壁粗糙,食管壁厚度正常,所有淋巴结缩小至短径1 cm以下。PR表现为肿瘤原发灶及转移淋巴结直径之和缩小超过基线病灶直径之和的30%及以上,且无新病灶出现。
3.扫描方案与图像分析
所有食管癌患者在nCRT开始前(平均nCRT开始前3 d;范围:0~12 d),nCRT早期(平均nCRT开始后15 d;范围:13~25 d),nCRT结束后(平均术前12 d;范围:3~25 d)接受胸部磁共振扫描。磁共振序列必须包括横断位及矢状位T2WI及DWI。磁共振图像采集设备为Philips Intera 3.0 T。患者仰卧位扫描,检查前进行浅慢呼吸训练。患者在治疗前及治疗后完成平扫序列后,须额外进行增强扫描,造影剂为钆喷酸葡胺(马根维显)。扫描范围取决于食管病变的大小和位置。在自由呼吸条件下,于膈肌导航器采集横断位及矢状位T2WI图像。DWI采用5种不同的弥散梯度因子 (b=0、50、200、600、800 s/mm2),通过自旋回波-回波平面成像(SE-EPI)技术获得弥散加权图像。详细扫描参数如表1所示。原始DWI图像在Ziostation2(Ziosoft.Inc.,Japan)工作站后处理取得ADC(b=0、800 s/mm2)图像。
“你再找个女人吧!”我再次向他提议。我真的希望他再找个女人,相守着过完下半生。我知道,父亲的潜意识里还存在一丝念想,他还以为跑了路的那个女人有朝一日会回心转意,再来找他。

表1 磁共振扫描参数
2名放射科医生负责影像诊断与测量,若意见相左则通过讨论达成共识。食管肿瘤原发灶位置、形态主要通过T2WI确定。肿瘤大小由影像存储与传输系统(PACS)自带测量工具于T2横断位测量取得.本次研究中,肿瘤大小(即RECIST中原发病灶直径)定义为食管壁的最大厚度。以T2WI图像作为参考,在DWI(b=800 s/mm2)选择原发病灶最大层面,人工圈画高信号感兴趣区(ROI),并自动移植至ADC值图。ADC值采用原发灶最大横截面上任意3个ROI所得数值的平均值。若T2WI及DWI未能发现残余肿瘤,则根据肿瘤床所在位置圈画ROI并计算ADC值。
以下参数均由阅片者测得:治疗前肿瘤大小(Sizepre)、治疗早期肿瘤大小(Sizeduring)、治疗后肿瘤大小(Sizepos)t、治疗前ADC值(ADCpre)、治疗早期ADC值(ADCduring)、治疗后ADC值(ADCpos)t。ADC值变化量百分比(△ADC)及肿瘤大小变化量百分比(△Size)的计算公式如下:
3. 统计学分析
计量资料比较采用配对样本t检验及独立样本t检验。使用ROC曲线分析各参数对于食管癌nCRT反应的预测价值,并计算ROC曲线下面积(AUC)及95%置信区间(CI)、截断值及对应的灵敏度和特异度。采用二元logistic回归联合多项参数建立肿瘤CR的预测模型。正态分布变量以均数±标准差描述,当P<0.05(双侧)时,差异具有统计学意义。除ROC分析采用MedCalc 10.1.6.0进行计算及分析外,其余统计均在SPSS 20.0上进行。
结 果
1.患者临床结局及手术结果
32例局部进展期食管癌患者nCRT结束后,在胸部增强CT及PET-CT基础上根据RECIST评价标准进行分组,其中CR 12例、PR 20例。CR与PR的典型病例如图1、2所示。食管癌位置分布、病理分型及病理退缩分级见表2。

表2 32例患者临床资料
2.磁共振DWI参数统计结果
局部进展期食管癌磁共振DWI各项参数在CR组及PR组中的差异如表3所示。通过分析肿瘤大小可知,所有患者食管癌原发灶在nCRT治疗早期及结束后均逐步缩小[Sizeprevs Sizeduring:(23.3±4.6)mm vs(17.3±3.9)mm,P<0.001;Sizeduringvs Sizepost:(17.3±3.9)mm vs(13.5±2.9)mm,P<0.001)]。在nCRT开始前,CR患者与PR患者的肿瘤大小没有显著性差异[(22.3±4.8)mm vs(23.9±4.5)mm,P=0.347)]。CR患者在nCRT治疗早期及治疗结束后的两次磁共振扫描中,肿瘤大小均小于PR患者[Sizeduring:(14.8±3.1)mm vs(18.9±3.6)mm,P=0.003;Sizepost:(11.9±3.3)mm vs(14.5±2.1)mm,P=0.011)]。另外,在nCRT早期,CR患者肿瘤原发灶缩小比例也显著高于PR患者[(31.9±15.0)%vs(20.6±8.9)%,P=0.012)]。
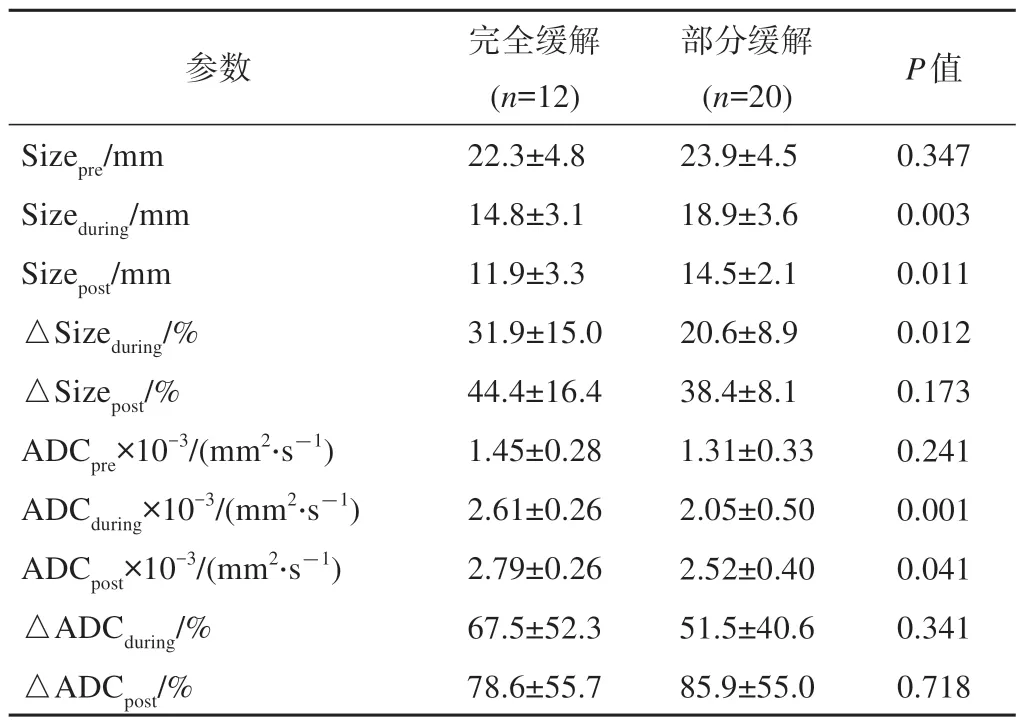
表3 磁共振各项参数在完全缓解及部分缓解组间的差异
通过分析DWI图像可知,所有食管癌患者ADC值在nCRT治疗早期[(1.36±0.31)×10-3mm2/s vs(2.26±0.50)×10-3mm2/s,P=0.001)]和治疗结束后[(1.36±0.31) ×10-3mm2/s vs(2.62±0.40) ×10-3mm2/s,P=0.002)]相比治疗前均显著升高。nCRT开始前,CR患者及PR患者之间ADC值无明显差异,但在治疗早期及治疗结束后,CR患者的ADC值均显著高于PR患者(ADCduring:(2.61±0.26)×10-3mm2/s vs(2.05±0.50)×10-3mm2/s,P=0.001;ADCpost:(2.79±0.26)vs(2.52±0.40)×10-3mm2/s,P=0.041)。△ADC不论在治疗早期还是治疗结束,在CR与PR患者之间均无显著性差异。
3. 诊断效能分析
图3及表4显示,Sizeduring、△Sizeduring、ADCduring和ADCpost能够较为可靠地区分CR患者和PR患者。通过ADCduring的ROC曲线分析可得,CR和PR的截断值为2.32×10-3mm2/s,即ADCduring在该值以上的患者为肿瘤完全缓解(灵敏度=91.7%,特异度=80.0%,PPV=73.3%,NPV=94.1%;AUC=0.831;P<0.001;图3)。分析Sizeduring的ROC曲线则可得到截断值为16.5 mm,该值以下的患者为肿瘤完全缓解(灵敏度=83.3%,特异度=70.0%,PPV=62.5%,NPV=87.5%;AUC=0.801;P<0.001;图3)
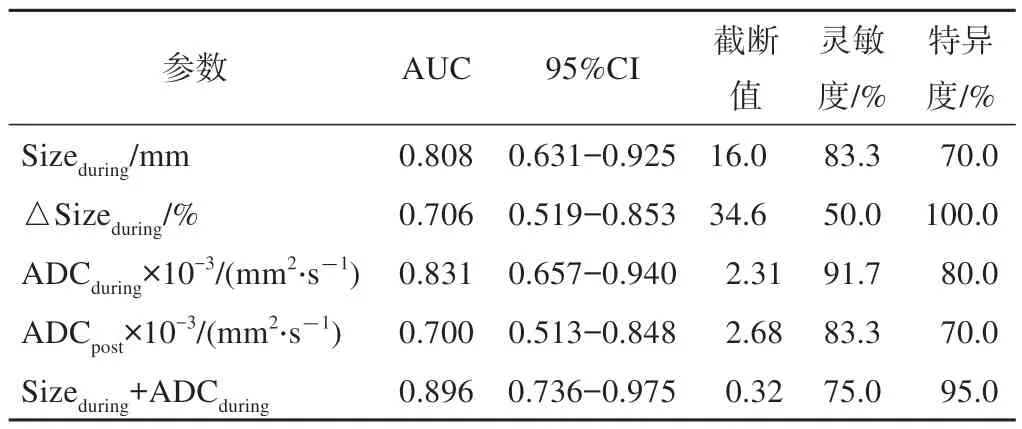
表4 磁共振参数ROC曲线分析结果
为了评价肿瘤大小和ADC值在评价食管癌nCRT疗效中的互补价值,本次研究利用logistic回归从Sizeduring、△Sizeduring、ADCduring和ADCpost等诊断效能较高的参数中进行筛选,进一步建立食管癌完全缓解的预测模型。结果显示,Sizeduring及ADCduring具有较高的联合预测价值。经ROC分析可得,Sizeduring+ADCduring预测模型的AUC为0.896(图4),较各自的AUC单值(0.808,0.831)更高,该模型预测食管癌完全缓解的灵敏度和特异度分别为75.0%和95.0%。
讨 论
本次研究讨论了磁共振DWI在评价局部进展期食管癌新辅助放化疗(nCRT)效果中的价值。nCRT是目前局部进展期食管癌的标准治疗,其治疗效果评价目前主要依靠胸部CT、经食管超声和PET-CT等检查。对于nCRT早期治疗效果评估,临床迫切需要一种对患者伤害小、评价效果准确的预测指标,从而达到为患者“量身定制”治疗方案的目的。从既往研究中可以看到,ADC值升高提示肿瘤细胞和间质发生特定的变化趋势,包括细胞膜完整性的丧失,间质的丧失,同时血管生成,肿瘤凋亡和坏死[10]。因此,许多研究者都在探索DW-MRI是否能作为食管癌nCRT治疗反应的新兴预测方法。
本组食管癌患者病理分型均为鳞状细胞癌,与中国食管癌地域分布特点基本一致。在众多有关食管nCRT与磁共振DWI的研究中[7-8],仅于nCRT开始前及结束后进行了两次扫描。van Rossum等[11]和Imanishi等[12]的研究中选择2~3周(第10~15次放疗)作为MRI扫描的最佳时机。因此,本研究除去治疗开始前及结束后两次常规磁共振扫描外,在nCRT开始后第2~3周(第10~15次放疗),即nCRT治疗早期额外增加一次MRI平扫。Chen等[13]在有关食管癌nCRT效果评估的meta分析中提到,在nCRT开始后的2周内,18F-FDG PET/CT的标准摄取值(standard uptake value,SUV)减少50%是预测食管癌患者对新辅助治疗反应的最佳条件,该时间节点肿瘤代谢活性变化最明显,有助于临床早期预估nCRT效果,及时调整治疗方案。在本次研究中,所有患者食管肿瘤ADC值在第2~3周明显升高,且完全缓解患者ADC升高幅度大于部分缓解患者,这种变化趋势可解释为放化疗后肿瘤结构丧失完整性,细胞凋亡、坏死、数量减少,弥散受限减弱。
本次研究讨论了磁共振DWI参数与食管癌nCRT治疗反应之间的联系,为局部进展期食管鳞状细胞癌患者在nCRT早期和术前评估提供了一种有潜在应用价值的影像学方法。首先,我们的研究显示,食管癌完全缓解组治疗早期ADC值和治疗结束后ADC值显著高于部分缓解组,该结果与既往国内外食管癌nCRT研究一致:如Li等[7]报道有反应者治疗后ADC值[(3.02±0.84)×10-3mm2/s vs(2.12±0.44)×10-3mm2/s,P=0.001)]和治疗前ADC值[(1.22±0.78) ×10-3mm2/s vs(0.64±0.26) ×10-3mm2/s,P=0.007)]显著高于无反应者。与之类似,De Cobelli等[8]在32例活检证实的局部进展期胃食管癌患者中发现,有反应者治疗前ADC值显著低于无反应者(1.32×10-3mm2/s vs 1.63×10-3mm2/s;P=0.002)],治疗后ADC值显著高于无反应者(2.22×10-3mm2/s vs 1.51×10-3mm2/s;P=0.001)。
其次,就肿瘤大小在食管癌nCRT期间的变化趋势来看,在nCRT开始后的2~3周内,CR患者肿瘤大小显著小于PR患者,且肿瘤缩小程度更大,该趋势与临床实际工作中所见一致。过去诸多研究对nCRT前后原发病灶直径/面积/体积变化的报道缺乏一致性[7-8,11-12],究其原因可能与不同测量标准或病灶体积计算误差有关,胃肠道肿瘤肿瘤活动度较大、形态不规则,一直是提高肿瘤疗效评估准确性中的难点。
此外,凭单一的肿瘤大小或ADC值可能无法早期准确评估nCRT的治疗反应。本次研究利用logistic回归将治疗早期肿瘤大小及ADC值相结合,建立食管癌完全缓解预测模型,一定程度上提高了完全缓解预测的准确性。在既往文献中尚未有关于此类模型价值的探讨,属于本文的创新点之一。
本研究仍有一定的局限性:①本次共收治32名食管癌患者患者,样本量仍较小。②对患者采用两种不同的新辅助放化疗方案,可能对肿瘤ADC值存在不同程度的影响。③所有MRI扫描均在同一台MRI机上进行,在可推广性上有所欠缺。在未来的研究中,我们将在不同的MRI机器采用相同序列进行扫描,从而提高研究的可信度及可推广性。
综上所述,磁共振DWI可被认为是局部进展期食管癌nCRT早期效果评估的可靠的非侵入性检查方法。此外,在nCRT早期,肿瘤大小联合ADC值的logistic预测模型对食管癌治疗效果评估有重要价值。

