MRI阴性颞叶内侧型癫痫海马结构分析的临床应用
赵 伟 杨 虹 王宝龙 罕迦尔别克·库锟 孙雨龙 王云玲
颞叶内侧癫痫(mesial temporal lobe epilepsy,mTLE)是最常见的MRI阴性癫痫类型,且多数表现为耐药性癫痫[1],而手术切除是MRI阴性颞叶内侧型癫痫(mTLE-N)患者获得临床缓解及治愈的唯一希望[2]。此类患者能够借助长程视频脑电图(video electroencephalogram,VEEG)等工具定位癫痫异常放电区域,但因VEEG空间定位能力较差,因此无法精确定位致痫灶位置,导致mTLE-N患者长期无法得到良好的症状控制和缓解机会。随着MRI序列的开发和应用,结构MRI(sMRI)是目前应用于癫痫、帕金森病、阿尔茨海默病等功能性脑病的常用研究序列,相应的自动化脑分割及分析软件也相继问世,目前最为常用的分析手段包括基于脑体素(voxel-based morphology,VBM)的SPM12和基于脑表面分析(surface-based morphology,SBM) 的Freesurfer软件[3]。研究认为SBM能够提供更为细致的结构分析,因此本研究拟招募单侧颞叶内侧型癫痫患者,采集sMRI图像并使用Freesurfer软件对海马体进行亚区分割和计算,对比健康志愿者的分割结果,以期了解海马体亚区结构在mTLE-N中的变化。
方 法
1. 研究对象
2019年12月—2021年6月期间就诊于我院的癫痫患者39例纳入病例组,同时招募年龄、性别匹配的健康志愿者44例纳入对照组。本研究经新疆医科大学第一附属医院伦理委员会批准。所有受试者均知情同意并签署知情文件。
病例组纳入标准:①经VEEG检查明确发现起源于左侧颞叶内侧的尖波、棘波、或棘-慢波;②服用同类型的AEDs。
病例组排除标准:①存在外伤、脑血管病、颅内占位性病变、炎症等病史;②确诊或既往存在精神病史;③服用AEDs以外的精神类药物;④MRI扫描的绝对禁忌证。
对照组为无颅内占位、感染、外伤、精神疾病或精神类药物用药史且年龄性别与病例组匹配的健康志愿者。
2.MRI扫描方案
所有被试均在西门子SKYRA 3.0 T磁共振扫描仪接受T1-磁化准备的快速梯度回波(MPRAGE)序列扫描。扫描参数:FOV=256 mm×256 mm,层数=176,扫描位置为矢状位,层厚=1 mm,相位编码方向为A-P(读出方向S-I);TR=2 530 ms,TI=1 100 ms(3 T),TE=1.64 ms/3.5 ms/5.36 ms/7.22 ms,带宽=651 Hz/px;射频脉冲为非选择性反转恢复,7°非选择性激发;加速因子为2×GRAPPA(全局自动校准部分并行采集)。
3. 图像后处理
从扫描仪中获取所有被试的DICOM原始图像,由影像存储与传输系统(PACS)导出,用MRIcron软件的dcm2nifti插件将DICOM格式文件转换为.nii格式,使用Freeview打开图像,由2名具有5年以上经验且不了解患者病史的医师对图像进行判读,使用SPM12的图像分析软件评估图像质量评估。使用Freesurfer软件对转换后的nii文件进行recon-all全脑分割,再使用Hippocampal Subfields and Nuclei of Amygdala功能进行海马亚区进行分割,获得的结果保存为mgz压缩图像格式和stat数据格式。
使用SPSS26.0软件对病例组患者两侧海马体积计算结果进行统计学分析,采用配对样本t检验;所有受试者的左侧海马亚区体积计算结果进行统计分析,采用独立样本t检验,以P<0.05作为有意义的标准。
结 果
1. 一般资料
累计收集39例左侧颞叶内侧型癫痫患者及44名健康志愿者的3D T1-MPRAGE图像,2组年龄[(38±10)岁vs(40±18)岁,P=0.54]、性别构成无统计学差异(P=0.86),所有受试者均为右利手,病例组患者病程为(36±6)个月。
2.病例组双侧海马体体积
病例组均为左侧颞叶内侧型癫痫,对患者双侧海马体图像进行分割和比较发现,患者双侧海马体积差异无统计学意义(P>0.05,表1)。

表1 病例组双侧海马体积比较
3.病例组及对照组左侧海马体亚区体积
病例组与对照组左侧海马体亚区分割和体积计算后发现,病例组海马总体积、CA1区、CA3区、分子层、CA4区、海马头部、海马体部及海马杏仁核过渡区体积均较对照组增大,差异有统计学意义(图1、表2)
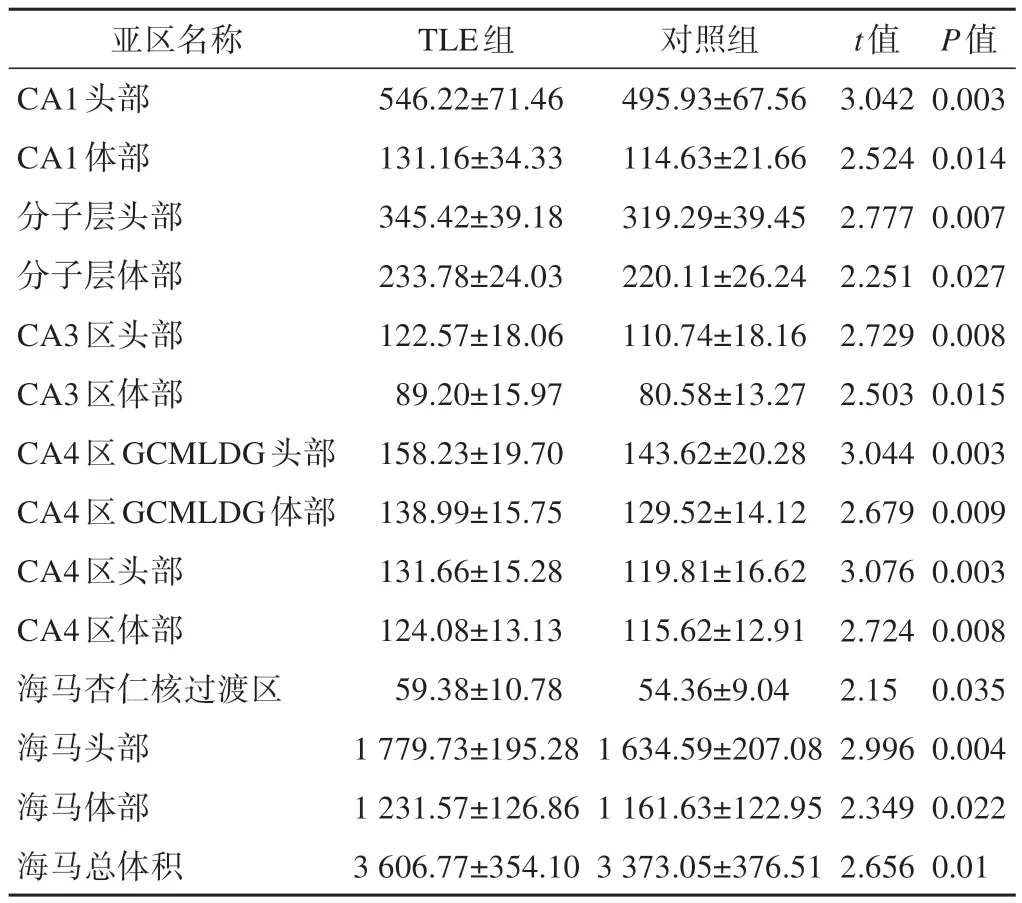
表2 病例组与对照组海马体亚区分析
讨 论
癫痫是一个全球性的医疗卫生问题,全球大约有7 000万人受其影响。癫痫的常见病因包括颅内肿瘤、感染、创伤、海马硬化等,在大约50%的病例中,癫痫病因是未知的。据世界卫生组织估计,如果得到适当的诊断和治疗,约70%的癫痫患者甚至可以完全消除癫痫发作[4]。
VEEG能同步监测和分析临床发作,但其灵敏度较低,并可能会受头皮、颅骨或肌电作用影响,降低定位效果。MRI是评估癫痫病因和确定癫痫潜在发作部位的重要技术,其对mTLE的定侧是术前检查的重要环节,虽然广泛颞叶切除术很大程度减少了癫痫发作的机会,但也带来了更严重的记忆损害和认知缺陷的风险,致痫灶的精确定位关系到手术结果的好坏。
随着3.0 T MR的引入,MRI技术识别小病灶的能力得以大大提高。然而,高达30%的mTLE患者在3.0 T MR影像上表现正常[5],即MRI阴性癫痫(mTLE-N)。MRI上没有明显病灶可能导致癫痫手术证据不足,与MRI阳性患者相比,大多数mTLE-N患者在手术干预后并不能控制癫痫发作。为了更有效地识别癫痫导致的异常,指导mTLE-N患者颅内电极植入,需要新颖的成像采集技术和先进的成像分析算法。
海马是由不同细胞结构亚区组成的皮质结构,被认为是癫痫网络中经常涉及的一个节点。近几年研究表明,海马亚区结构的细微改变,可能导致神经及精神方面疾病,包括癫痫、阿尔茨海默病、严重抑郁障碍、创伤后应激障碍和精神分裂症等。
本研究使用的海马分割工具是应用广泛的神经成像分析软件Freesurfer。海马分割的输出是左右半球图像,将海马区域中的体素(分辨率为1 mm等向和0.333 mm等向)进行12个子区域的分割。它们按平均大小排序为CA1、分子层(molecular layer,ML)、海马体部、海马尾部、下托、前下托、齿状回颗粒细胞层(GC-ML-DG)、CA4、CA3、海马裂、海马-杏仁核过渡区(HATA)和海马伞[6]。
在我们的研究中发现,39例mTLE-N患者左侧海马总体积、CA1区、CA3区、ML、CA4区、海马头部、海马体部及海马杏仁核过渡区体积均较对照组略增大,考虑mTLE-N的发病机制并不同于内侧颞叶海马硬化癫痫(temple lobe epilepsy associated with mesial temporal sclerosis,TLE-MTS)。之前有研究[7]发现,在95例1.5 T/3.0 T mTLE-N患者中,海马硬化(hippocampal sclerosis,HS)的发生率仅为9.9%,因此mTLE-N患者并不一定患有HS,我们的发现也与Sone等[8]最近的另一项研究一致,该研究显示合并HS的TLE中的多个海马亚区体积减少,但在mTLEN中没有。在多项mTLE-N患者的手术病理结果的研究中显示[9],大多数病理学诊断为“组织学上正常的海马”,一部分病理诊断为“非特异性胶质细胞”。
越来越多的研究报道表明,mTLE-N可能有不同于TLE-MTS的病理生理学,而不仅仅是一个早期变体[9]。一些医生认为mTLE-N与TLE-MTS的近侧TLE属于同一类别,而另一些医生则认为mTLE-N应该作为一个独立的整体存在[10]。我们的研究结果为后者提供了一些依据。最近有研究认为,微小的颞极脑膨出是mTLE-N的隐藏原因[11]。这些研究表明,mTLE-N患者发作年龄较晚、术前癫痫持续时间较短,并有全面性癫痫发作倾向,这似乎与TLE-MTS的癫痫网络不同。Rutland等[12]提出了一种新的海马亚区特异性纤维束成像方法,用于量化mTLE-N患者海马亚区的结构连通性;宁殿秀等[13]的表明,MRS可早期发现癫痫区域脑代谢变化,有助于进一步研究mTLE-N的发病机制。
海马亚区功能的多样性表明,海马不应被视为一个单一的结构,而应被视为一个多连接区域[14]。然而,阐明每个亚区功能和连接它们的通路是需要进一步研究的问题。先前研究发现,癫痫患者与健康志愿者相比存在一定的亚区体积差异,这表明某些亚区可能比其他亚区更容易受到疾病的影响,或某些亚区的病变可能造成了不同的癫痫发作机制[15]。
本研究局限性:①患者均未行手术切除,患者海马病理结果未知;②患者及对照组样本量较小,数据可靠性还待进一步验证;③未使用fMRI方法对mTLE-N患者海马进行研究。
综上,mTLE-N患者可能存在肉眼无法识别的海马异常,使用脑结构自动分割和体积计算工具可揭示海马亚区的结构异常,有助于发现并定位可疑致痫灶,从而尽早对致痫灶行切除治疗,提高患者生活质量。

