自制药美沙拉嗪肠溶片与原研药Salofalk 体外溶出一致性评价研究
李付鸾 董文弟 刘云 贾妥 孟玉 张晓宁 赵晓芳
炎症性肠病(IBD)指非特异性肠道炎症性疾病,包括溃疡性结肠炎(UC)和克罗恩病(CD)。UC 是一种原因不明的慢性结肠炎,主要是侵及结肠黏膜的慢性非特异性炎性疾病,常始自左半结肠,可向结肠近端乃至全结肠以连续方式逐渐进展[1]。UC 在西方国家非常常见,发病率为(10~200)/10 万[2]。我国目前尚缺乏大规模的以人口为基础的流行病学调查数据,粗略估计我国UC 患病率为11.6/10 万[3]。根据中华医学会2018 年9 月通过的“炎症性肠病诊断与治疗的共识意见”,美沙拉嗪为炎性肠炎治疗药物A 级推荐。国外上市的美沙拉秦缓控释制剂较多[4],除Salofalk 外,还有缓慢释放型美沙拉秦(Asacol)、时间依赖型美沙拉秦(Pentasa)、pH 依赖性缓释型美沙拉秦(Apriso)和高浓度美沙拉秦缓释胶囊(Lialda)[5]。国内目前无美沙拉嗪产品通过一致性评价。国家食品药品监督管理总局自制药质量和疗效一致性评价专家委员会审核确定的第十批参比制剂目录确定原研药Salofalk 为自制药美沙拉嗪肠溶片的参比制剂。本研究按照《国务院办公厅关于开展自制药质量和疗效一致性评价的意见》(国办发[2016]8 号)和国家药品监督管理局《关于发布普通口服固体制剂参比制剂选择和确定等3 个技术指导原则的通告》(2016 年第61 号)的有关要求,开展了自制药美沙拉嗪肠溶片与原研药(参比制剂Salofalk)的体外释放曲线一致性评价研究。由于美沙拉秦生物药剂学分类系统(BCS)分类为4 类,酸性介质中的溶解度很小,自制药美沙拉嗪肠溶片与原研药 (参比制剂Salofalk)在pH 1.0 盐酸、pH 4.5 醋酸盐、水介质中2 h 内药物释放均<20%,推断在这3 种介质中的释放不具备区分能力。故本研究着重测定了自制药美沙拉嗪肠溶片与原研药(参比制剂Salofalk)在pH 6.8 和pH 7.4 磷酸盐介质中的释放曲线。本研究采用美国食品药品监督管理局(FDA)和日本医疗器械审评审批机构(PMDA)推荐采用相似因子比较法评价自制药美沙拉嗪肠溶片与原研药(参比制剂Salofalk)释放曲线一致性[6],指导自制药美沙拉嗪肠溶片的质量和疗效一致性评价研究,以提高自制药与原研药生物等效性(BE)试验的成功率。
1 材料与方法
1.1仪器 Agilent 708-Ds 自动溶出仪(美国Agilent公 司);UV2600 紫外。可见分光光度计(日本岛津公司);pH 计FE-28(梅特勒);电子天平AUW120D(日本岛津公司);FAVD-25(上海富科思)。
1.2试药 自制药美沙拉嗪肠溶片(石家庄蒎格医药科技有限公司,规格:250 mg,批号:200171、200172、200173);生产规模:24 万片/ 批。原研药Salofalk(德国Dr Falk Pharma GmbH,规格:250 mg,批号:16B04458L、17I21478L、18A11484L);美沙拉嗪肠溶片对照品(中国食品药品检定研究院,批号:100565-201802,含量:99.4%);二水合磷酸二氢钠(AR,科密欧);氢氧化钠(AR,天津永大化学)、磷酸二氢钾(AR,科密欧)、冰醋酸(AR,天津天大化学);结晶醋酸钠(AR,天津天大化学);盐酸(AR,科密欧);实验用水为纯化水(华北制药有限公司)。
1.3释放曲线测定方法 释放曲线测定采用照紫外-可见分光光度法(中国药典2015 年版四部通则0401),精密量取各取样点的供试品或对照品溶液5 ml,用相应的缓冲溶液稀释到50 ml,在330 nm 的波长处测定吸光度。供试品溶液:取自制药美沙拉嗪肠溶片或原研药(参比制剂Salofalk)按照《中华人民共和国药典》2015 年版四部通则溶出度与释放度测定法第一法,转速 50 r/min,分别以pH 1.0 盐酸、pH 4.5 醋酸、pH 6.8磷酸盐缓冲液、水或pH 7.4 磷酸盐缓冲液为释放介质,体积 900 ml,在不同取样点取样5 ml 即得。每次取样后回补释放介质5 ml。对照品溶液:精密称取美沙拉嗪肠溶片对照品3 mg,分别加入pH 1.0 盐酸、pH 4.5醋酸、pH 6.8 磷酸盐缓冲液、水或pH 7.4 磷酸盐缓冲液溶解定容至100 ml。即得每1 ml 中约含美沙拉嗪30 µg 的溶液,作为对照品溶液。
2 结果
2.116B04458L、17I21478L、18A11484L 批参比制剂在不同介质中的溶出结果 三批参比制剂在4 种介质中的溶出均较慢,具有明显的pH值依赖。在介质pH 6.8和7.4 磷酸盐缓冲液中具有平滑的曲线形态,溶出时间在2 h 可达到80%以上,而其他介质中溶出较慢,且在溶出过程中片间差异较大。结合所得数据并参考美沙拉嗪片质量标准,选择介质pH 6.8 或7.4 磷酸盐缓冲液作为自制样品的溶出介质。见表1~3 及图1~3 溶出数据和溶出曲线图。
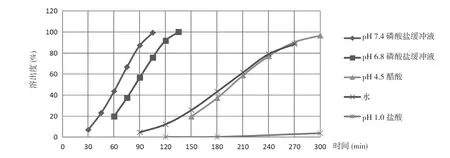
图1 16B04458L 参比制剂Salofalk 在不同介质中的溶出曲线
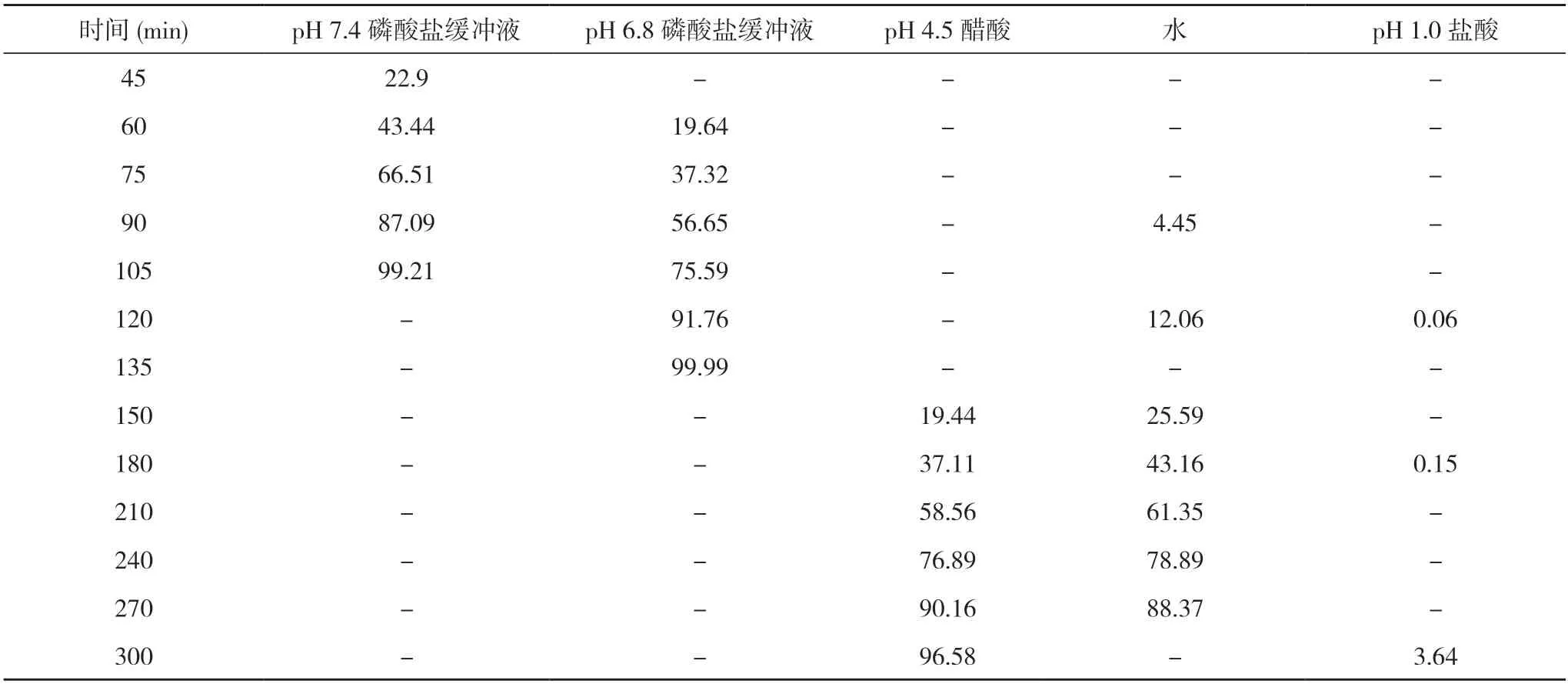
表1 16B04458L 批参比制剂在不同介质中的溶出结果(%)
2.2自制样品在不同介质中的溶出结果 200171、200172、200173 自制样品溶出趋势与参比制剂一致,相似因子均达到50%以上,并且2 h 溶出达到85%以上,溶出曲线平滑,溶出行为相似。见表4,表5 及图4,图5。

图2 17I21478L 参比制剂在不同介质中的溶出曲线
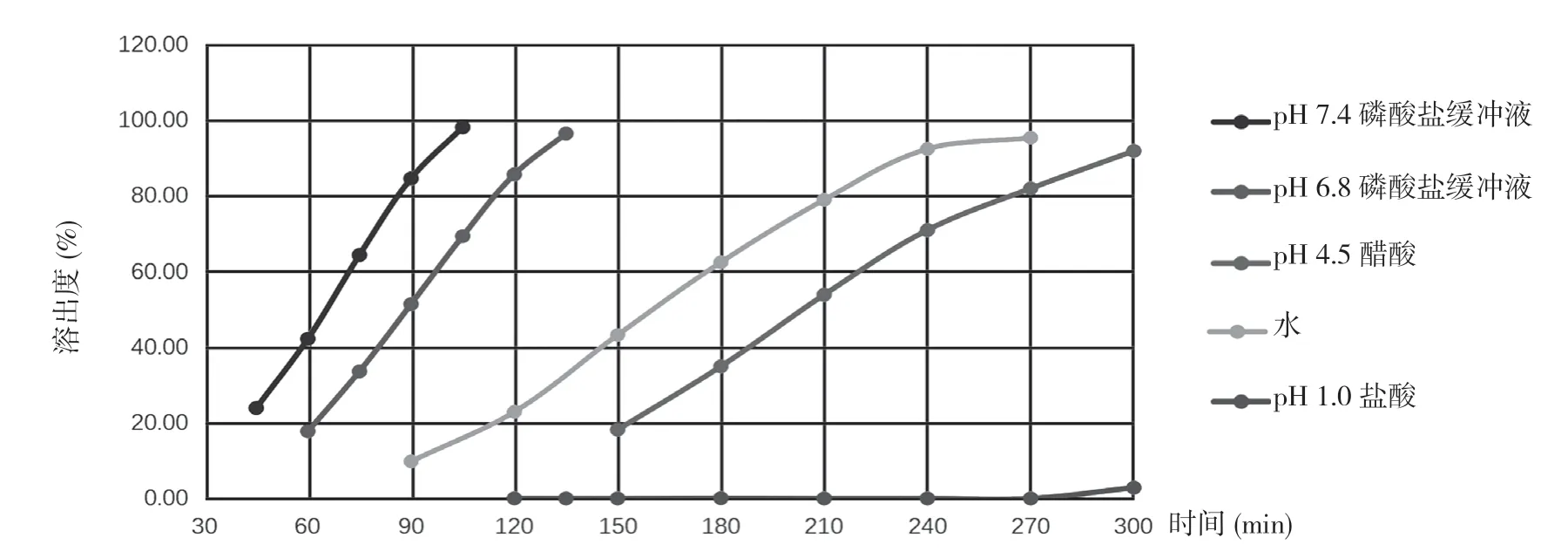
图3 18A11484L 参比制剂在不同介质中的溶出曲线
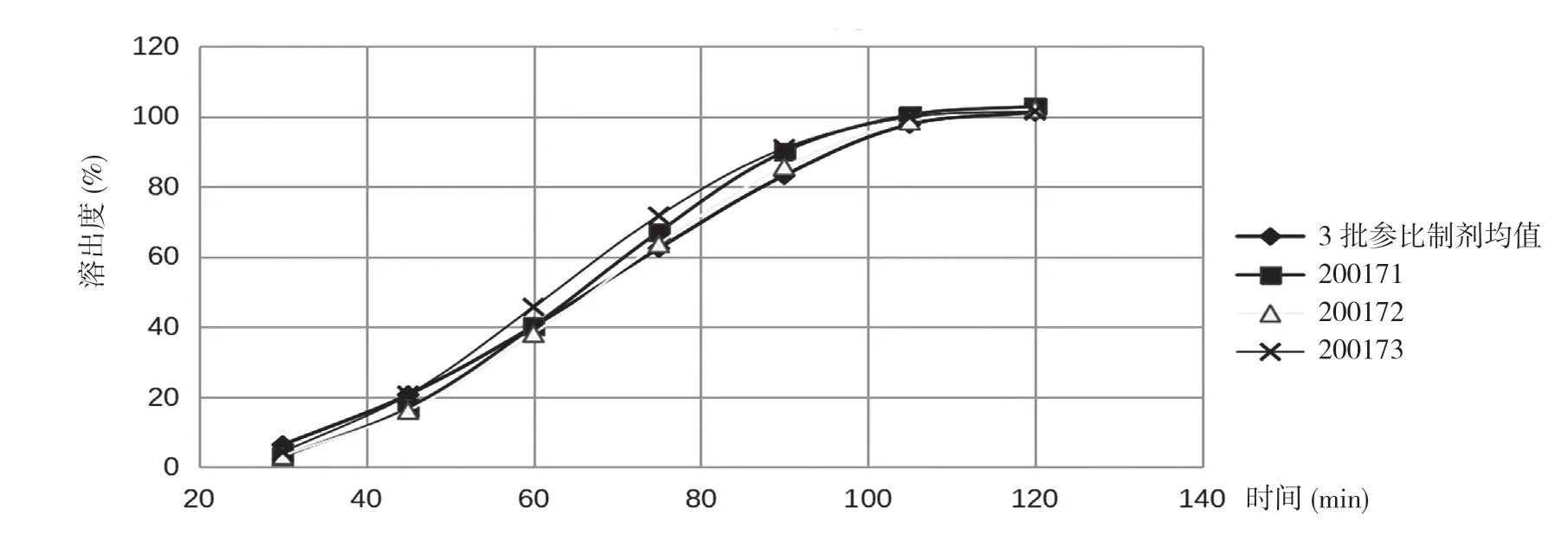
图4 自制样品在pH 6.8 磷酸盐缓冲液介质中的溶出曲线
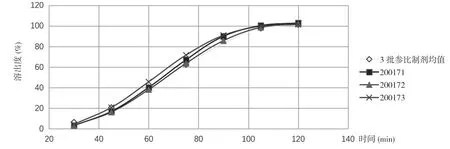
图5 自制样品在pH 7.4 磷酸盐缓冲液介质中的溶出曲线
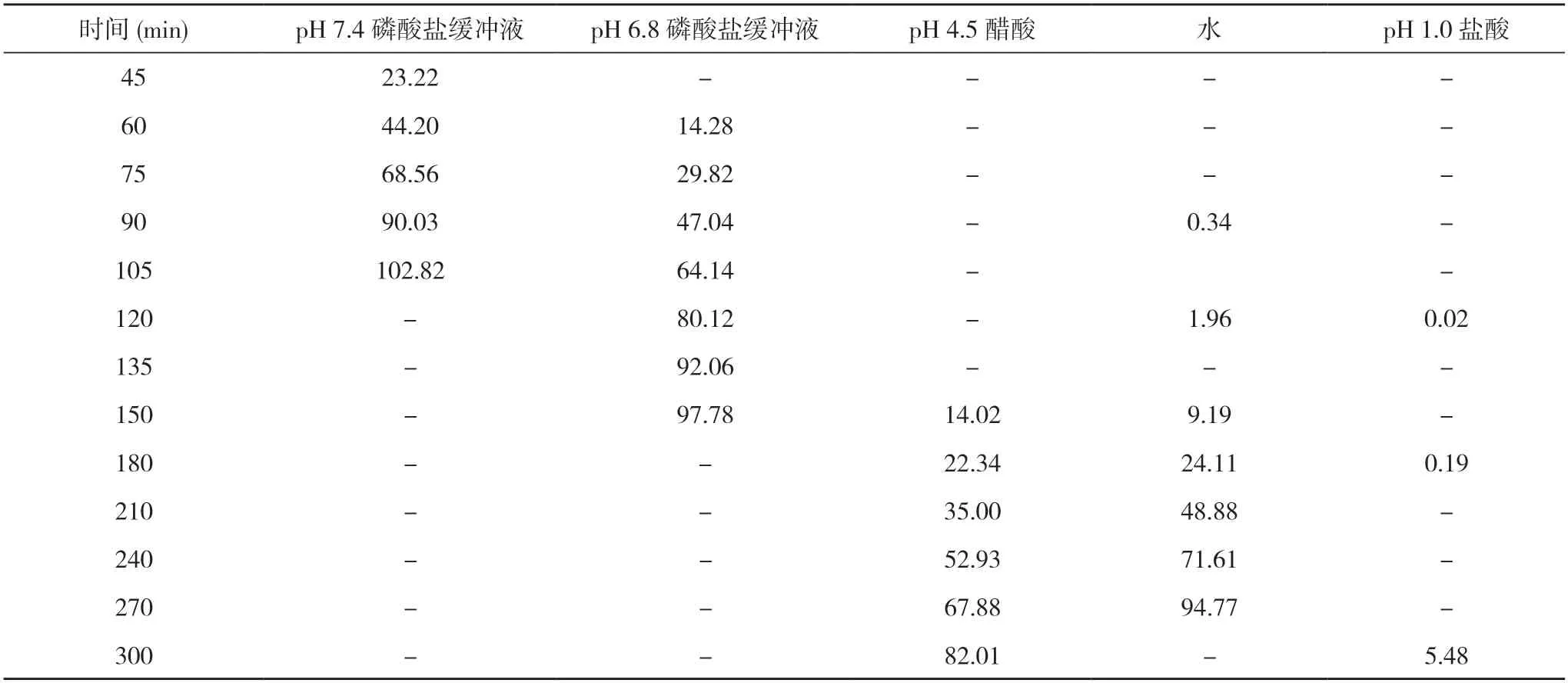
表2 17I21478L 批参比制剂在不同介质溶出数据结果(%)
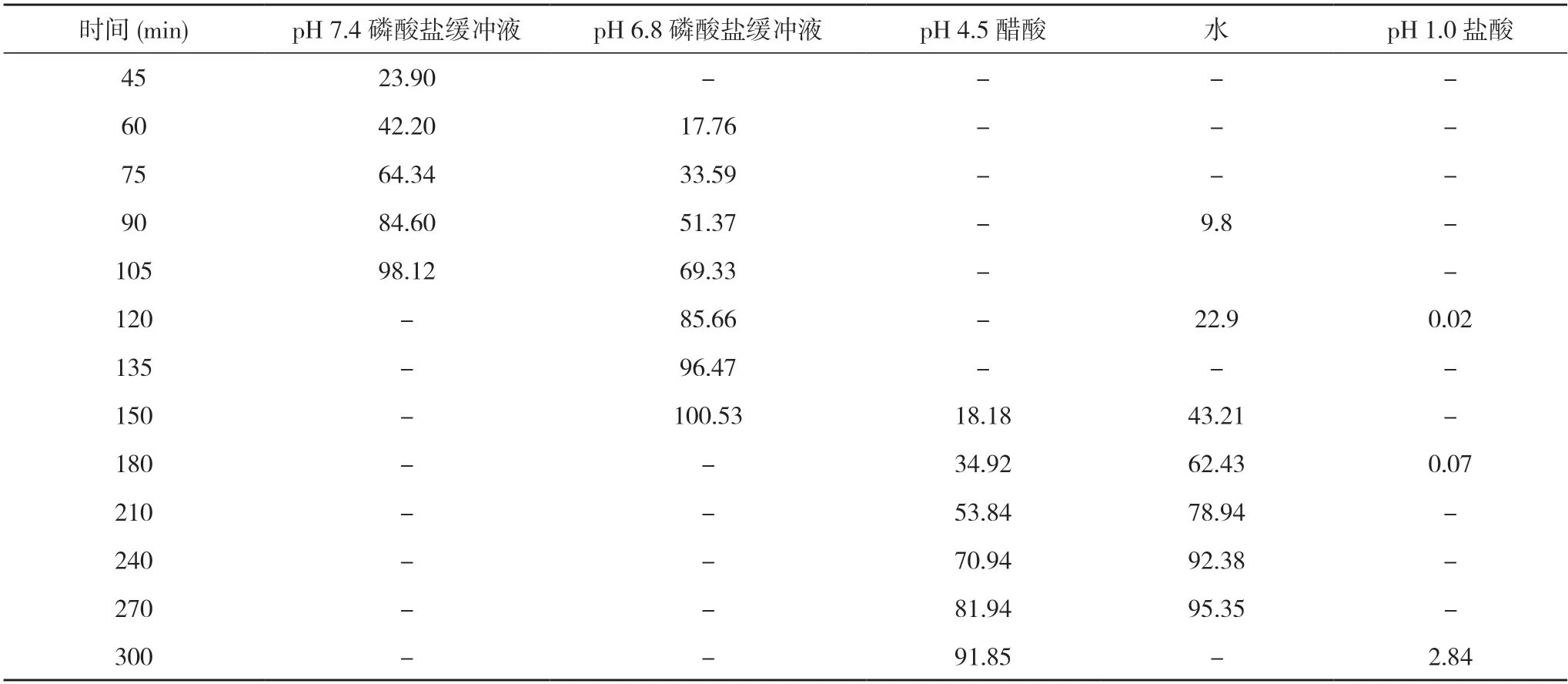
表3 18A11484L 批参比制剂在不同介质中的溶出结果(%)

表4 自制样品在pH 6.8 磷酸盐缓冲液介质中的溶出度结果(%)

表5 自制样品在pH 7.4 磷酸盐缓冲液介质中的溶出度结果(%)
3 讨论
美沙拉嗪属于BCS4 类,为低溶低渗药物,相较于BCS1 类等药物仿制难度较大,对于缓控释制剂,仿制难度又有所增加。美沙拉嗪肠溶片属于多层包衣肠溶片,参比制剂Salofalk 批间差异较大,所以美沙拉嗪肠溶片仿制难度极大[7,8]。这应该是目前为止国内尚没有美沙拉嗪肠溶片通过一致性评价的主要原因。固体口服制剂的体外溶出度检测是体外评价药物质量的重要指标,对药物的临床实验起着重要的指导作用[9]。尤其是自制药,其体外溶出行为与参比制剂是否具有相似性,是决定后续是否开展生物等效性实验的重要参考,也是自制药品是否与参比制剂质量一致性的重要参考指标。
通过对参比制剂Salofalk 与自制药美沙拉嗪肠溶片在pH 6.8、pH 7.4 磷酸盐缓冲液中的溶出行为与溶出数据进行对比,相似因子>50%,溶出曲线平滑、趋势一致。在对比研究参比制剂Salofalk 与自制药在pH 1.0 盐酸溶液、pH 4.5 醋酸溶液、水介质溶出行为时发现2 h 内溶出行为相似,但溶出均<20%。综合考虑药物在不同介质中的溶出行为,选定pH 6.8、pH 7.4 磷酸盐缓冲液为溶出的主要研究介质。
综上所述,经过多批次自制药美沙拉嗪肠溶片与参比制剂Salofalk 在不同溶出介质中的溶出行为研究,两者溶出行为一致,为其体内的评价实验奠定了基础。

