BoneCeramic与Bio-Oss促进大鼠PAOO术后成骨与骨髓基质细胞成骨分化效果的比较研究
李伟琼,张雨晴,徐建光,张红艳
随着生活水平提高越来越多的成年人寻求正畸治疗[1],但成年人治疗时间较长,同时易发生牙周破坏等情况[2-4]。为此正畸科医师提出牙周加速成骨正畸(periodontally accelerated osteogenic orthodontics,PAOO)这一观点[5-6]。PAOO是指在相关区域牙槽骨进行骨皮质切开,移植颗粒骨并结合正畸牙移动,从而达到加速牙齿移动,增加牙槽骨骨量的目的[7-8]。研究[9]表明当牙根唇颊侧牙槽骨厚度<2 mm时,骨皮质切开的同时需要植骨,同时材料的降解速率应当适中,不能影响牙齿的移动[10]。目前PAOO术中常用的骨移植材料为Bio-Oss[11],但相关研究[12]表明Bio-Oss在植入数年后未完全吸收。BoneCeramic是一种纯合成骨移植材料,由40%β-磷酸三钙(betatricalcium phosphate,β-TCP)和60%羟基磷灰石(hydroxyapatite,HA)组成[13]。该研究通过比较BoneCeramic与Bio-Oss促进大鼠PAOO术后成骨与骨髓基质细胞成骨分化效果,探讨BoneCeramic 作为纯合成骨移植材料是否能够增加SD大鼠PAOO术后牙槽骨骨量及其及相关机制,为未来的临床实践提供理论基础。
1 材料与方法
1.1 动物、试剂与仪器普通级8周雄性SD大鼠36只、SPF级3.5周龄雄性SD大鼠4只(安徽医科大学动物实验中心);Bio-Oss(瑞士Geistlich Pharma公司);BoneCeramic (瑞士Switzerland 公司);胎牛血清(杭州四季青生物科技公司);CCK-8试剂(日本同仁公司);碱性磷酸酯酶试剂盒(上海碧云天生物技术有限公司);PCR引物(上海生物工程股份有限公司);镍钛拉簧(上海埃蒙迪材料科技股份有限公司);细胞培养箱(美国Therno公司);实时荧光定量PCR仪(美国Stratagene公司);超声骨刀(中国啄木鸟医疗器械有限公司)。
1.2 动物实验
1.2.1动物实验分组 将36只SD大鼠随机分成3组:骨皮质切开组(CO组);骨皮质切开+Bio-Oss植入组(BO组);骨皮质切开+BoneCeramic植入组(BC组)。所有大鼠饲养在安徽医科大学动物实验室内,动物护理和实验步骤按照安徽医科大学动物护理和使用委员会指南进行。
1.2.2骨皮质切开术与骨粉材料植入 用1%戊巴比妥钠(4 ml/kg)麻醉大鼠后,在大鼠右上第一磨牙腭侧及近中作切口,翻瓣,暴露右上第一磨牙近中及腭侧牙槽骨骨面。用超声骨刀在生理盐水冲洗下在右上第一磨牙腭侧靠近近中牙槽骨根尖区域处作长5 mm、宽1 mm、深0.5 mm的切口,深至骨髓质。CO组在血液充盈创口后缝合。BO组在进行骨皮质切开术后,在牙槽骨骨面植入Bio-Oss骨粉,待血液充盈后,黏骨膜复位,严密缝合。BC组植入BoneCaremic骨粉,后续处理同BO组。对于两骨粉植入组所植入骨粉量相同,每只大鼠骨粉植入量均为0.05 g。三组大鼠术后均给予抗生素治疗3 d。
1.2.3正畸牙移动模型建立 骨皮质切开术当天,用0.2 mm的不锈钢结扎丝将镍钛闭合弹簧圈固定在右上颌第一磨牙和上颌2个中切牙上,激活弹簧,50 N/kg力将磨牙拉向近中(见图1)。为确保稳定性,在上颌中切牙远中尽可能靠龈方各磨出一凹槽使结扎丝通过,并用自凝树脂固定。因啮齿动物的门齿是不断生长的,所以每7 d调整中切牙不锈钢丝结扎位置。在28、60 d分别从三组内随机抽取6只大鼠处死,分离右侧上颌骨第三磨牙至中切牙区域骨段,用甲醛浸泡固定进行micro-CT检测。
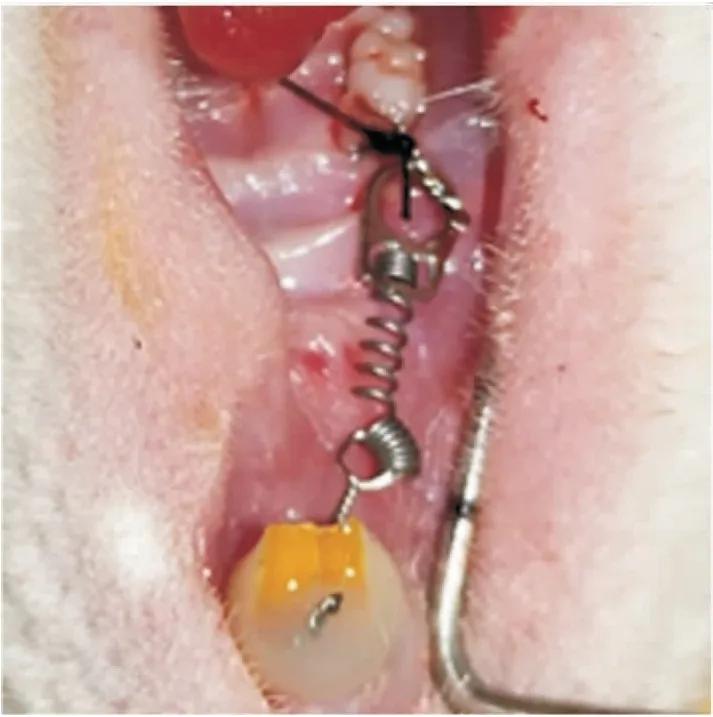
图1 正畸牙齿移动模型
1.2.4micro-CT检测 Micro-CT扫描所有标本后进行三维图像重建,牙齿移动距离是从第一磨牙牙冠最远中到第二磨牙牙冠最近中进行测量(图2A)。为了评估右上第一磨牙腭侧牙槽骨高度丧失(alveolar bone height loss,ABHL)的距离,在重建的三维图像上测量第一磨牙腭侧近中、中间、远中三个点的ABHL距离即测量釉牙骨质界(cemento-enamel junction,CEJ)至牙槽嵴顶(alveolar bone crest,ABC)之间距离,取三者平均值,所有图像都重新定向,使釉牙骨质界和根尖出现在同一个CT切片上(图2B)。在上颌第一磨牙周围绘制相关感兴趣区域(region of interest,ROI),它的范围在垂直方向上为第一磨牙牙槽嵴最高点至根尖点、近远中方向上为第一磨牙最近中点至最远中点,颊舌侧方向上为牙槽骨颊侧骨板至舌侧骨板所形成的区域(图2C),随后进行该区域骨体积分数(bone volume fraction,BVF)测量,BVF=骨骼的矿化组织/感兴趣区域的总体积。
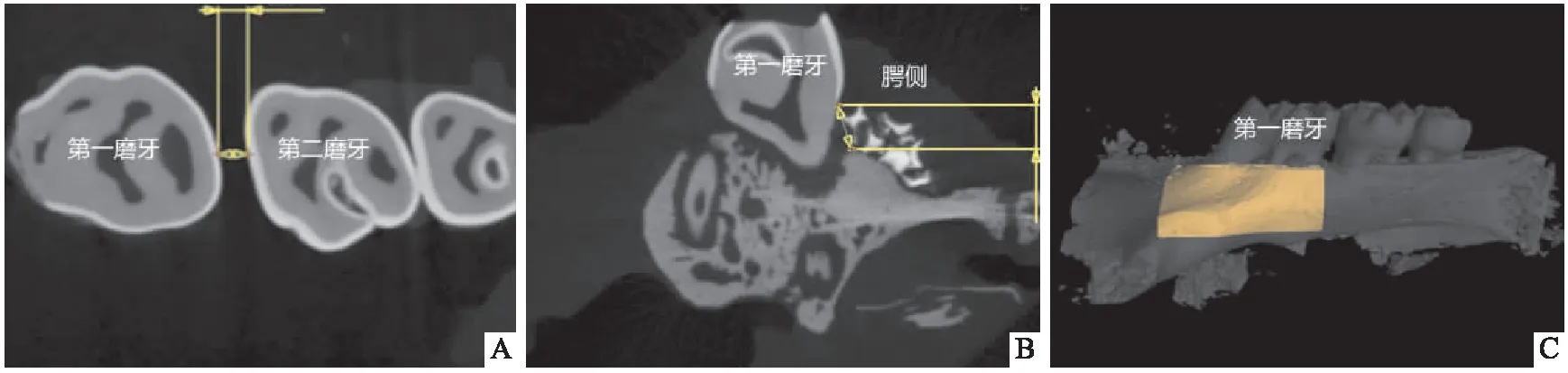
图2 Micro CT正畸牙齿分析
1.3 体外实验
1.3.1骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分离培养 将3周龄大鼠脱颈处死,分离股骨和胫骨,减去两端,露出骨髓腔。用培养液冲洗骨髓腔,反复 3次。收集骨髓悬液置于15 ml离心管中,离心,弃上清液,用培养液重悬细胞,转移至培养皿,置于培养箱中进行培养,3 d换液一次,细胞生长至80%~90%时传代,传代第2~3代用于后续细胞实验。
1.3.2CCK-8检测 将BoneCeramic和Bio-Oss在无菌条件下分别加入到含10%胎牛血清的培养基中浸泡48 h(浓度为0.1 g/ml),过滤获得浸提液。将BMSCs以密度为4 ×104/ml接种在96孔板中,24 h悬浮细胞贴壁后,加入浸提原液,对照组加入正常培养液,3 d换液一次。在第1、3、5 天后进行CCK-8测试。
1.3.3SEM检测 将Bio-Oss和BoneCeramic加入至离心管中,接种密度为1×106/ml的BMSCs,培养3 d后,戊二醛固定过夜,PBS清洗3次。无水乙醇脱水,干燥、镀金,SEM下进行观察。
1.3.4ALP定量检测 将Bio-Oss和BoneCeramic无菌环境下,分别置于6孔板中,BMSCs以密度为5×105/ml接种在6孔板中,培养24 h后,将生长培养液(growth medium,GM)换为成骨培养液(osteogenic medium,OM),3 d换液一次。A组:BMSCs+GM;B组:Bio-Oss+BMSCs+OM; C组:BoneCeramic+BMSCs+OM;D组:BMSCs+OM。在更换培养液后的第4、7、10 天用碱性磷酸酶试剂盒检测细胞培养液上清中碱性磷酸酶的活性水平。
1.3.5q-PCR检测 按照ALP定量检测方法和操作步骤,在第7、14天萃取细胞总RNA,PrimeScriptbTM RT reagent Kit进行逆转录,TB Green® Premix Ex TaqTMⅡ进行q-PCR,检测RUNX-2、OPN 和OCN的水平。以GAPDH为内参,引物序列见表1。

表1 q-PCR引物序列表

2 结果
2.1 牙齿移动距离是否植入骨移植材料及其种类对牙齿移动无影响,CO、BO、BC三组在28、60 d时的牙齿移动距离差异无统计学意义(P>0.05)。见图3。
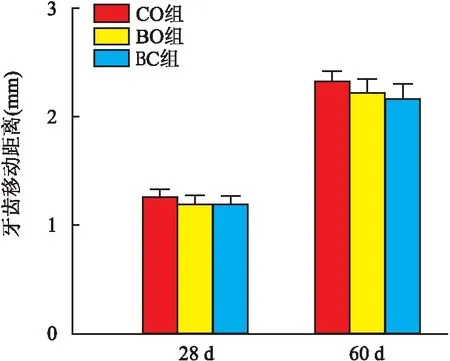
图3 右上第一磨牙移动距离
2.2 ABHL检测结果28 d时CO组ABHL(0.893±0.041)mm明显高于BO、BC组,差异有统计学意义(P<0.05),BO组ABHL(0.763±0.039)mm稍高于BC组(0.735±0.037)mm,但差异无统计学意义。60 d时CO组ABHL(1.318±0.038)mm明显高于BO、BC组,差异有统计学意义(P<0.05),BO组ABHL(0.828±0.037)mm高于BC组(0.761±0.036)mm,差异有统计学意义(P<0.05)。见图4。
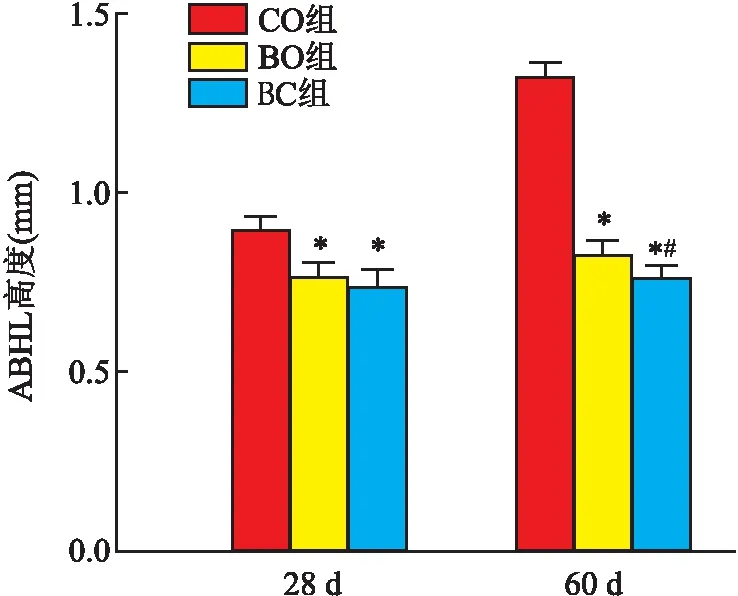
图4 ABHL高度
2.3 BVF测量结果与CO组比较,在28、60 d时BO、BC组BVF升高,差异有统计学意义(P<0.05);60 d时,BC组BVF明显高于BO组,差异有统计学意义(P<0.05)。见图5。

图5 相关区域BVF测量
2.4 BMSCs观察原代时,BMSCs呈圆形,胞体透亮,大小不一,与周围的血细胞相互混杂。3 d换液后可见大量贴壁细胞,9~10 d细胞逐渐融合成片,相互紧密贴附生长。第3代时可见细胞纺锤形,呈典型的漩涡状生长。见图6。

图6 大鼠BMSCs体外培养观察
2.5 骨粉浸提液对BMSCs增殖的影响与CO组比较,在第3、5天时BO、BC组OD值均有所增高,差异有统计学意义(P<0.05) ,且在第5天时BC组略高BO组,但差异无统计学意义(P>0.05)。见图7。
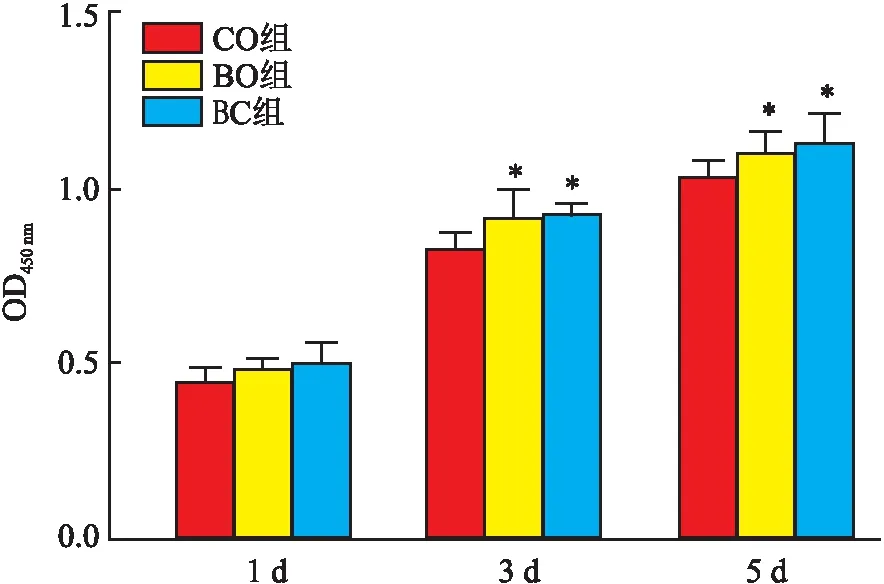
图7 CCK-8检测骨粉浸提液对BMSCs增殖的影响
2.6 BMSCs在骨材料表面的分布情况Bio-Oss表面观察到少数BMSCs,并且细胞与材料贴合不紧密。与Bio-Oss比较,BMSCs在BoneCeramic表面分布更多并且更紧密。见图8。

图8 SEM观察
2.7 ALP活性情况在第4、7、10天时B、C、D组ALP活性均高于A组,差异有统计学意义(P<0.05) 。在第7、10天时B组和C组活性高于D组,且C组高于B组,差异有统计学意义(P<0.05)。见图9。

图9 ALP活性定量检测
2.8 成骨相关基因RUNX2、OPN、OCN的mRNA的表达情况与A组比较,在第7、14天时B、C、D组的成骨相关基因RUNX2、OPN、OCN的mRNA相对水平都显著增高(P<0.05),同时,B、C组高于D组,并且C组高于B组,差异均有统计学意义(P<0.05),见图10。

图10 mRNA相对表达量
3 讨论
成人正畸治疗应在保证牙齿周围有足够健康的牙周组织的前提下,适当的增加牙齿移动的速率。PAOO技术可以加速正畸牙移动,并且通过植骨拓宽了正畸范围。Bio-Oss在PAOO术中作为骨移植材料已有相关文献报道,但本研究希望寻找一种适合PAOO术后正畸牙齿移动的骨移植材料,既可以达到骨增量的效果,又有着合适的降解速率。
CO、BO、BC三组第一磨牙近中移动距离均差异无统计学意义,表明在PAOO术中植入骨粉材料不影响牙齿移动速度。CO组在28、60 d时第一磨牙腭侧ABHL高于BO、BC组而BVF明显低于BO、BC组,这与Brugnami et al[14]认为骨皮质切开(不植骨)牙槽骨高度明显低于骨皮质切开(植骨)结果相吻合,表明大鼠在PAOO术中植入骨材料可以增加术区牙槽骨骨量。在28、60 d时,BO组ABHL高于BC组及BVF明显低于BC组,BO、BC两组之间的差异表明大鼠PAOO术中植入BoneCeramic比植入Bio-Oss更有利于增加术区牙槽骨骨量。这个结果可能是由于BoneCeramic是一种双相磷酸钙,结合了HA的生物相容性和β-TCP的良好性降解速率[15],可以在相对较短的时间内被吸收并被再生骨组织所取代。
体外实验CCK-8、SEM结果表明两种骨粉材料对BMSCs生长无抑制作用; ALP结果表明BMSCs接种于骨粉材料表面上更有利于其成骨分化,这主要是由于骨粉材料三维支架结构加大细胞的生长空间,使得细胞和骨粉材料的接触面积加大,减少接触抑制,从而促进BMSCs的成骨分化。同时细胞接种于BoneCaremic骨粉上比Bio-Oss上更有利于其分化,这一结果表明BoneCaremic材料的空间结构更有利于BMSCs黏附、生长、成骨分化。q-PCR检测结果也证实了这一结论。
经过一系列实验的结果表明,在体内,与Bio-Oss、BoneCeramic更有利于大鼠PAOO术后成骨;在体外,BoneCeramic有着与Bio-Oss同样优异的生物相容性,并且成骨性能更优异。本研究首次在大鼠模型上比较BoneCeramic和Bio-Oss在PAOO术后成骨的效果,为成年人正畸在安全快速移动牙齿的基础上,增加牙槽骨骨量提供新的实验依据和治疗方法。BoneCeramic是一种新型的纯合成骨移植材料,具有较好的骨引导再生作用,可以有效增加牙槽骨骨量,而且具有合适的降解率,未来有望可以运用在正畸临床中。

