肺炎克雷伯菌毒力基因与TLR4表达的相关性研究
王鹤鸣,刘 周,王珊珊,唐 伟,周 强
作者单位:安徽医科大学第二附属医院检验科,合肥 230601
肺炎克雷伯菌(Klebsiellapneumoniae,KP)是社区获得性感染和医院感染最常见的革兰阴性菌,检出率分别可达6.8%和6.69%[1]。KP根据毒力特点可分为经典肺炎克雷伯菌(classicK.pneumoniae,cKP)和高毒力肺炎克雷伯菌(hypervirulentK.pneumoniae,hvKP)。hvKP的毒力显著高于cKP,它可以侵害健康的年轻个体,致死率达3%~32%[2]。目前研究多将荚膜多糖合成相关基因≥2个阳性或铁载体相关基因≥3个阳性的KP菌株定义为hvKP[3]。肺上皮细胞可以分泌Toll样受体(Toll like receptors,TLRs)[4]、细胞因子等以应对肺炎克雷伯菌肺炎(K.pneumoniaepneumonia,KPN)。TLRs接收相关微生物配体信号并启动下游级联反应,其中TLR4参与介导炎症反应、氧化应激、诱导细胞凋亡等,但可能引发过度的炎症反应[5]。该研究拟通过分析临床菌株毒力基因等流行病学特征,进而阐明hvKP及cKP感染的患者体内或细胞水平TLR4的表达水平及其与临床预后的差异,为KPN的临床诊断及治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1病例资料 选取2020年10月—2021年10月间安徽医科大学第二附属医院收治的85例KPN患者,并收集同期收治的55例体检健康者作为对照。收集培养出的KP菌株65株,并收集检出KP患者的血清与临床病历资料。
1.1.2纳入标准 符合《中国成人社区获得性肺炎临床实践指南》[6-7],在痰培养或肺泡灌洗液中检出KP,外周血检查:白细胞总数、中性粒细胞以及C反应蛋白(C-reactive protein, CRP)增高;结合患者X线或CT检查,明确诊断为KPN。
1.1.3实验仪器及试剂 全自动细菌分析仪(法国Biomerieux公司);生物安全柜(力新仪器上海有限公司);细菌多点接种仪(法国Interscience公司);聚合酶链式反应(polymerase chain reaction,PCR)仪器(德国Bi-ometra公司);凝胶成像仪(北京大龙有限公司);PCR引物(上海生工生物公司);酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(武汉伊莱瑞特生物有限公司),人肺泡上皮细胞A549来自中国科学院(上海)。
1.2 方法
1.2.1毒力基因检测 用煮沸法提取各菌株的DNA,采用PCR方法检测8种毒力基因[8],包括:①荚膜多糖合成和调控相关基因rmpA1、rmpA2、magA;②铁载体系统相关基因iucA、kfu、iroN、iroB;③菌毛合成相关基因mrkD[5-6]。毒力基因的引物序列参照表1。各菌株的PCR产物进行凝胶电泳后记录结果并进行比对。

表1 KP毒力基因的PCR引物序列
1.2.2药敏试验 敏感与耐药判读参照美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)M100-S26文件2018年推出的判读标准[9]。采用琼脂平板稀释法测定菌株对于15种常用抗菌药物的最低抑菌浓度。
1.2.3ELISA实验 收集患者外周血清,通过毒力基因检测将实验对象分为cKP组与hvKP组,健康体检者血清作为健康对照组,采用ELISA方法测定两实验组及对照组外周血清TLR4的表达水平,检测过程均严格按照试剂盒说明书及仪器操作指南进行。
1.2.4KP侵染A549细胞实验 A549细胞用含有10%胎牛血清和青霉素-链霉素的1640培养基于37 ℃、5%CO2箱中培养。当细胞生长至80%~90%密度时,铺12孔板,更换为不含双抗的培养基。
实验将临床培养鉴定出的hvKP、cKP两种菌株,分别于哥伦比亚血琼脂平板上过夜生长后,刮取单个菌落于LB培养基中,37 ℃温箱中摇动培养,分光光度计测量600 nm吸光度=0.35,此时细菌处于生长指数期,10 000 r/min离心15min,无菌生理盐水清洗重悬,通过稀释涂板法计菌落数量,在A549细胞12孔板中,每孔加入4 μl菌液,测得MOI=100 ∶1。
1.2.5qRT-PCR 在12孔板中使用hvKP、cKP分别侵染A549细胞,设立未感染的空白细胞为对照组,在CO2培养箱中培养6 h后,收集细胞,用TRIzol试剂提取细胞RNA,TLR4引物序列:上游5′-AATCTAGAGCACTTGGACCTTTCC-3′,下游5′-GGGTTCAGGGACAGGTCTAAAGA-3′。在10 μl反应体系中使用1 μl总RNA进行qRT-PCR反应。采用比较阈值循环(CT)方法,通过计算与内参基因GAPDH比值来确定目的基因的表达水平。每组重实验复3次。
1.2.6临床严重程度及预后评分 根据医院病历系统获取病人基本信息与临床特征如年龄、体温、脉搏、呼吸频率、血压、PH、血尿素氮、血糖、血钠、红细胞比积、氧分压及相关影像学表现等,根据临床PSI评分[10]及CURB-65评分[11]对KPN患者进行分级,分析患者血清TLR4水平与临床肺炎评分之间的相关性。本研究已获安徽医科大学第二附属医院伦理委员会批准。

2 结果
2.1 毒力基因检测结果hvKP组中毒力基因阳性率最高的前3种为:kfu(100%),rmpA1(87.8%),rmpA2(80.5%)。与cKP组相比,毒力基因有统计学差异的是rmpA1(P=0.000),rmpA2(P=0.000),magA(P=0.000),ironB(P=0.000)。其他基因虽差异无统计学意义,但在hvKP组中的阳性率均高于cKP组(表2)。hvKP及cKP基因电泳条带结果见图1。
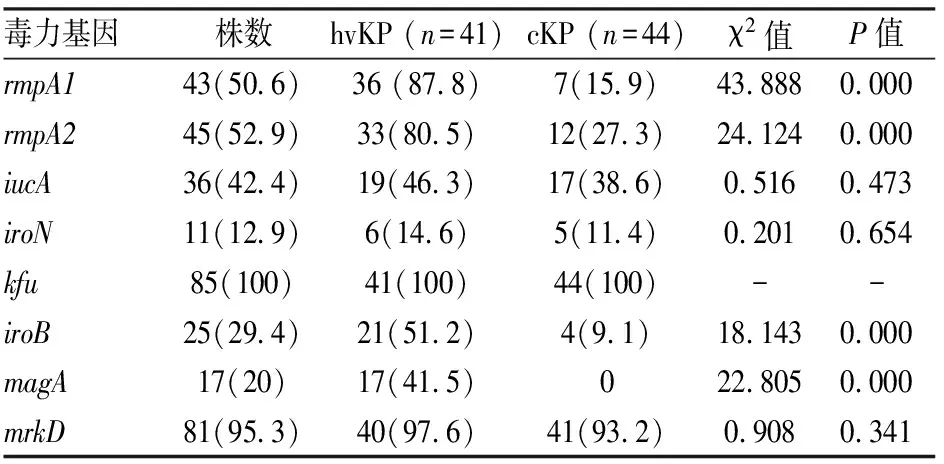
表2 hvKP和cKP的毒力基因比较[n(%)]
2.2 药敏实验结果药敏结果显示本院所收集肺炎克雷伯杆菌对替加环素最敏感,敏感率为97.6%;其次是阿米卡星和阿莫西林/克拉维酸,敏感率分别为80.0%及72.9%。在hvKP中对替加环素最敏感,敏感率为95.1%。cKP的头孢曲松、厄他培南、左氧氟沙星、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦耐药性明显高于hvKP(表3)。

表3 hvKP和cKP的抗生素敏感性比较[n(%)]
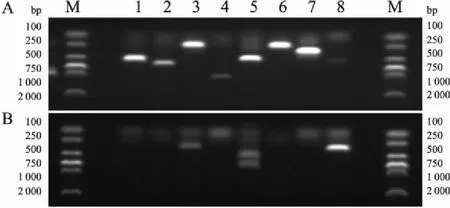
图1 KP毒力基因电泳条带结果
2.3 ELISA实验结果通过对KP菌株毒力基因检测,将收集的临床血清分为hvKP组及cKP组。血清TLR4的ELISA结果显示,相比cKP组,hvKP组的血清TLR4水平明显高于健康对照组(图2),差异有统计学意义(P<0.05)。
2.4 qRT-PCR实验结果qRT-PCR法检测显示,相比于空白细胞对照,在hvKP侵染6 h后的A549细胞中,TLR4的mRNA表达水平明显升高,而在cKP侵染的细胞中TLR4升高不明显(图3),差异有统计学意义(P<0.05)。
2.5 临床肺炎评分预后分析对KPN患者根据临床肺炎评分进行分级后,结果显示患者血清TLR4水平与PSI评分呈正相关性,PSI评分越高的患者,血清TLR4水平也越高(图4A);在CURB-65评分中,2分的患者血清TLR4水平高于0~1分的患者(图4B),差异有统计学意义(P<0.05)。应用Spearman相关分析表示,血清TLR4水平与PSI、CURB评分均存在正相关关系(r:0.692、0.466;P<0.001)。
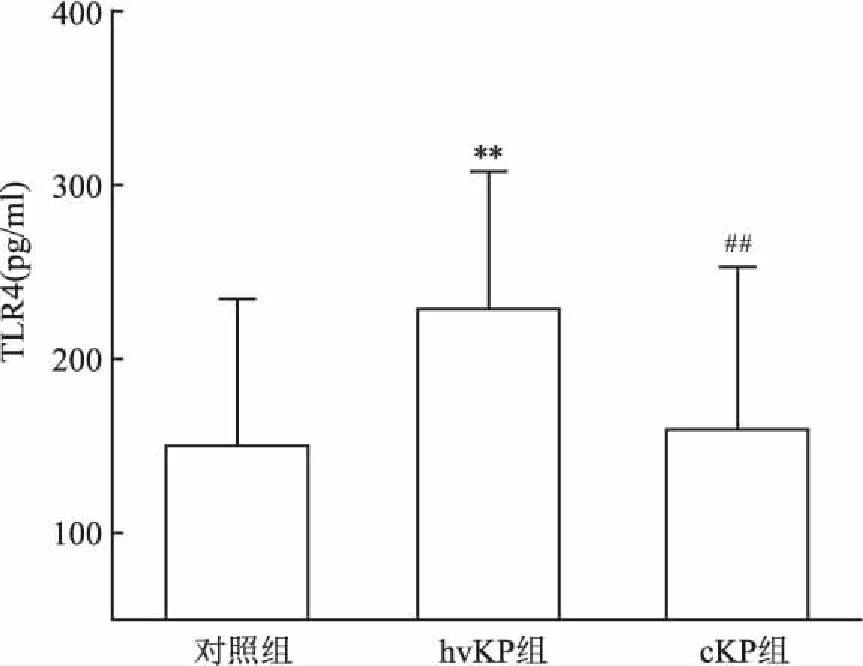
图2 hvKP、cKP感染的患者及健康体检组血清中TLR4的表达量
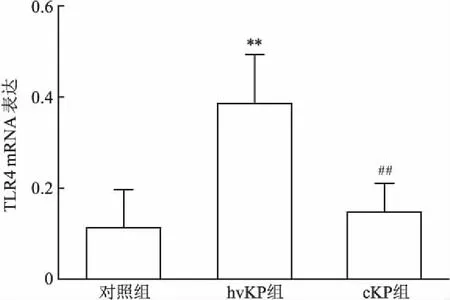
图3 TLR4在mRNA水平上的表达
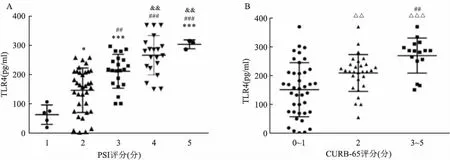
图4 血清TLR4水平与各肺炎评分的相关性
3 讨论
KP是与人类关系密切的一种机会性致病菌[12],在免疫功能低下的人群中通过铁摄取系统、CPS、LPS等多种毒力因子,可以引起以呼吸道为主的多部位的感染。目前,治疗KP感染的常用药物有碳青霉烯类(例如亚胺培南,美罗培南)、内酰胺类及喹诺酮类等,但近年来KP的耐药率逐渐升高[13]。此外,hvKP感染的发病率和病死率也存在持续上升趋势,并且目前hvKP的明确诊断主要依靠细菌培养及基因检测,需要较长的时间,给临床治疗也带来了严峻的挑战。hvKP可产生大量的荚膜多糖,并且拥有较强的抗吞噬作用以及抗杀菌作用,可以促进炎症反应以及加重感染。荚膜多糖是hvKP重要的毒力因子,主要通过抗巨噬细胞吞噬作用、抵抗抗菌肽等作用从而帮助细菌免疫逃逸[4]。目前hvKP的分子标志物诊断仍存在争议,本研究通过对收集的临床菌株的毒力基因检测,显示rmpA1、rmpA2及magA基因联合诊断hvKP的特异性及准确性较高,可作为临床hvKP检测的重要分子标志物。
从呼吸道快速清除入侵细菌对于有效的宿主防御机制对抗细菌性肺炎具有重要意义。除了直接的细菌吞噬和杀伤外,肺上皮细胞表面的TLR4识别病原菌后,可以趋化并刺激中性粒细胞等,激活免疫反应[14],并促进CRP等的分泌,TLR4水平的上升并不是单独的,与机体的炎性反应有密切的关联。本研究证实hvKP侵染的人肺泡上皮细胞中TLR4表达水平明显上升,提示肺上皮细胞对hvKP的感染做出反应并过表达TLR4介导免疫反应等对抗感染。
通过对KPN患者血清中TLR4水平的检测,显示与hvKP感染的患者TLR4水平相比,cKP感染的患者及健康体检者有明显的升高,提示TLR4可能在毒力基因的介导下参与了hvKP菌株感染人体的防御过程。根据对患者临床预后的肺炎评分分级,结果显示血清TLR4水平与PSI评分及CURB-65评分呈正相关性,TLR4水平越高的患者由评分预测的临床预后情况越差,提示TLR4可作为衡量患者体内的病程进展程度的指标,血清TLR4水平可能作为hvKP感染的患者诊断和评估预后的潜在生物标志物。并且猜测,通过抑制TLR4可以减轻机体由于炎症反应带来的损伤,但需进一步实验研究毒力基因与蛋白通路之间的联系以及起到保护作用的机制。

