miR-146a通过调节IRAK1影响急性胰腺炎炎症自噬机制的研究
郑传明,纪 忠,徐志鹏,杜召辉,窦贺贺,姜 海,王振杰
作者单位:蚌埠医学院第一附属医院急诊外科,蚌埠 233000
急性胰腺炎(acute pancreatitis,AP)是一种常见的外科急腹症,其发病率和病死率都很高,目前对其发病机制知之甚少,也没有特异性或有效的治疗方法[1-2]。多项研究[3-4]表明,AP的发病机制与自噬失调和持续的炎症密切相关。中文名小RNA(microRNA,miRNA)是长度为18~25 nt的单链非编码小分子RNA,近年来其在AP中的作用受到了广受关注。相关研究[5-7]表明,miR-146a在炎症和先天性免疫应答中起着重要的调节作用,且有个别报道[8]显示miR-146a有作为AP预后标志物的潜力,但其在AP中的具体作用机制尚未见研究。该研究利用牛磺石胆酸3磷酸盐(taurolithocholic acid 3-sulphate,TLCs)处理AR42J细胞建立AP模型,探究miR-146a在AP中的作用及机制,为AP的机制研究提供新思路,更为AP精准诊疗提供潜在靶点。
1 材料与方法
1.1 材料TLCs(美国Sigma-Aldrich公司),miR-146a mimic及阴性对照(miR-ctrl)、si-IRAK1及阴性对照(si-ctrl)(广州锐博生物技术有限公司),引物(苏州金唯智生物科技有限公司),IL-1受体相关激酶1(IRAK1)、actin抗体(美国Abcam公司)、LC3、p62抗体、兔二抗(美国CST公司),白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(杭州联科生物技术有限公司),Ham's F-12K培养基、血清(美国Gibco公司)。逆转录试剂盒及qPCR试剂盒(日本Takara公司)。
1.2 方法
1.2.1细胞培养及AP模型构建 细胞复苏于细胞培养瓶中,用含有20%的胎牛血清的Ham's F-12K培养基培养,细胞培养箱中设置的条件为37℃、5%CO2。细胞传3代后,在细胞处于对数生长期时进行细胞功能学实验。将细胞种于6孔板内,分别加入100、200 μmol/L TLCs,40 min后收集细胞进行后续实验。
1.2.2RNA抽提及逆转录 将处理好的细胞均匀地铺在培养板内,培养适当时间后弃去培养基,用PBS洗1次,每孔加入1 ml TRIzol,充分收集细胞,加入200 μl氯仿,充分混匀后室温静置5 min;4℃、12 500 r/min离心15 min;吸取上清液,转移至新的1.5 ml离心管中,加入等体积异丙醇,冰上静置10 min,4℃、12 500 r/min离心10 min;弃上清液,加入1 ml预冷好的75%乙醇溶液,重悬沉淀,4 ℃、12 500 r/min离心5 min,弃上清液,待沉淀变成无色透明状,加入适量的RNase-free水溶解RNA,并检测各组浓度。RNA逆转录及荧光实时定量PCR的步骤参照试剂盒说明书。引物序列见表1。

表1 引物序列
1.2.3蛋白提取 将处理好的细胞均匀地铺在培养板内,培养适当时间后弃去培养基,用PBS洗1次,每孔加入300 μl细胞裂解液,冰上静置15 min,4 ℃、13 000 r/min离心15 min;吸取上清液,转移至新的1.5 ml离心管中,留取一部分用来测蛋白浓度,剩余液体按照比例加入5×loading,煮10 min,放入-20 ℃储存备用。
1.2.4细胞转染 细胞密度长至培养板孔的80%~90%,进行转染操作。首先用50 μl opti-medium稀释1 μl Lipofectamine 3000,再用50 μl opti-medium稀释500 ng质粒,加入1 μl T3000;充分混匀后,将质粒和T3000混合物滴加到Lipofectamine 3000稀释液中,室温静置15~20 min,滴加到24孔板培养基中。miRNA的转染方法参照质粒转染方法。
1.2.5荧光素酶报告基因实验 构建pMIR-IRAK1 wt 3’UTR及结合位点突变pMIR-IRAK1 mut1 和mut2 3’UTR质粒。将上述3种质粒分别转染到293T细胞中,再次转染miR-146a mimics或阴性对照,检测荧光素酶活性。

2 结果
2.1 TLCs诱导AR42J细胞炎症采用不同浓度(0、100、200 μmol/L)TLCs诱导AR42J细胞,使细胞发生炎症反应,检测促炎因子TNF-α和IL-6的mRNA及蛋白水平的变化。结果表明,在用不同浓度TLCs处理的AR42J细胞中,TNF-α和IL-6的mRNA表达水平升高(图1A)。ELISA分析显示,在不同浓度TLCs刺激的AR42J细胞培养上清液中,TNF-α和IL-6的蛋白水平也显著增加(图1B)。
2.2 TLCs抑制miR-146a促进IRAK1表达并诱导AR42J细胞自噬用不同浓度的TLCs处理AR42J细胞,通过qPCR和Western blot测定miR-146a和IRAK1的表达。结果显示:与对照组相比,用100 μmol/L TLCs处理AR42J细胞,miR-146a表达降低率为(40±1.22)%,用200 μmol/L TLCs处理AR42J细胞,miR-146a表达降低约(60±0.98)%(图2A);但是,用100、200 μmol/L TLCs处理AR42J细胞,IRAK1 mRNA水平是对照组的(2.5±0.12)倍和(4±0.08)倍,蛋白水平也同样有上升(图2B、C)。表明miR-146a和IRAK1可能在AP的发展中起重要作用。此外,在用TLCs处理的AR42J细胞中,自噬相关标志物LC3-Ⅱ/Ⅰ比值和p62的表达水平也有所变化,即LC3-Ⅱ/Ⅰ比值增加、p62减少(图2D),提示TLCs可以抑制miR-146a、促进IRAK1表达并诱导AR42J细胞发生自噬。
2.3 过表达miR-146a可以抑制TLCs诱导的炎症和自噬为了研究miR-146a在AP中的功能作用,用Lipofectamine 3000分别向AR42J细胞转染miR-146a mimic和miR-control,然后用TLCs(200 μmol/L)处理。qPCR和ELISA分析结果表明,在未加TLCs处理的条件下,过表达miR-146a未引起显著的IL-6和TNF-α变化。在TLCs处理条件下,过表达miR-146a显著降低IL-6和TNF-α的mRNA和蛋白水平(图3A、B)。自噬试验结果显示,在转染miR-control的处理条件下,TLCs引起LC3-Ⅱ/Ⅰ比值升高和p62表达下降,该结果与前述结果一致;与转染miR-control且添加TLCs处理相比,过表达miR-146a,即转染miR-146a mimic+TLCs处理,显著降低LC3-Ⅱ/Ⅰ比值且上调p62表达(图3C)。以上结果说明,上调miR-146a可以抑制由TLCs诱导的炎症和自噬应答。
2.4 敲减IRAK1可以抑制TLCs诱导的炎症和自噬为了进一步研究IRAK1在AP中的功能,在AR42J细胞中转染si-IRAK1或siRNA-control,然后用TLCs处理(200 μmol/L)。Western blot结果表明,与siRNA-control组相比,si-IRAK1组中IRAK1的蛋白表达下降(图4A)。敲减IRAK1显著降低了TNF-α和IL-6的mRNA和蛋白水平(图4B、C)。此外,敲减IRAK1减弱了TLCs诱导的LC3-Ⅱ/Ⅰ比值升高和p62表达降低(图4D)。该部分结果显示,敲减IRAK1与上调miR-146a表达对TLCs诱导的AP细胞模型中具有相似的作用。
2.5 miR-146a在AR42J细胞中靶向IRAK1为了进一步探索AP中miR-146a与IRAK1之间的关系,在AR42J细胞中过表达miR-146a,再用TLCs处理细胞,Western blot和qPCR检测IRAK1表达。结果显示:miR-146a可以明显抑制IRAK1表达,TLCs可以促进IRAK1表达,同时加入miR-146a和TLCs,与只加TLCs组相比,IRAK1表达量也显著降低(图5A),这说明miR-146a可以抑制IRAK1的表达。为了更深入探究miR-146a与IRAK1靶向关系,通过Targetscan在线网站预测了miR-146a与IRAK1 3′UTR 的潜在结合位,并构建野生型和结合位点突变型质粒,通过荧光素酶实验进一步验证miR-146a与IRAK1靶向关系。结果表明,miR-146a的过表达强烈降低了IRAK1-wt的萤光素酶活性,而转染miR-146a后,IRAK1-mut的萤光素酶活性未受到明显影响(图5B、C)。综上所述,这些结果表明miR-146a可以直接靶向IRAK1。
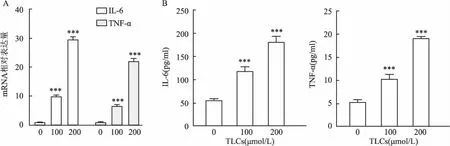
图1 TLCs诱导AR42J细胞炎症
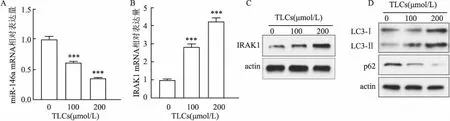
图2 TLCs抑制miR-146a促进IRAK1表达并诱导AR42J细胞自噬

图3 过表达miR-146a抑制TLCs诱导的炎症和自噬
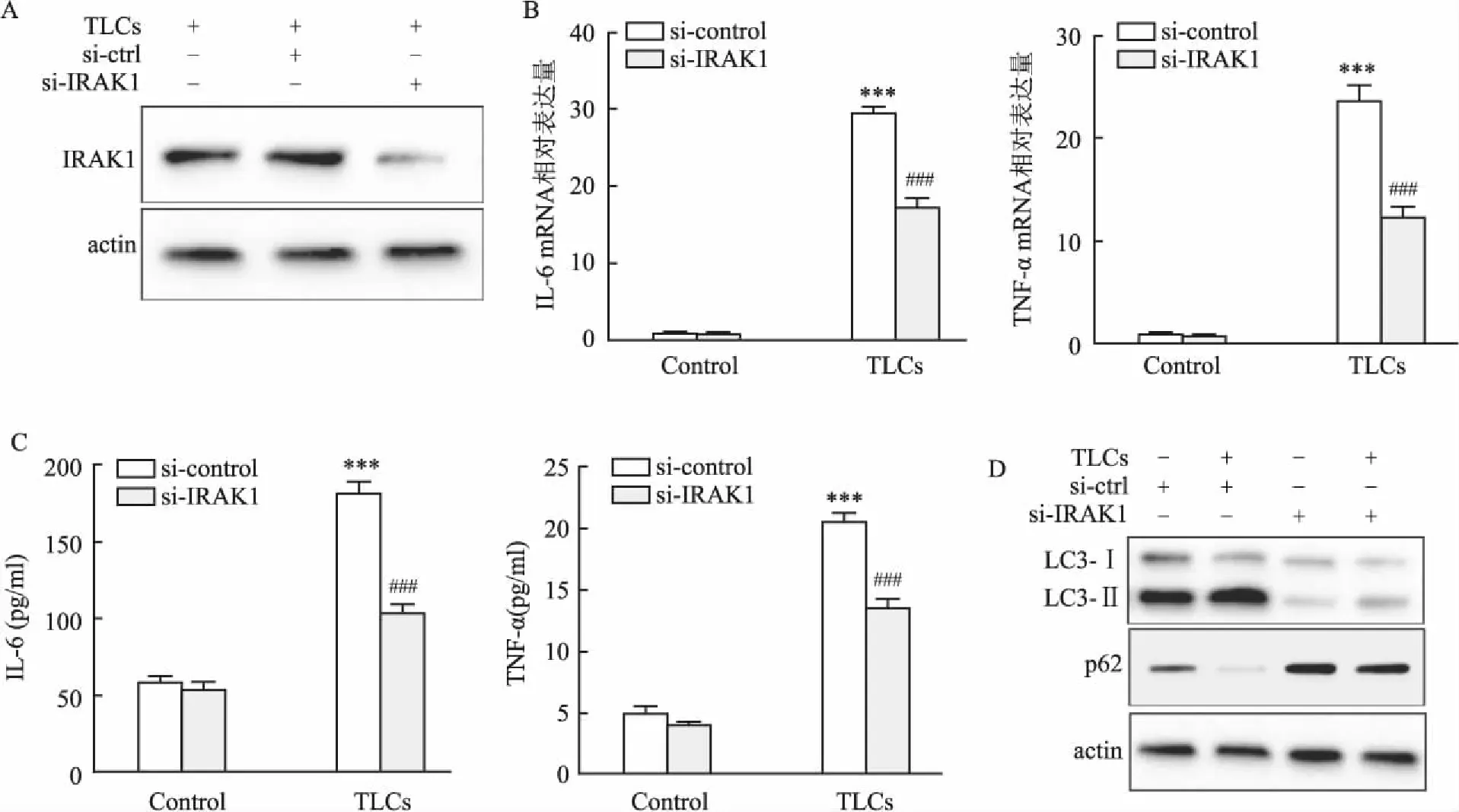
图4 敲减IRAK1可以抑制TLCs诱导的炎症和自噬
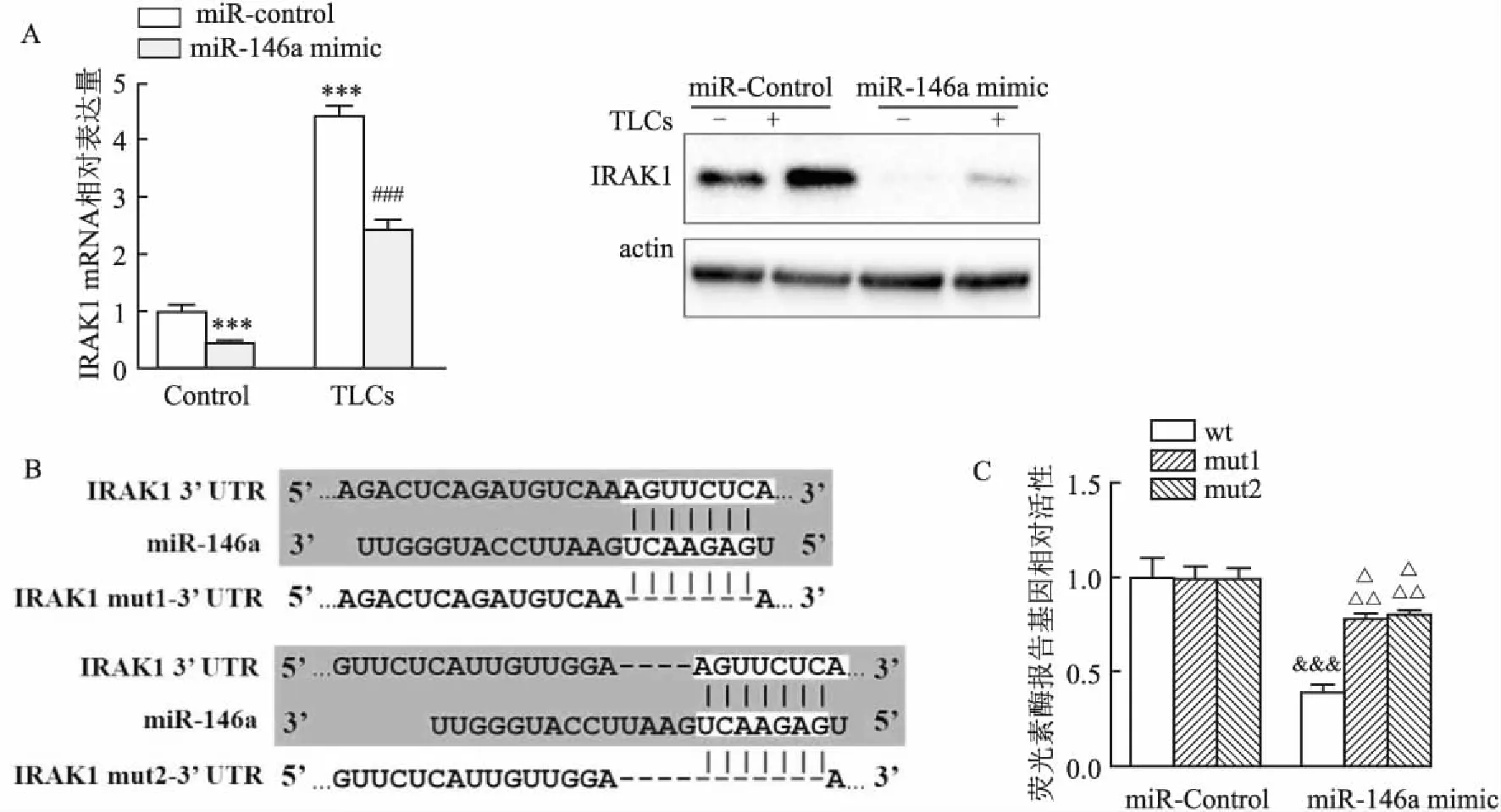
图5 miR-146a在AR42J细胞中靶向IRAK1
3 讨论
AP具有不同的临床病程。大多数患者表现为轻度AP,具有自限性,通常在1周内消退。大约20%的患者发展为中度或重度AP,伴有胰腺或胰周组织坏死,或是器官衰竭,亦或两者兼有,病死率高达 20%~40%[1-2]。更为重要的是,目前,临床尚无可以改变AP疾病进程的药物。因此,深入研究AP的发病机制,可能为AP的机制研究提供新思路,更可能为其治疗提供新的靶点。
有研究[3]显示,AP会导致腺泡细胞的细胞器(内质网、线粒体和溶酶体-自噬系统)受损,并使细胞器功能紊乱,进而导致胰蛋白酶原和炎症通路的激活。自噬是细胞内主要的分解代谢过程,细胞通过该过程消除受损、有缺陷或不需要的细胞器、蛋白质和脂质等,并产生能量满足细胞代谢需要。相关研究[9]显示,在转基因GFP-LC3小鼠中,GFP-LC3的表达对肝、肺和脾的自噬影响很小或没有影响,但可以显著增加胰腺腺泡细胞中的自噬体形成。另一项研究[10]显示,抑制AP小鼠的自噬可以改善小鼠的预后。本研究也表明,在AP的细胞模型中,随着TLCs浓度的逐渐增加,LC3-Ⅱ/Ⅰ比值逐渐升高、p62逐渐降低,同时,在炎症和先天性免疫应答中起着重要负性调节作用的miR-146a表达量也逐渐降低。上调miR-146a可以显著抑制TLCs诱导的AR42J细胞自噬。说明miR-146a可调控TLCs诱导的AR42J细胞自噬,且miR-146a的表达与AP的进展密切相关。
众所周知,巨噬细胞在炎症反应中起重要作用。巨噬细胞产生各种细胞因子和炎性介质,如IL-1β、IL-6、IL-8和TNF-α,它们可损伤附近组织和远处器官。抑制胰腺炎相关巨噬细胞的活化不仅减轻了胰腺本身的病理损伤,而且在一定程度上减少了全身炎症反应综合征和多器官功能衰竭的发生[11]。研究[12]显示通过腹腔灌洗清除巨噬细胞后AP小鼠的TNF-α、IL-6和IL-10血清水平降低。本研究显示,TLCs可以促进炎症因子IL-6和TNF-α分泌,且随着TLCs的浓度逐渐增加,IL-6和TNF-α的表达量也逐渐增加。同时,TLCs可抑制AR42J细胞内miR-146a的表达、促进IRAK1表达。IRAK1是介导的NF-κB活化途径的重要元件,NF-κB对于炎性反应和介导炎性因子(例如TNF-α、IL-1β和IL-6)的释放是重要的,并可加剧炎性损伤[13]。NF-κB在AP相关巨噬细胞激活过程中起重要作用[14]。本研究在AR42J细胞中过表达miR-146a,显著抑制TLCs诱导的炎症及IRAK1的表达。结合荧光素酶报告基因实验,进一步证明了miR-146a可以靶向调控IRAK1的表达。这些结果提示miR-146a和IRAK1极可能是AP治疗的潜在靶点。

