白藜芦醇基于PI3K/Akt通路对人结肠癌细胞HCT-116凋亡的影响
郎超
(山西药科职业学院,山西太原 030031)
白藜芦醇(Resveratrol,Res)是一种广泛存在于花生、葡萄等植物中的天然多酚类化合物,是植物在受到外界刺激时自身合成的一种植物抗毒素,可用于对抗外伤、细菌、感染、紫外线等外界压力。1940年,日本人Tokaoka首次从毛叶藜芦的根中分离得到白藜芦醇,目前多项研究表明白藜芦醇具有抗氧化、改善微循环、抗炎等广泛的生物活性和药理学特性[1-3]。
近年来的研究还证实白藜芦醇能够通过调节肿瘤细胞内多种靶点和信号途径表现出明显的抗肿瘤作用[4-7]。PI3K/Akt信号通路广泛参与肿瘤细胞的增殖、凋亡、代谢、侵袭等活动,故其在肿瘤细胞中常会过度表达或被异常激活[8]。白藜芦醇可通过调节细胞内PI3K/Akt信号通路进而调控下游分子影响细胞的增殖[9]。因此,本研究选取PI3K/Akt信号通路研究白藜芦醇对人结肠癌细胞HCT-116凋亡的影响及其相关分子机制,为相关疾病的治疗提供数据支撑。
1 材料与方法
1.1 主要试剂
白藜芦醇、DMSO、MTT试剂,Sigma-Aldrich(上海)贸易有限公司;F-12/DMEM培养基,美国Gibco公司;1%青-链霉素,北京索莱宝科技有限公司;10%胎牛血清,生工生物工程(上海)股份有限公司;细胞裂解液、BCA蛋白定量试剂盒,上海碧云天生物技术有限公司;Caspase-3、PI3K、Akt和β-actin抗体,美国CST公司;Bcl-2、Bax抗体,上海碧云天生物技术有限公司。
1.2 主要仪器
Galaxy 170 S二氧化碳培养箱,德国Eppendorf公司;MX2型微孔板振荡器,韩国FINEPCR公司;Infinite F50型酶标仪,瑞士Tecan公司;TG-16型离心机,上海卢湘仪离心机仪器有限公司;BD FACSCalliburⅡ型流式细胞仪,美国BD公司;PowerPac HC型电泳仪,美国Bio-Rad公司。
1.3 细胞培养
HCT-116(人结肠癌上皮细胞株)接种于加有10%胎牛血清及1%青-链霉素的F-12/DMEM培养基中,置于37 ℃、湿度饱和及5% CO2培养箱中培养,观察细胞生长情况定时换液。
1.4 MTT实验
选取对数生长期的HCT-116细胞,以每孔2×103个接种于96孔板中,观察其贴壁后,设置对照与不同浓度(25 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L)的白藜芦醇组,每组设5个复孔。分别孵育12 h、24 h、36 h后取出,每孔更换100 μL新鲜培养基,再加入20 μL MTT(5.0 mg/mL),继续培养4 h。于避光环境下,弃去培养液,加DMSO 150 μL,低速震荡10 min。
使用酶标仪在570 nm波长处测得各孔的吸光度。按照公式(1)计算不同浓度白藜芦醇对细胞增殖的抑制率,实验重复3次。

式中,At为t实验组吸光度平均值,A0为对照组吸光度平均值。
1.5 细胞凋亡检测
选取对数生长期的HCT-116细胞,以每孔1×105个接种于6孔板中,观察其贴壁后,设置对照与不同浓度(50 μmol/L、100 μmol/L)的白藜芦醇组,培养24 h,收集细胞,1 000 r/min离心10 min,弃去上清,加入1×结合缓冲液100 μL重悬细胞沉淀,并转移至流式细胞管中,加Annexin V-FITC和PI各5 μL,避光染色15 min;加入 1×结合缓冲液400 μL,流式细胞仪检测,Annexin V-FITC荧光通道为FL1-H,PI荧光通道为FL2-H,获取细胞数量为15 000个/样,不足15 000个收取全部细胞;最后于流式细胞仪上机检测,结果用FlowJo 10.8.1软件分析,统计细胞凋亡百分率。
1.6 Western Blot实验
将不同浓度白藜芦醇处理过的HCT-116细胞收集起来,裂解提取蛋白,BCA法测得蛋白浓度后制样。取20 μL样品进行SDS-PAGE电泳分离,转至PVDF膜,5%脱脂奶粉封闭2 h。接对应蛋白一抗4 ℃孵育过夜,接二抗室温孵育2 h。将杂交膜上多余抗体清洗干净后,滴加发光液曝光定影,条带记录相应蛋白表达情况。以β-Actin作为内参,用Image J 1.8.0进行灰度分析。
2 结果与分析
2.1 白藜芦醇对HCT-116细胞增殖的抑制作用
通过MTT实验检测了白藜芦醇对HCT-116是否存在增殖抑制效应,如图1所示。与对照组相比,随着作用时间的延长及白藜芦醇浓度的增大,细胞增殖抑制率明显升高,且各组差异具有统计学意义(P<0.05),表明白藜芦醇对HCT-116细胞的增殖抑制存在浓度和时间依赖。

图1 白藜芦醇对HCT-116细胞增殖的影响
2.2 白藜芦醇对HCT-116细胞凋亡的影响
用流式细胞仪检测白藜芦醇对HCT-116细胞是否存在促凋亡效应,结果如图2所示。对照组HCT-116细胞的凋亡率为2.61%(早期凋亡0.54%,晚期凋亡2.07%);实验组随白藜芦醇浓度增高,HCT-116细胞凋亡率增加,50 μmol/L和 100 μmol/L白藜芦醇组HCT-116细胞凋亡率分别为16.80%(14.70%+2.10%)、43.98%(39.10%+4.88%),分别较对照增加14.19个百分点和41.37个百分点。结果表明,白藜芦醇可有效促进HCT-116细胞凋亡。
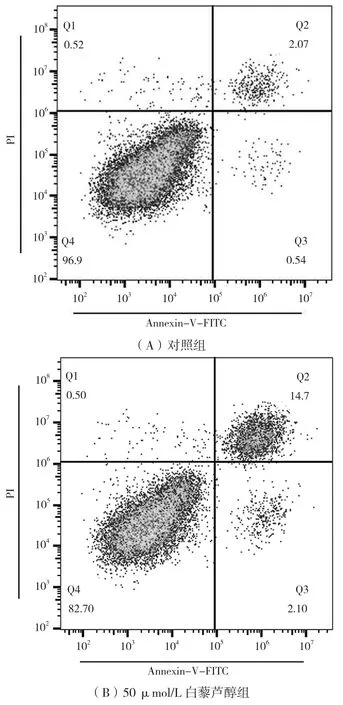
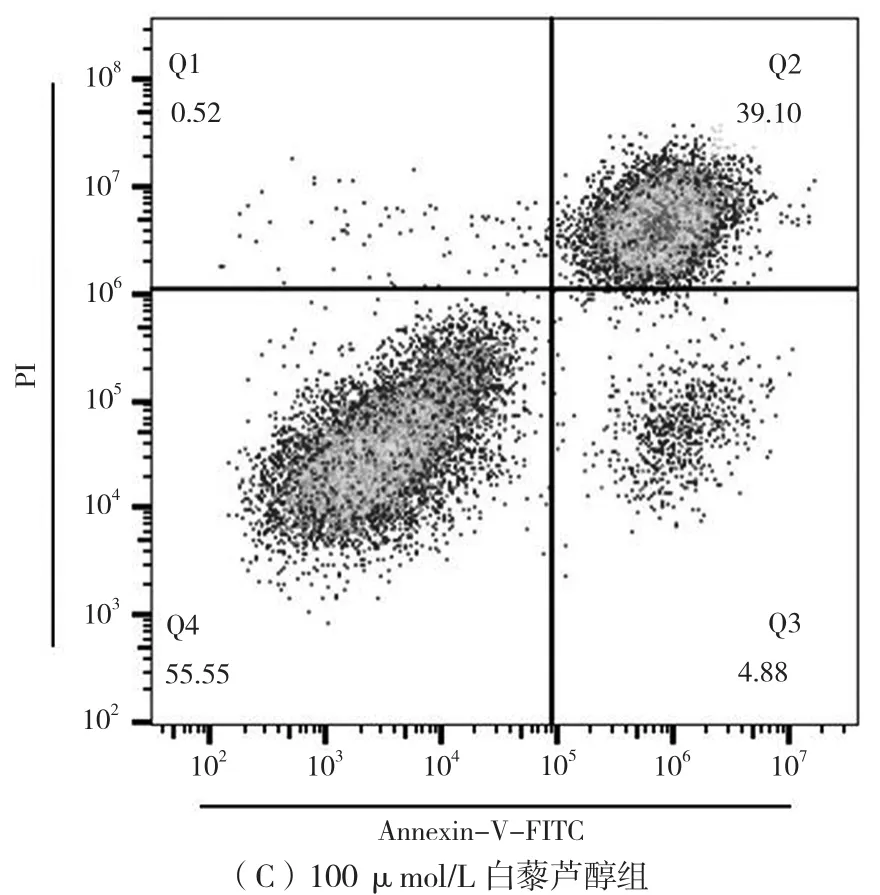
图2 不同浓度白藜芦醇对HCT-116细胞凋亡的影响
2.3 白藜芦醇对HCT-116细胞内凋亡相关蛋白表达的影响
经 25 μmol/L、50 μmol/L、100 μmol/L 白藜芦醇处理24 h后,HCT-116细胞内Caspase-3、Bcl-2、Bax的表达情况如图3所示,Akt、PI3K的表达量如图4所示。灰度分析结果表明(图5),与对照组相比,实验组HCT-116细胞中Caspase-3的表达明显上调(P<0.05),Bcl-2表达量显著下调(P<0.05),Bax的表达明显上调(P<0.05),且呈浓度依赖关系。与对照组相比,p-Akt/Akt、p-PI3K/PI3K比值均显著降低,差异具统计学意义(P<0.05)。PI3K/Akt通路的激活对下游的抗凋亡蛋白Bcl-2及促凋亡蛋白Bax有明显影响[10],Bcl-2和Bax之间的平衡对细胞凋亡的调控起关键作用[11]。说明白藜芦醇有效抑制了PI3K/Akt通路的激活,并影响促凋亡蛋白Bax高表达,抗凋亡蛋白Bcl-2表达下调,介导HCT-116的凋亡诱导效应。

图3 白藜芦醇对HCT-116细胞内Caspase-3、Bcl-2、Bax蛋白表达影响

图4 白藜芦醇对HCT-116细胞内Akt、PI3K蛋白表达及磷酸化的影响
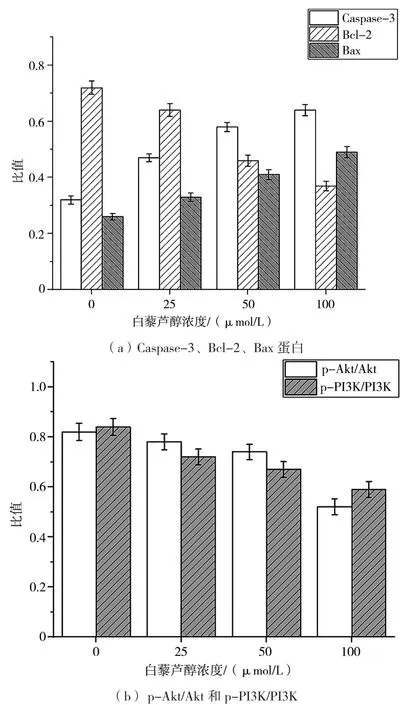
图5 白藜芦醇对HCT-116细胞内相关蛋白表达的灰度分析图
3 结论
本研究初步探讨了白藜芦醇基于PI3K/Akt通路对HCT-116细胞凋亡的影响。结果发现,白藜芦醇可通过抑制PI3K/Akt信号通路的激活,在肿瘤细胞内有效上调Caspase-3和Bax的表达并下调Bcl-2的表达,从而诱导肿瘤细胞发生凋亡,且其作用效果呈浓度和时间依赖性,为白藜芦醇抗肿瘤机制的研究提供了新的参考。

