绵羊梅迪- 维斯纳病毒CA 蛋白可溶性表达、多克隆抗体制备及鉴定
李慧萍,陈思旭,张 良,史晓娜,刘淑英
(1.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018;2.农业农村部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018;3.内蒙古自治区基础兽医学重点实验室,内蒙古 呼和浩特 010018)
绵羊梅迪-维斯纳病 (maedi-visna disease,MVD) 的病原为梅迪-维斯纳病毒 (maedi-visna virus,MVV)[1]。 感染MVV 的病畜以呼吸系统疾病为主要临床特征,3 岁以上病畜有明显表现,少数病畜没有临床症状但终身携带病毒[2]。 MVD 广泛流行于各养羊大国,近年来印度、墨西哥也相继报道有MVD 的流行[3-4]。 1966 年我国新疆维吾尔自治区和田地区于田羊场首次发现MVD[5],2019 年内蒙古农业大学兽医学院动物生理学实验室研究人员发现在内蒙古地区存在MVD 的流行[6]。 目前,MVD 尚无有效的治疗方法, 尽管国内外都开展了针对MVV 疫苗的研发,然而效果较差[7-8]。
MVV 为有囊膜的单股正链RNA 病毒, 含3个逆转录病毒共同的主要基因 (gag、pol、env),分别编码3 个结构蛋白(Gag、Pol、Env)[9]。 有研究表明[10],gag 基因编码保护DNA 的内部结构蛋白,其中, 分子量最大的是衣壳蛋白 (capsid protein,CA),在感染过程中能引起机体强烈的抗体反应。此外,Preziuso 等[11]利用MVV CA 单克隆抗体经免疫组化法对该病毒在绵羊体内的分布进行鉴定,发现在感染MVV 绵羊的肺脏、肺门淋巴结、乳房、脾、骨髓均有阳性信号。 由此可见,MVV CA 蛋白及其抗体对MVV 的诊断具有重要价值。 目前,国内鲜有关于MVV CA 蛋白研究报道。 该研究通过原核表达方法获得重组MVV CA 蛋白并制备兔源多克隆抗体, 旨在为进一步研究MVV CA 蛋白的生物学功能和研发MVV 血清学诊断技术提供参考。
1 材料与方法
1.1 试验材料
1.1.1 病料来源
自然感染MVV 的绵羊病肺组织和健康绵羊肺脏组织由内蒙古农业大学兽医学院动物生理学实验室保存。
1.1.2 实验动物
清洁级新西兰大白兔,雄性,2 只,体重4~5 kg,购自北京维通利华实验动物技术有限公司。
1.1.3 主要试剂
胶回收试剂盒、DNA 提取试剂盒、 质粒小提试剂盒,购自金百特公司;IPTG,购自宝生物工程(大连)有限公司;Trans1-T1 感受态细胞、pEASY®-Blunt E1 原核表达载体、Protein Marker, 购自北京全式金生物技术有限公司;HRP 标记山羊抗兔IgG、HRP 标记山羊 抗鼠IgG、 氨 苄西林(ampicillin),购自生工生物工程(上海)股份有限公司;抗His 单克隆抗体,购自艾博抗(上海)贸易有限公司;BCA 蛋白测定试剂盒、SDS-PAGE 凝胶配制试剂盒、一抗稀释液、二抗稀释液、SDS-PAGE 蛋白上样缓冲液(5×),购自上海碧云天生物技术有限公司; 弗氏完全佐剂和弗氏不完全佐剂, 购自Sigma 公司。
1.1.4 主要仪器设备
PCR 仪(型号:T100)、核酸电泳仪(型号:Mini-Sub Cell GT Cel)、 蛋白电泳仪 (型号:Mini-PROTEAN Tetra)、蛋白转印系统(型号:Trans-Blot Turbo),美国伯乐公司产品;多功能酶标仪(型号:EXL808),美国Bio-Tek 公司产品;恒温振荡培养箱(型号:DHZ-C),苏州培英实验设备有限公司产品。
1.2 试验方法
1.2.1 扩增目的基因及构建重组质粒
根据GenBank 已登录的MVV 内蒙古株(GI:MW248468.1)CA基因序列, 运用Primer 5.0 软件设计扩增CA基因引物, 上游引物P25-F-1 序列:5′-ATGCAAGCAGGAGGAAGAAGTTGG-3′,下游引 物P25-R-645 序 列:5′-CTAAAATCCTTCTGAGCCCACATCT-3′, 引物由生工生物工程 (上海)股份有限公司合成。对内蒙古农业大学兽医学院动物生理学实验室保存的自然感染MVV 的绵羊病肺组织提取DNA,利用MVV LTR 引物[7]对其进行PCR 扩增并将扩增结果作为阳性对照,以健康绵羊肺脏组织为阴性对照,利用P25-F-1/P25-R-645 引物扩增MVV CA基因,PCR 反应条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35 个循环;72 ℃延伸10 min。 进行胶回收及纯化目的片段。 按照pEASY®-Blunt E1 Expression Kit 说明书, 将目的片段和pEASYBlunt E1 表达载体进行连接, 采用热激法将重组质粒转化至Trans1-T1 感受态细胞, 筛选阳性克隆菌并测序。
1.2.2 MVV CA 重组蛋白原核表达及纯化
将重组质粒pEASY-E1-CA 和空质粒分别转化至BL21 感受态细胞, 同时设置空质粒对照组、未诱导表达组及诱导表达组, 在含有氨苄西林的LB 固体培养基上培养12 h, 筛选阳性克隆质粒,在含有氨苄西林的LB 液体培养基37 ℃摇床旋转培养至OD600nm值达0.5~0.6,诱导表达组及空质粒组加入IPTG 诱导8 h, 超声破碎后经SDS-PAGE电泳鉴定MVV CA 重组蛋白的表达及可溶性。 收集上清液,使用亲和层析柱(Ni Sepharose excel 5 mL)进行纯化,依次用含10 mmol/L 及20 mmol/L的咪唑缓冲液洗脱杂质蛋白, 用400 mmol/L 的咪唑洗脱缓冲液洗脱目的蛋白3 次, 对纯化后的蛋白样品进行SDS-PAGE 鉴定。 纯化后的MVV CA重组蛋白浓度为0.7 mg/mL。
1.2.3 Western blot 鉴定MVV 重组CA 蛋白的表达
将纯化的MVV 重组CA 蛋白进行Western blot 鉴定, 以1∶4 000 稀释的鼠源His 标签标记的抗体为一抗,以HRP 标记的山羊抗鼠IgG(1∶1 000稀释)为二抗,鉴定MVV CA 重组蛋白的表达。
1.2.4 多克隆抗体的制备
取新西兰大白兔2 只, 试验组和阴性对照组各1 只, 将纯化的MVV CA 重组蛋白与等体积的弗氏完全佐剂乳化,分别背部多点注射,蛋白终浓度为0.7 mg/mL,免疫剂量为1 mL/只;一免后进行加强免疫3 次, 即每2 周使用纯化的MVV CA 重组蛋白与等体积的弗氏不完全佐剂乳化免疫1次,免疫剂量0.7 mg/只;距最后一次免疫7 d 时,心脏采血,分离血清。
1.2.5 多克隆抗体效价测定
采用间接ELISA 方法测定新西兰大白兔血清中的抗体效价。将纯化的MVV CA 重组蛋白稀释至1 μg/mL(100 μl/孔)包被于96 孔酶标板中,37 ℃包被1 h,PBST 洗涤3 次; 加入5%的脱脂奶粉封闭液200 μL/孔,37 ℃封闭1 h,PBST 洗涤3次。将制备的多克隆抗体进行倍比稀释,以免疫前兔血清为阴性对照,100 μL/孔,37 ℃孵育1 h,PBST 洗涤3 次;HRP 标记的山羊抗兔IgG 1∶7 000 倍稀释,100 μL/孔,37 ℃孵育1 h,PBST 洗涤3 次;100 μL/孔TMB 显 色液室温避光显色5 min,100 μL/孔终止液,反应终止后酶标仪测定OD450nm值,以阳性OD450nm值/阴性血清OD450nm值(P 值/N 值)大于3 为阳性判定标准。
1.2.6 多克隆抗体的特异性鉴定
参照李艳华等[12]报道的提取肿瘤组织全蛋白的方法,提取绵羊健康肺脏组织和MVV 感染羊阳性肺组织的全蛋白,用于Western blot 鉴定多克隆抗体的特异性。 以制备的MVV 重组CA 阳性兔血清为一抗(1∶2 000 稀释),以HRP 标记的山羊抗兔IgG(1∶1 000 稀释)为二抗,鉴定多克隆抗体的特异性。
1.2.7 多克隆抗体的免疫组化检测
采用免疫组化方法,检测自然感染MVV 绵羊的病肺组织石蜡切片样本, 以制备的MVV 重组CA 多克隆抗体为一抗(1∶2 000 稀释),以链霉卵白素标记的山羊抗兔IgG(1∶2 000 稀释)为二抗,鉴定制备的多克隆抗体。
2 结果与分析
2.1 MVV CA 基因的扩增及重组质粒鉴定
提取自然感染MVV 绵羊病肺组织DNA,经PCR 扩增得到LTR 目的片段约291 bp,符合预期大小。 经P25 引物通过PCR 扩增得到片段约651 bp,符合预期大小。 以健康绵羊肺脏组织的DNA为模板,以P25 引物通过PCR 扩增没有出现任何条带。 结果表明, 对MVV 病肺组织的DNA 经MVV LTR 引物鉴定为阳性,可用于MVV CA基因的PCR 扩增, 且P25 引物可以在感染MVV 的病肺中扩增CA 基因(见图1)。将胶回收产物连接至pEasy-Blunt E1 原核表达载体, 命名为pEASYE1-CA。 测序结果表明,pEASY-E1-CA 重组质粒与GenBank 中 登 录 的MVV 内 蒙 古 株(GI:MW248468.1)CA 基因相比,有2 个碱基发生同义突变,但对其氨基酸序列并无影响。
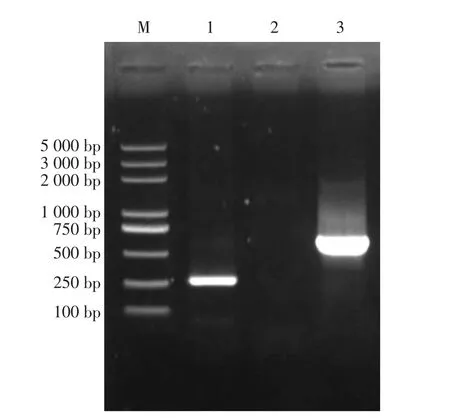
图1 MVV CA 基因PCR 扩增结果
2.2 MVV CA 基因的蛋白表达、纯化及鉴定
菌体破碎后经SDS-PAGE 电泳检测, 发现重组蛋白以可溶性和包涵体的形式存在,约27 kDa,与预期大小一致, 空质粒组和未诱导组无目的蛋白表达(见图2)。 纯化后重组蛋白未见明显杂蛋白条带,蛋白纯度满足制备多克隆抗体的要求(见图3)。 以pEasy-blunt E1 空载体转化至BL21 阳性菌落为对照,Western blot 检测结果显示, 纯化MVV CA 重组蛋白试验组27 kDa 处出现特异性条带而对照组没有条带, 表明MVV CA 重组蛋白表达正确(见图4)。

图2 MVV CA 重组蛋白SDS-PAGE 检测结果

图3 纯化后的MVV CA 重组蛋白SDS-PAGE 检测结果

图4 纯化后的MVV CA 重组蛋白Western blot 检测结果
2.3 多克隆抗体效价测定
以间接ELISA 方法测定多克隆抗体效价,制备的多克隆抗体稀释度在1∶8 192 时, 阳性血清OD450nm值和阴性血清OD450nm值差值仍较大,阳性血清OD450nm值大于阴性血清OD450nm值3 倍以上,表明制备的多克隆抗体效价较高(见图5)。

图5 MVV CA 多克隆抗体效价测定
2.4 多克隆抗体Western blot 特异性鉴定
将从健康绵羊肺脏组织和自然感染MVV 绵羊病肺组织提取的全蛋白进行Western blot 鉴定,结果显示,MVV 病肺组织试验组在约25 kDa 处(与预期大小相符)有单一特异性目的条带,而健康羊肺组织试验组没有条带, 表明制备的多克隆抗体特异性识别MVV CA 蛋白(见图6)。

图6 MVV CA 多克隆抗体Western blot 特异性鉴定
2.5 多克隆抗体免疫组化检测结果
将自然感染MVV 绵羊病肺组织的石蜡切片进行免疫组化检测。在显微镜下观察可见,棕色的阳性信号主要定位在巨噬细胞的胞浆内 (见图7),结果表明,制备的MVV CA 多克隆抗体可在生产实践中用于MVV 的检测。

图7 MVV CA 多克隆抗体免疫组化检测
3 讨论
在我国社会经济全面发展的背景下, 养羊业也得以快速发展。 但是,MVD 对于规模化养殖场特别是规模化种羊场造成了巨大危害。目前,既没有针对MVD 的有效预防措施,也没有较好的治疗方法,对于感染MVV 病畜只能采取隔离和扑杀措施[9],因此,MVD 诊断技术的研发对于MVD 的防控有重要意义。 有研究表明[13],Gag 蛋白是非糖基化的前体分子,通过中间蛋白进行加工,形成了衣壳蛋白(capsid protein,CA)、基质蛋白(matrix protein,MA)、核衣壳蛋白(nucleocapsid protein,NC),CA 蛋白在感染过程中能引起机体的强烈抗体反应。 2005 年,De Andrés 等[14]整理关于MVV 血清学诊断方法发现大多数ELISA 检测方法均包含CA 蛋白作为检测抗原。因此该试验选取了MVV CA蛋白作为目的蛋白,相比于古努尔·吐尔逊等[15]和张彦红等[16]通过原核表达的方法获得以包涵体形式表达的重组MVV Gag 蛋白,该试验通过原核表达的方法获得了可溶性MVV CA 蛋白,SDSPAGE 和Western blot 结果显示纯化的重组CA 蛋白具有较高的纯度和免疫原性, 为后续建立血清学诊断方法奠定了研究基础。
目前, 国内外针对CA 蛋白抗体的研究报道较少,而CA 蛋白抗体对深入研究MVV 病毒感染机制有重要作用, 此外CA 蛋白的抗体还能应用于MVD 临床病例的检测。 Western blot 结果表明,该试验制备的多克隆抗体能特异性识别自然感染MVV 的病肺组织中的CA 蛋白; 免疫组化结果显示,可见明显棕黄色阳性信号,主要定位在肺脏中的巨噬细胞的胞浆内。 绵羊感染MVV 后,肺脏中巨噬细 胞是MVV 感 染 的靶细 胞[10],Luján 等[17]、Gayo 等[18]分别用MVV 单克隆抗体进行免疫组化检测,结果显示在巨噬细胞的胞浆内有明显的阳性信号出现,与该研究中免疫组化检测结果一致,表明该试验制备的多克隆抗体可用于MVV 的检测。
4 结论
成功获得可溶性表达的重组MVV CA 蛋白,同时制备的多克隆抗体可以特异性识别MVD 阳性羊病肺中表达的天然CA 蛋白, 且该抗体可初步用于生产实践中检测MVV。
——一道江苏高考题的奥秘解读和拓展

