18F-FMISO乏氧显像剂的临床应用进展
高艳青,王宇飞,郭占林*
(1.内蒙古医科大学,内蒙古 呼和浩特 010059;2.内蒙古医科大学附属医院 胸外科)
肿瘤乏氧是导致癌症病人预后不良的重要原因[1]。由于肿瘤早期新生血管不足以支持其快速增殖,从小到几毫米到大到十几厘米的恶性肿瘤组织普遍存在乏氧区域。肿瘤组织的微环境是不断变化的。所以,它的乏氧区域与乏氧程度也是不断变化的。乏氧是肿瘤预后不好、产生对放化疗抵抗及侵袭性增加的关键原因之一[2]。因此,检测肿瘤组织的乏氧区域和乏氧程度十分重要,它能够为肿瘤早期诊断、疗效评价和预后情况提供线索。众多乏氧检测方法中,核医学(PET/SPECT)分子显像技术扮演着重要角色。原理就是被放射性核素(18F、64Cu、11C、15OO、111In、99m Tc、123I等)标记的乏氧显像剂(硝基咪唑类、非硝基咪唑类)能够在肿瘤特定的乏氧区域成像,而且成像后能够进行定量分析。其中1-H-1-(3-[18F]氟-2-羟基丙基)-2-硝基咪唑(18F-fluo-romisonidazole,18F-FMISO)乏氧显像剂是目前临床上应用最广泛的。下面将对18F-FMISO的最新实验及临床研究进展及目前存在的问题进行综述。
1 18F-FMISO概述
18F-FMISO乏氧显像剂具体是如何在乏氧细胞内蓄积的机制尚未明确。但Luo等[3]认为硝基咪唑类化合物拥有较高的组织渗透性,所以可以很轻松地进入到组织细胞内。硝基基团被细胞内酶(黄嘌呤氧化酶)还原形成一种自由基阴离子,如果细胞内氧合条件好,这种阴离子自由基会被氧化成原化合物被排出体外;但是如果细胞氧分压较低的话,这些中间产物就不会被氧化,而会进一步被还原,并结合细胞内大分子物质从而积聚于乏氧细胞内。这些被放射性核素标记的乏氧显像剂在乏氧细胞与正常细胞内形成浓度差,利用相应仪器探测并记录这种浓度差,从而进行乏氧的显像。Yamane等[4]认为,18F-FMISO(硝基咪唑类化合物)在乏氧细胞内聚集可能是由于还原后的自由基阴离子与谷胱甘肽形成结合体聚集在乏氧细胞内,所以它检测乏氧方面的能力可能与细胞乏氧和细胞内谷胱甘肽量的多少有关。近期又有研究[5]指出巨噬细胞中18F-FMISO的摄取可能与细胞的极化状态有关。
以2-硝基咪唑为基础的化合物是第一代用来检测肿瘤乏氧的[6]。在过去的几十年间,一些氟化硝基咪唑类[4](如图1)已被发现并应用于PET成像。包括18F-FMISO、18F-FETNIM、18F-EF5、18F-FAZA、18F-HX4、18F-FETA。其中18F-FMISO是最先被发现,也是目前临床上应用最广泛的。
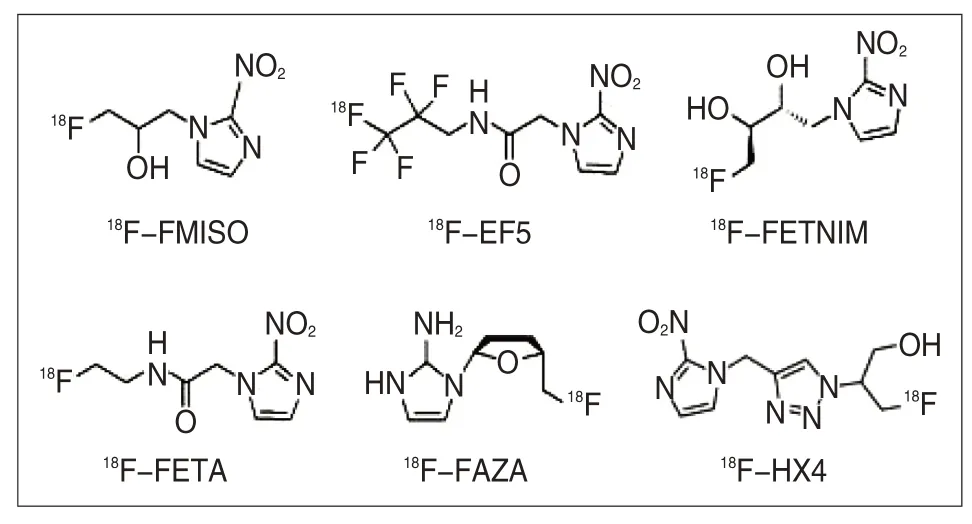
图1 氟化硝基咪唑类化合物的分子式Fig.1 Molecular formula of fluorinated nitroimidazole compounds
2 18F-FMISO在肿瘤诊断中的应用与进展
2.1 良恶性肿瘤的鉴别
临床上我们常借助PET-CT检查来判断肿瘤的良恶性,目前临床常用的两种放射性核素标志物是18F-FDG[7]和18F-FMISO。由于18F-FDG诊断恶性肿瘤的机制是肿瘤细胞糖酵解增强,摄取葡萄糖增加,而一些炎症、结核糖酵解也会增加,所以18F-FDG往往会存在假阳性的问题。近期梁志娜[8]进行了一项关于18F-FMISO与18F-FDG诊断良恶性肺结节的Meta分析,结果表明诊断早期肺良恶性结节18F-FMISO更具有优势,18F-FMISO诊断良恶性肺结节的特异性要优于18F-FDG,但是敏感性不如18F-FDG。所以单独使用18F-FMISO或联合18F-FDG在诊断良恶性肿瘤方面可能会更准确。
2.2 确定肿瘤的分级、分期
神经胶质瘤(GB)是一种常见的原发性恶性肿瘤,共分为IV级,级别越高,恶性程度越高,不同级别的神经胶质瘤治疗方法和预后完全不同。Mapelli等[9]很早便发现多形性胶质母细胞瘤(GB,IV级)摄取18F-FMISO较低级别的神经胶质瘤(IV级以下)摄取量明显增多。最近,Abdo等[10]在一项前瞻性临床研究中,对33例神经胶质瘤患者进行了18F-FMISO PET和MRI检查,发现缺氧程度(低氧量和SUVmax)与HIF-1α(乏氧诱导因子)、CAIX(碳酸酐酶IX)、VEGF(血管内皮生长因子)的表达之间存在相关性,没有摄取18F-FMISO的患者比摄取阳性的患者有更长的生存时间(log-rank,P<0.005),证明了18F-FMISO PET摄取与肿瘤级别密切相关,多形性胶质母细胞瘤(GB,IV级)的摄取率很高。这些研究表明,18F-FMISO不仅能诊断神经胶质瘤,而且在神经胶质瘤的分级、分期上也有很大作用,可以为后续治疗提供依据。目前只有文献报道18F-FMISO在神经胶质瘤分级、分期上扮演重要角色,至于在其他肿瘤上有没有帮助,还有待研究。
2.3 诊断微转移癌、预测肿瘤转移
肿瘤乏氧会导致肿瘤产生耐药,从而使侵袭性增加,更容易发生转移[1.2]。而成为真正临床转移灶之前被称为微转移癌。微转移癌普遍高度乏氧,不容易被目前影像学(CT/MRI)手段检测到。Pretell等[11]建立人非小细胞肺癌A549和HTB177细胞皮下、腹腔移植瘤模型,用免疫组化方法发现亚毫米级微转移癌严重缺氧,而PET显示有显著的18F-FMISO摄取,认为18F-FMISO PET不仅对在宏观上的肿瘤检测有帮助,在微转移癌方面也有很大的作用。近期Zhang等[12]研究发现,在建立小鼠结直肠癌细胞肝脏转移的模型中,18F-FMISO的摄取与HIF-1α/GLUT-1表达之间存在一定相关性,认为18F-FMISO的摄取可能作为转移癌的潜在分子探针,可以预测肿瘤转移。但是目前不足之处在于18F-FMISO在预测肿瘤转移的检测仍处于基础实验研究中。
2.4 诊断非肿瘤性疾病
18F-FMISO的原理是检测乏氧的组织细胞,但是一些非肿瘤性疾病也存在乏氧。众所周知,核磁是目前诊断早期脑梗死的首选检查,一般发病24 h内的脑梗在核磁上便会被发现。但是脑梗的病变范围可能会在发病的3~7 d内继续扩大。所以早期预测脑梗病变继续扩大的方法会为治疗提供帮助。Gómez等[13]对19名早期(发病48 h内)脑梗患者行18F-FMISO PET检查,发现没有摄取18F-FMISO的9例患者中脑梗病变范围后来没有继续扩大。脑梗病变范围扩大的标准是较初次核磁检查病变范围体积增加20%。18F-FMISO摄取与梗死范围继续扩大存在显著相关性。18F-FMISO PET扫描在预测梗死病变继续扩大方面具有100%的敏感性和82%的特异性。近来也有研究[14]报道18F-FMISO在诊断结节性心肌病或心脏外的结节病中可能非常有效。总之,18F-FMISO未来可以诊断的疾病将会越来越多,有待于进一步研究证实。
3 18F-FMISO在肿瘤治疗中的应用与进展
3.1 18F-FMISO在指导放疗方面的作用
目前认为,肿瘤乏氧会对放化疗产生抵抗,造成对治疗的不敏感,肿瘤会进一步进展威胁患者生命。而18F-FMISO能够检测肿瘤乏氧,确定肿瘤对放化疗的耐受性,从而有助于临床医生调整个性化治疗方案。(1)调强放疗:Li等[15]研究发现,剂量学上在18F-FMISO PET的指导下,通过同时综合升压将非小细胞肺癌乏氧部位的剂量调整到72Gy、78Gy和84Gy是可行的,同时并未见到放疗并发症的出现。近期Vera等[16]在一项II期临床实验中发现,对于54例非小细胞肺癌患者18F-FMISO摄取量高也就是存在乏氧的肺癌患者,予以加强的放疗,而其他人则予以常规放疗,在长达3年的随访过程中,发现18F-FMISO阳性患者中,调强放疗似乎可以延长11.2个月的生存期,改善了患者5年的生存期,当然这有待于进一步的临床验证;(2)放疗增敏:肿瘤细胞乏氧会对放疗不敏感,放疗增敏就是应用某些药物,使乏氧的肿瘤细胞对放疗再次敏感,有助于增加放疗疗效,而18F-FMISO可以动态监测这种放疗增敏剂的疗效。我国学者[17]近期研究发现,对60例食管鳞癌患者行完全随机对照研究发现18F-FMISO PET能够无创、动态、敏感地监测甘氨双唑钠(放疗增敏剂)对食管癌患者的放疗增敏效果,能够为临床放疗提供重要依据,准确评价放射增敏疗效,利于肿瘤的个体化治疗的和新型增敏剂的开发。以上两种治疗方法均需要大量实验验证,但是都指出了18F-FMISO能够为放疗治疗提供重要线索,所以18F-FMISO可能会提示发现更多恶性肿瘤乏氧的治疗方法。
3.2 18F-FMISO指导低氧靶向治疗
目前,已经开发出多种低氧靶向药物[18]。比如Evofosfamide、替拉扎明等,是一类新型的生物还原活性物,对乏氧细胞具有特异的细胞毒性,在细胞代谢时产生自由基,可以与DNA结合,导致DNA损害继而细胞死亡。Jennifer等在试验中发现,结直肠癌移植瘤模型予以不同的治疗方案:单纯5-氟尿嘧啶化疗、单纯放疗、低氧靶向药物+5-氟尿嘧啶、低氧靶向药物+放化疗,用FAZA PET(乏氧显像剂)检测肿瘤情况,发现后两者治疗方案效果显著,明显抑制肿瘤生长。目前多种乏氧靶向药物已步入临床实验中,Zeng[19]表示低氧靶向药物目前在临床实验中有很好的前景。Bandurska[20]实验研究表示18F-FMISO PET可以检测微小肿瘤乏氧状况,并且具有安全、可重复等优点。因此,在18F-FMISO PET帮助下,低氧靶向药物可能会更有效。
4 18F-FMISO与肿瘤预后评估
18F-FMISO可以用来评价放化疗后的治疗效果以及恶性肿瘤肿瘤的预后。Zschaeck等[21]研究发现,在22例恶性肿瘤患者中,在放疗前行18F-FMISO PET检查,其中18例出现低氧区域,乏氧的评价标准是最大标准化摄取值(SUVmax),肿瘤与肌肉的比率(T/M)和低氧体积(HV)。结果显示18F-FMISO摄取较多的患者生存率较18F-FMISO摄取较少的患者低。这提示18F-FMISO PET在放疗之前检测到的肿瘤缺氧可能预示了临床结局。Rühle等[22]在23例口腔鳞癌患者术前行18F-FMISO PET和18FDG PET检查,后行根治性手术随访5年以上,根据术前PET的参数与术后的结局进行分析,发现低氧容量(HV)与无病生存期和局部复发存在明显相关性,肿瘤HV可以预测口腔鳞癌患者的预后。恶性肿瘤18F-FMISO摄取量与预后存在相关性,但这需要更多的临床证据去验证。
5 18F-FMISO临床应用中存在的问题
18F-FMISO作为第一代乏氧显像剂,临床应用很普遍[6]。这证明它有很多优势,比如安全、可重复、无创,能够特异性保留在乏氧组织细胞。但是随着研究发现,它也存在很多不足的地方。比如:18F-FMISO半衰期过短、吸收率低、清除率较低,从注射到显像大约需要2 h,更有研究表明历时4 h显像效果可能会更好[24],这些因素影响了清晰度和对比度。而且,还有研究表示它在肝脏、肾脏等部位放射性浓度高,不适合这些地方成像。再与传统影像(CT/MRI)相比,分辨率(5~7 mm)较低。这些问题同时也限制了18F-FMISO在临床上进一步推广。
6 18F-FMISO与其他乏氧显像剂
由于18F-FMISO存在一些问题,所以目前其他一些乏氧显像剂的研究也非常火热,近几年18F-HX4和18F-FAZA表现出了更为广阔的发展前景[25]。研究对比18F-HX4、18F-FAZA和18F-FMISO乏氧显像,发现18F-HX4具有较高的清除率,显像图像更清晰。18F-FAZA的生物动力学特点更佳,更能将特异性结合到乏氧区域,而且也有很高的清除率及成像时间快等优点。目前并没有研究对比出三种乏氧显像剂在乏氧成像中哪种占过多优势,因为这几种乏氧显像剂都存在各自的优势与不足。临床工作中,我们需要根据不同肿瘤、不同乏氧显像剂的优缺点进行选择,这样才能发挥更大的作用。另外还有一些其他的乏氧显像剂也在研发与实验阶段,比如64Cu-ATSM、SR-4554等,需要更多的实验去证明这些乏氧显像剂未来的发展趋势。
7 展望
在肿瘤进展过程中,乏氧微环境是一个动态的过程,并且与新生血管生成、肿瘤侵袭、肿瘤转移及肿瘤耐药密切相关。本文主要介绍乏氧显像剂18F-FMISO的概念和其在肿瘤诊断、治疗、预后方面的应用,以及其存在的不足。我们有理由相信,未来18F-FMISO会得到更好的技术改进,也会有其他更好的乏氧显像剂开发出来应用于临床,指导肿瘤的诊断、治疗和预后等,使肿瘤患者可以活得更长、活得更好。

