基于高通量靶向代谢组学筛选PCOS患者卵泡液差异游离脂肪酸
程铭,贾婵维,马延敏,刘英
(首都医科大学附属北京妇产医院生殖医学科,北京 100026)
多囊卵巢综合征(PCOS)为育龄女性最常见的生殖内分泌疾病,是引起女性月经紊乱、排卵障碍性不孕、高雄激素和胰岛素抵抗的重要原因[1]。PCOS作为一种与多种代谢紊乱相关的复杂疾病,相关代谢紊乱引起的代谢物改变可能会影响卵巢卵泡[2],其独特的代谢特征往往反映在卵泡液组成中。常见的代谢性疾病可导致过度的脂肪分解使游离脂肪酸(FFA)水平升高,FFA是异常脂质代谢的重要生物指标[3],在女性卵泡液中FFA含量的变化会影响卵母细胞的成熟和发育[4],导致卵母细胞生长和分化的改变[5-6]。既往关于PCOS患者卵泡液的检测,主要集中在运用非靶向代谢组学获取广泛的代谢物类别,有学者通过超高液相色谱-四级杆飞行时间质谱联用技术发现脂肪酸类代谢物表达存在差异[7],而靶向代谢组学技术具有更高灵敏性和选择性,可以在非靶向的基础上定量分析特定的代谢物浓度[8],从而对非靶向结果加以验证和扩展[9]。
本研究采用气相色谱-质谱联用(GC-MS)技术高通量靶向定量检测PCOS患者卵泡液中的FFA浓度,运用单元与多元变量统计分析方法筛选与PCOS相关的差异FFA,通过分析可能参与的代谢通路,找到差异FFA的共上下调相关性,初步探索影响PCOS卵巢功能的相关因素,增加对PCOS患者发生的复杂代谢过程的了解,为预测和改善PCOS患者卵母细胞质量和体外受精治疗结局提供思路。
资料与方法
一、研究对象
选取2021年3月—12月在我院生殖医学科接受体外受精/卵胞浆内单精子注射(IVF/ICSI)治疗的不孕患者(年龄<40岁)为研究对象。行IVF/ICSI治疗的PCOS患者(13例)为PCOS组,其纳入标准依据鹿特丹标准[10]并排除临床表现与PCOS 类似的非PCOS患者;对照组为平素月经周期和排卵规律、因女性输卵管因素和(或)男性因素行IVF/ICSI患者(8例)。两组患者同时排除高催乳素血症、子宫内膜异位症、卵巢早衰、卵巢缺如,且入组前1个月患者均未接受过性激素、胰岛素、血糖代谢的药物。本研究经首都医科大学附属北京妇产医院伦理委员会批准,所有患者在研究前均签署知情同意。
二、主要试剂与仪器
1.主要试剂:硫酸甲醇溶液(Thermo,美国);正己烷(苏州永华);无水硫酸钠(北京国药集团);水杨酸甲酯(TCI,日本)。
2.主要仪器:Thermo TG-FAME毛细管柱(Thermo,美国);TSQ 9000质谱(Thermo,美国)。
三、实验方法
1.样本采集:经阴道超声引导下穿刺取卵时收集无血染的卵泡液,3 000 转/min 4 ℃离心10 min后分离上清,分装入1.5 ml无菌离心管中,于-80℃冰箱保存备用。
2.样本预处理:吸取50 μl卵泡液于15 ml离心管中,加入2 ml 1 %硫酸甲醇溶液,充分混匀震荡1 min,80℃水浴锅中酯化30 min;取出后冷却,加入1 ml正己烷萃取,振荡混匀30 s,静置5 min,加入5 ml H2O(4℃)洗涤,3 500转/min 4 ℃ 离心10 min;吸取700 μl上清液于2 ml离心管中,加入100 mg无水硫酸钠粉末除去多余水分,振荡混匀30 s,12 000转/min离心5 min;吸取300 μl上清液于2 ml离心管中,加入15 μl 500 ppm水杨酸甲酯作为内标,振荡混匀10 s;吸取200 μl上清液加入到检测瓶中待检测。所有样本均间隔数针随行质量控制(QC)检测。
3.GC-MS检测:色谱柱使用Thermo TG-FAME毛细管柱(50 m×0.25 mm ID×0.20 μm,Trace 1300);进样量1 μl,分流比8∶1。进样口温度250 ℃,离子源温度300 ℃,传输线温度280 ℃。程序升温起始温度80 ℃,保持1 min;以20 ℃/min升至160 ℃,保持1.5 min;以3℃/min升至196℃,保持8.5 min;最后以20 ℃/min升至250 ℃,保持3 min。载气为氦气,载气流速0.63 ml/min。质谱使用电子轰击电离源,SIM扫描模式,电子能量70 eV。
4.数据采集和预处理:按照上述GC-MS条件对待测样本进行数据采集,根据标准样品出峰面积绘制标准曲线,计算线性回归方程,并对结果进行定性和换算处理。数据从下机的raw格式通过Xcalibur软件转置成CDF格式进行后续的数据分析。其中采用主成分分析法(PCA)通过主成分对各组数据归类,从而直观反映各个样本的聚集和离散程度;结合正交偏最小二乘法-判别分析法(OPLS-DA)对样本进行指定并分组,对数据降维的同时结合回归模型并进行判别分析,从而使FFA的组间差异可视化,并经其置换检验评估检验模型是否存在过拟合现象。
四、统计学分析
通过独立样本t检验对两组样本的每个变量进行计算求P值,当0.01≤P<0.05则认为有显著差异,当P<0.01则认为有极显著差异。用Pearson相关对两组样本的差异FFA开展相关性分析,用r反映两个变量的相关性程度。r的绝对值越接近1,表示两变量之间直线联系越密切;当r为负值时,表示两个变量的变化方向相反,称为负相关;当r为正值时,表示两个变量的变化方向一致,称为正相关。将原始定量数据导入R软件进行多元统计分析处理。运用OriginPro 2022(OriginLab Corporation,Northampton,MA,美国)软件分别绘制火山图、层次聚类分析热图和相关热图,数据分析流程见图1。

图1 数据分析流程图
结 果
一、主成分分析(PCA)
PCA得分图可直观地观察样本的聚集和离散程度,样本分布点越靠近,说明这些样本中所含变量的组成和浓度越接近;反之,样本点分布越远离,其所含变量的组成和浓度差异越大。在该PCA得分图(图2)中每个点代表一个对应的样本,两组卵泡液样本的点分别聚集在一起,说明两组卵泡液样本的各个样本之间的相似性非常高,且两组卵泡液样本对应的散点在组内呈现互相聚集的现象,说明组内的重复性较好,样本数据非常相似,组间具有较好的区分度。
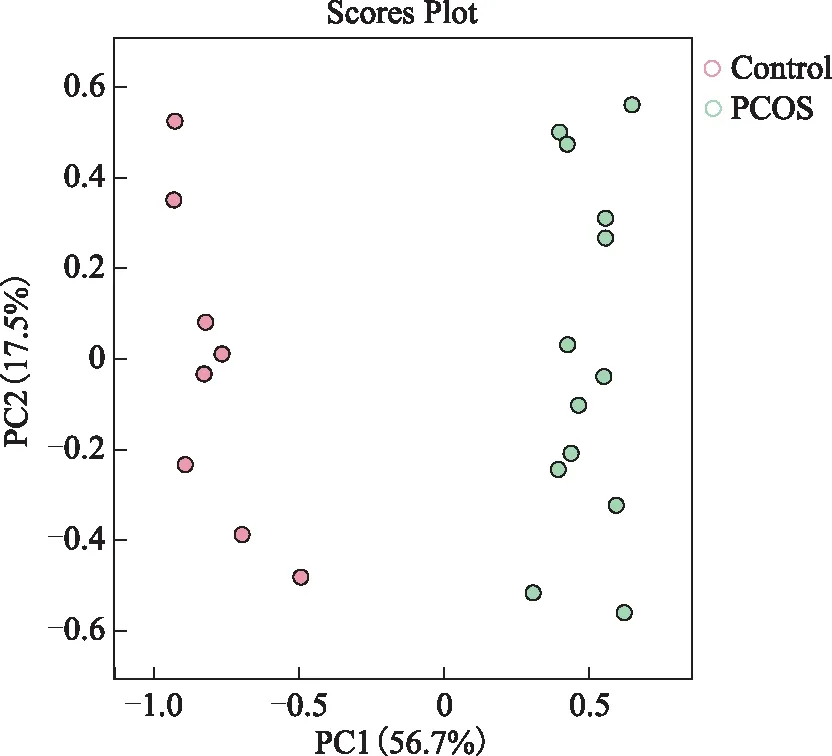
红色圆点代表对照组患者的卵泡液样本,绿色圆点代表PCOS组患者的卵泡液样本。
二、OPLS-DA分析结果
正交偏最小二乘法-判别分析法(OPLS-DA)使用正交信号校正技术,在不降低模型预测能力的前提下,过滤掉样本中与模型分类不相关的正交信号,从而使FFA的组间差异可视化。各卵泡液样本的OPLS-DA得分图结果显示,PCOS组和对照组组内分布均匀,组间FFA分布具有差异性(图3)。为防止检验模型出现过拟合,对其进行OPLS-DA的置换检验(Permutation test of OPLS-DA),结果如图4所示,R2Y为模型Y变量的可解释度,其值越接近1,说明建立的模型符合样本的真实情况;R2X值代表模型可解释的变量;Q2值为通过交叉验证计算得出的用以评价模型的预测能力,其值越接近0.5,说明该模型的可预测性越好。该图中Q2值的回归线在Y轴上的截距小于0说明该模型具有良好的稳定性,不存在过拟合现象。
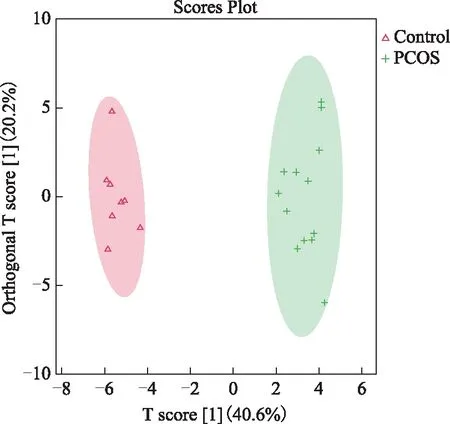
红色三角形代表对照组,绿色加号代表PCOS组。横坐标表示主要成分得分值(Tp),反映组间的差异;纵坐标表示正交主成分得分值(TO),反映组内样本间的差异。

横坐标表示置换检验得到的分组变量与原始分组变量的相关性,纵坐标表示R2Y及Q2值,绿色圆点表示置换检验得到的R2Y值,蓝色方点表示置换检验得到的Q2值,两条虚线分别表示R2Y及Q2值的回归线。
三、PCOS患者卵泡液差异FFA的筛选
以独立样本t检验对两组卵泡液样本的每个变量进行计算求得的P值小于0.05,同时两组样本表达差异倍数(FC)值大于1.2为标准对PCOS患者卵泡液中的差异FFA进行筛选。结果以火山图的形式可视化呈现。火山图中的每个点代表一个FFA,横坐标表示PCOS组比对照组的差异表达倍数(取以2为底的对数),点越偏离中心表示差异倍数越大;纵坐标表示经独立样本t检验的P值(取以10为底的对数),点越靠近图顶部表示差异越显著。结果表明,在PCOS患者卵泡液中筛选出28种差异FFA,其中有21种FFA上调表达(P<0.05,FC>1.2),有7种FFA下调表达(P<0.05,FC>1.2)(图5)。我们对每批卵泡液间隔数针随行质量控制(QC)检测,通过标准品与内标的峰面积比值计算所有QC的相对标准偏差(RSD),来评价方法的稳定性,所有样本均质检合格(图6)。

红色表示显著上调的FFA,蓝色表示显著下调的FFA,灰色表示非显著差异的FFA。
图6 质量控制总离子流色谱图
四、PCOS患者卵泡液中差异FFA的鉴定
对差异FFA的定量值做层次聚类(hierarchical clustering)分析,结果以热图的形式呈现。结果显示,与对照组相比,PCOS组患者卵泡液中的己酸(C6:0)、十一烷酸(C11:0)、十三烷酸(C13:0)、反-9-肉豆蔻烯酸(C14:1T)、顺-9-棕榈油酸(C16:1)、十七烷酸(C17:0)、异油酸(C18:1N7)、亚油酸(C18:2N6)、γ-亚麻酸(C18:3N6)、α-亚麻酸(C18:3N3)、二十一烷酸(C21:0)、山嵛酸(C22:0)、HOMO-γ-亚麻酸(C20:3N6)、巴惟酸(C22:1N9T)、顺-11,14,17-二十碳三烯酸(C20:3N3)、花生四烯酸(C20:4N6)、二十三烷酸(C23:0)、顺-13,16-二十二碳二烯酸(C22:2)、木蜡酸(C24:0)、顺-7,10,13,16-二十二碳四烯酸(C22:4)、DPA(C22:5N3)水平显著上调(P<0.05),而月桂酸(C12:0)、顺-9-肉豆蔻烯酸(C14:1)、反-10-十五烯酸(C15:1T)、顺-10-十五烯酸(C15:1)、反油酸(C18:1N9T)、反-11-二十碳烯酸(C20:1T)、顺-11-二十碳烯酸(C20:1)水平显著下调(P<0.05)(图7)。
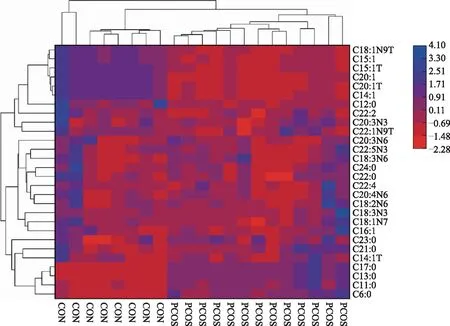
横坐标为样本名,代表不同实验分组,每一列代表一个样本;纵坐标为差异FFA;图中FFA的相对含量大小通过不同颜色呈现。标尺示差异FFA的相对表达量的高低,颜色越红表示该FFA的表达量越低,颜色越蓝表示该FFA的表达量越高。
五、差异FFA的代谢通路分析
为进一步探索PCOS患者卵泡液中差异FFA的变化与代谢通路之间的关系,通过MetaboAnalyst5.0对得到的差异FFA以SMPDB代谢物数据库为背景进行相关代谢通路的富集分析,从而筛选出与FFA差异相关性最高的关键通路。代谢通路分析的结果以气泡图的形式呈现。结果显示,差异FFA匹配到与脂肪酸代谢密切相关的6条通路,分别是α-亚麻酸和亚油酸代谢、超长链脂肪酸的β-氧化、脂肪酸生物合成、短链饱和脂肪酸的线粒体β-氧化、中链饱和脂肪酸的线粒体β-氧化、花生四烯酸代谢(图8)。

纵坐标为每一个气泡对应的代谢通路名称,横坐标为P值,-log10(p-value)值越大,P值越小。气泡越大代表富集到该通路的FFA数目越多,气泡颜色反映P值大小。
六、差异FFA的相关性分析
通过计算两组差异FFA两两之间的Pearson相关系数来分析各个代谢物之间的相关性。结果显示,PCOS卵泡液中表达上调的己酸(C6:0)、十一烷酸(C11:0)、十三烷酸(C13:0)、十七烷酸(C17:0)之间,异油酸(C18:1N7)、亚油酸(C18:2N6)、γ-亚麻酸(C18:3N6)、α-亚麻酸(C18:3N3)之间,HOMO-γ-亚麻酸(C20:3N6)、花生四烯酸(C20:4N6)、木蜡酸(C24:0)、DPA(C22:5N3)之间均具有显著正相关性(P<0.05);PCOS卵泡液中表达下调的月桂酸(C12:0)、顺-9-肉豆蔻烯酸(C14:1)、反-10-十五烯酸(C15:1T)、顺-10-十五烯酸(C15:1)、反油酸(C18:1N9T)、反-11-二十碳烯酸(C20:1T)、顺-11-二十碳烯酸(C20:1)之间均具有显著正相关性(P<0.05);上调的己酸(C6:0)、十一烷酸(C11:0)、十三烷酸(C13:0)、十七烷酸(C17:0)与下调的差异FFA之间有显著负相关性(P<0.05)(图9)。

横纵坐标代表两组差异FFA,不同位置色块颜色深浅代表对应坐标的两个代谢物的相关系数大小,红色代表正相关,蓝色代表负相关,×代表非显著相关性。
讨 论
卵巢是卵母细胞发育和排出、分泌性激素的重要生殖器官。卵泡液是卵母细胞在体内发育中的微环境,其组成包括卵泡生长和卵母细胞成熟所必需的成分以及卵母细胞和颗粒细胞排泄的代谢物[11-12]。卵泡液的代谢组成可能反映卵母细胞和颗粒细胞的质量[13]。低生育力可能会导致正常的生理代谢失衡,引入代谢组学技术能更好地在分子水平上评估女性生育力,了解卵母细胞发育过程中的代谢变化,以期提高卵母细胞的质量,从而获得优质胚胎[14],进而有助于改善辅助生殖治疗结局[15]。目前对卵母细胞的质量评估主要基于对卵丘-卵母细胞复合体的形态学观察,具有人为观察和鉴定的主观性;而卵泡液在IVF治疗过程中容易获得,且非侵入性的代谢组学检测技术可识别与疾病特定表型相关的潜在生物标志物和代谢途径,可作为预测卵母细胞质量的指标以及补充对胚胎形态学的评估,进而深入了解其背后的机制[8]。
既往研究发现,PCOS患者血清中的代谢异常与FFA、溶血磷脂等脂质代谢异常相关[16-18],同时PCOS患者的卵泡液也具有其独特的代谢特征[19]。有报道在PCOS患者卵泡液中鉴定出21种不同的代谢物,其中与脂肪酸代谢障碍相关的肉碱合成途径是其关键代谢途径之一,可诱发脂肪酸代谢功能障碍的7β-羟基胆固醇[20]可能是PCOS的一种潜在代谢标志物[21]。本研究采用GC-MS技术高通量靶向定量检测PCOS患者和非PCOS患者卵泡液中FFA的浓度,通过单元和多元变量统计分析筛选出28种差异表达的FFA,其中有21种差异FFA表达上调,包括异油酸、亚油酸、γ-亚麻酸、α-亚麻酸、花生四烯酸等,7种差异FFA表达下调,包括月桂酸、顺-9-肉豆蔻烯酸、反油酸等,进一步验证了PCOS患者卵泡液中存在FFA的代谢变化且FFA浓度并非只升高不降低,这为既往的研究结果进行了补充[4]。
FFA水平的升高被认为是女性生育力低下的重要因素。PCOS患者卵泡液中浓度升高的FFA与形态不佳的卵丘-卵母细胞复合体之间存在关联[22],表明过量的FFA会对卵泡的功能产生不利影响。既往研究表明,升高的FFA不仅会干扰葡萄糖代谢,也影响胰岛素受体及其信号传导,FFA是引起胰岛素抵抗的最主要非激素物质之一[23]。PCOS患者卵泡液中葡萄糖转运障碍,可利用葡萄糖减少,从而启动脂肪酸等代谢途径来代偿能量供应不足,而这些代偿机制会造成卵泡液中脂类、酮体等水平的改变[24]。这可能是PCOS患者卵母细胞质量较差的原因。Mu等[25]研究证明,饱和脂肪酸如棕榈酸和硬脂酸通过诱导人卵巢颗粒细胞凋亡从而使细胞死亡;而多不饱和脂肪酸如花生四烯酸即使在超生理浓度下对细胞存活无影响,反而对棕榈酸和硬脂酸诱导的细胞凋亡有保护作用。这提示FFA对颗粒细胞存活的影响可能参与生殖异常的机制。此外,花生四烯酸及其衍生物的释放在卵母细胞成熟过程中受到卵泡刺激素和黄体生成素的调节[26]。本研究中,我们发现在PCOS卵泡液中异油酸、亚油酸、γ-亚麻酸、α-亚麻酸、花生四烯酸等表达上调,且通过差异FFA富集到α-亚麻酸和亚油酸代谢、花生四烯酸代谢等代谢通路,结合上述研究,表明这些代谢途径可能参与导致PCOS患者不良生殖结局的机制。
作为人体必需脂肪酸的α-亚麻酸和亚油酸需维持在一定的生理水平,且饱和/不饱和脂肪酸的比例也可能会影响到卵母细胞的发育能力[4]。Niu等[6]研究结果显示,油酸、棕榈酸、硬脂酸、十一烷酸、肉豆蔻烯酸和亚油酸是卵泡液中主要的FFA;PCOS患者的卵泡液中两种长链脂肪酸(棕榈酸和油酸)水平明显升高,肥胖PCOS患者卵泡液中亚油酸浓度高于非肥胖PCOS患者和非PCOS患者。这些结果表明,卵泡细胞以不同的速率代谢特定的FFA,一些FFA可能会被优先运输到卵泡中进行分解代谢。在本研究中,PCOS患者卵泡液中表达上调的FFA之间存在共上调关系,表达下调的FFA之间存在共下调关系,同时一些表达上调的FFA与表达下调的FFA之间存在显著负相关,说明活跃的机体代谢活动远比单一的代谢不平衡所能解释的要复杂得多[11,27-28]。因此,研究多类化合物组合预测生殖结局至关重要,代谢组学让我们更加全面了解发育中的卵母细胞和胚胎的营养情况以及女性生殖内环境,这对诊断和改善生育治疗的结局具有潜在影响。
综上所述,本研究建立了基于高通量靶向代谢组学技术筛选卵泡液中差异FFA的方法。我们发现,与非PCOS患者相比,PCOS患者的卵泡液中有28种FFA水平发生变化,其中有21种FFA表达水平上调,7种FFA表达水平下调,且存在表达上调的FFA相互间共上调、表达下调的FFA相互间共下调的关系。结果提示PCOS患者部分脂肪酸的代谢改变可能会影响卵泡生长的微环境,影响卵巢功能。此外通过相关代谢通路的富集分析,初步探索PCOS患者体内可能参与的重要脂肪酸代谢通路,对未来寻找影响卵母细胞发育过程中的信号通路有指向作用。

