肾综合征出血热并发肾积水及膀胱凝块1例
叶 丹,蔺婉婷,李 婷,李建平,李钊伦,纪泛扑,高 宁
1 病例报告
1.1 病史 患者男,20岁,因发热6 d,腹痛、腰痛2 d于2021年7月4日晚入院。6 d前无明显诱因出现发热,体温最高39 ℃,无寒战、皮疹或其他不适。当地诊所按“上呼吸道感染”治疗,效果欠佳。2 d前出现腹痛,伴腰背部疼痛,自觉面部发红伴肿胀感,口干多饮,易出汗,有胸闷气短,伴恶心,无呕吐。就诊于当地县医院,查血常规:白细胞18.08×109/L,血红蛋白206 g/L,血小板53×109/L;尿常规:隐血+ -,尿蛋白3+;便常规:隐血+。给予对症处理后体温反复升高。1 d前气短加重,出现眼结膜充血水肿,颜面部及前胸部充血潮红,口腔、咽喉部黏膜充血、出血,伴恶心、大汗,四肢发凉,尿量较前减少,24 h尿量约500 ml,就诊于我院。患者平素身体健康状况一般,否认传染病史,3年前行“脑脊膜膨出脑室腹腔分流术”、“脑梗塞动脉取栓术”。来自肾综合征出血热(hemorrhagic fever with renal syndrome, HFRS)疫区,近期无鼠类接触史,否认外伤及输血史,否认药物、食物过敏史。预防接种史不详。
1.2 入院查体 体温38.4 ℃,脉搏112次/min,呼吸26次/ min,扩充血容量(扩容)后血压17.47/8.4 kPa(1 mmHg=0.133 kPa)。意识淡漠,反应迟钝。颜面部水肿,结膜充血Ⅱ度水肿,全身浅表淋巴结未及肿大,颈部及前胸充血潮红,咽红,软腭可见网状充血。心、肺查体未见明显异常。腹膨隆,全腹软,有压痛、无反跳痛,肝脾肋下未及。双肾叩击痛阳性。肠鸣音5次/min。
1.3 入院检查 入院前(7月3日)血常规:白细胞27.38×109/L,血红蛋白187 g/L,血小板13×109/L;尿隐血3+,尿蛋白4+;肝功能及心肌酶未见异常;肾功能:尿素氮23.4 mmol/L,肌酐412 μmol/L;电解质:钠119 mmol/L,钾4.33 mmol/L,氯81.6 mmol/L,CO2结合力14.3 mmol/L;D-二聚体12 600 ng/ml。
患者于7月4日晚收入感染科,复查血常规:白细胞14.69×09/L,红细胞4.24×1012/L,血红蛋白136 g/L,血小板13×109/L;尿常规:尿蛋白2+,隐血3+;肝肾功+电解质:尿素氮28.40 mmol/L,肌酐561.57 μmol/L,钾3.2 mmol/L,天冬氨酸氨基转移酶130 IU/L,磷酸肌酸激酶同工酶32 U/L;24 h尿量1030 ml。汉坦病毒抗体:IgM(+),IgG(-)。胸腹部彩超提示脂肪肝和双侧胸腔积液。腹部CT提示脂肪肝,腹腔内渗出性病变,双侧胸腔少量积液。心电图示:窦性心动过速。心脏超声未见明显异常。
1.4 诊疗经过 见图1。患者来自HFRS疫区,结合典型的临床表现及血清学检查,根据2021年《肾综合征出血热防治专家共识》[1],入院诊断:HFRS(发热、低血压休克、少尿期3期重叠)重度(早期定度);脂肪肝;胸腔积液(双侧)。入院第2 d(7月5日),复查白细胞15.06×109/L,血红蛋白115 g/L,血小板19×109/L;尿素氮31.40 mmol/L,血肌酐 629 μmol/L,24 h尿量1020 ml;考虑仍存在出血及血液浓缩,积极补液扩容,适当利尿,输注血小板、白蛋白,抗渗出及出血,头孢曲松钠他唑巴坦钠2 g(2次/ d)抗感染,并且给予保肝、营养心肌、维持水电解质平衡等对症支持治疗,期间患者出现少量絮状尿膜状物。7月8日复查结果:白细胞9.15×109/L,血红蛋白130 g/L,血小板156×109/L;凝血指标正常;尿素氮42.3 mmol/L,肌酐405.7 μmol/L,24 h尿量2770 ml,患者进入多尿期第2 d,血常规已恢复正常,肾功血尿素氮仍持续进展,按照多尿期治疗原则维持酸碱及水电解质平衡及防止感染。12日复查结果:白细胞14.97×109/L,血红蛋白150 g/L,血小板336×109/L;尿素氮48.60 mmol/L,肌酐 348.00 μmol/L,钠 126.0 mmol/L,钾 5.75 mmol/L;炎症指标升高,出现代谢性酸中毒,高钾血症、低钠血症,考虑伴有高血容量综合征,不除外二次感染致急性肾功能衰竭,调整抗生素为美罗培南0.5 g,静脉滴注,1次/8 h,纠酸降钾利尿等对症治疗。2 d后炎症指标较前稍下降,肾功仍持续恶化,尿素氮升至49.4 mmol/L,肌酐321.00 μmol/L,钠122.0 mmol/L,钾3.64 mmol/L,调整抗生素为美罗培南1 g,静脉滴注,1次/12 h,于14、16、19日分别行3次连续肾脏替代治疗(continuous renal replacement therapy, CRRT)。第2次CRRT期间患者出现酱油色尿,伴血性尿膜状物形成(图2 A),后尿色变淡渐恢复正常,3次CRRT后肾功能较前明显好转,尿素氮降至11.5 mmol/l,肌酐 143 μmol/L,白细胞 6.62×109/L,血红蛋白100 g/L,血小板142×109/L;凝血功能检查:PT 10.0 s,D-二聚体4300 ng/ml;24 h尿量4330 ml。但随后血尿素氮仍继续升高,患者诉腰痛明显,床旁超声示双肾轻度积水。23日尿中再次出现暗红色陈旧性膜状物(图2 B),尿常规:红细胞512.10 /μl,尿蛋白+,凝血功能基本正常。26日血常规及炎症指标正常,停用抗生素(已满2周)。28日肌酐继续上升至178 μmol/L,尿素氮21 mmol/L,上腹部+泌尿系彩超示:双肾积水,双侧输尿管上段扩张。左肾盂光带分离1.7 cm,右肾盂光带分离1.2 cm,左输尿管上段1.3 cm;右输尿管上段1.0 cm;膀胱内4.5 cm×2.4 cm×3.2 cm混合回声,边界清晰,考虑血凝块。当日即行膀胱镜检查见输尿管膀胱开口膜状物堵塞,膀胱内巨大含组织凝块(图3),遂行双侧输尿管双J管置入术并留置导尿。术后2 d拔除导尿管,拔管2 d后患者自行排出3块巨大膜状物(图2 C)。8月2日复查泌尿系彩超:双肾轻度积水伴双侧输尿管扩张较前稍有缓解,双J管位置正常;膀胱内混合回声消失;尿素氮14.4 mmol/L,肌酐278 μmol/L。置管1周后患者自觉腰痛较前好转,复查尿素氮10.0 mmol/L,肌酐251 μmol/L;电解质:钠142 mmol/L,钾3.8 mmol/L;肾功稳定好转,血常规示轻度贫血,凝血基本正常,于8月6日出院。

图1 治疗期间患者肾功能指标随时间变化情况Figure 1 Changes of renal function along with time during treatment
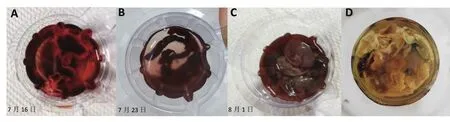
图2 经尿道排出的巨大膜状物(絮状、条状、团块状,肉眼观粉红色、棕褐色及灰白色)A.血性膜状物: B.陈旧性条状膜状物;C. 3块膜状物排出即刻;D. 膜状物固定于福尔马林溶液Figure 2 Huge membranes excreted through the urethra
1.5 出院情况及随访 出院诊断:①HFRS危重型;②输尿管支架置入术后;③脂肪肝。留置双J管4周后(9月1日)复查肾功能:尿素氮5.7 mmol/L,肌酐125 μmol/L;电解质:钠136 mmol/L,钾4.0 mmol/L;6周后(9月12日)复查泌尿系超声:双肾大小形态正常,实质回声均匀,左肾盂光带分离1.1 cm,右肾盂光带分离1.1 cm,左输尿管上段内径0.8 cm,右输尿管上段内径0.5 cm。最后一次随访9月13日,复查肾功能:尿素氮3.5 mmol/L,肌酐155.63 μmol/L,随后拔除双J管。
2 讨 论
HFRS是由汉坦病毒引起的一种自然疫源性疾病,主要病理变化是全身小血管和毛细血管广泛性损害,临床以发热、低血压休克、充血、出血和肾损害为主要表现[2]。典型病程为发热期、低血压休克期、少尿期、多尿期、恢复期共5期[3]。HFRS的肾脏损害表现为肾小球滤过率下降、少尿、血尿、蛋白尿,可合并急性肾功能衰竭,严重者可有自发性肾破裂[4],然而并发肾积水的报道罕见。既往报道过1例HFRS患者双肾重度损害合并右肾积水和输尿管血块,经抢救治疗5 d无效,最终因肾功能衰竭死亡[5]。
本文报道1例成功诊治的危重型HFRS患者因肾脏损害严重出现巨大尿膜状物,膜状物堵塞并发肾积水及膀胱凝块,重点讨论因巨大膜状物导致肾脏相关并发症的临床特征以及诊疗经验。
膜状物是由尿液中的蛋白、肾脏坏死脱落的上皮细胞、白细胞、红细胞等组织细胞与钙盐颗粒等在肾小管或肾盂中沉积粘着形成,肉眼观呈暗红至灰白色,大小形态不一,松散柔软或质韧硬结状[6-7]。HFRS患者尿膜状物多在少尿期出现,其大小与肾脏损害程度有关,多尿期也可出现,因尿量增加可伴随尿流冲刷作用排出。膜状物的出现与肾脏缺氧、肾血管通透性增加、血液外渗、肾小管上皮细胞变性坏死及纤维素形成有关,往往提示肾脏损害较重。膜状物排出过程中可能会造成泌尿系的梗阻,以输尿管生理狭窄部位较常见,可能造成肾积水及梗阻部位以上的输尿管扩张,若进入膀胱可引起下尿路梗阻引发尿潴留。本例患者多尿后期仍有膜状物出现,考虑二次感染后加重肾损害,此外CRRT可能会加重出血风险,出血坏死的组织集聚形成巨大膜状物,进而造成输尿管膀胱连接处梗阻,导致双肾积水及双侧输尿管扩张。
临床上除了避免二次肾脏损害的因素,早期识别可能的并发症也很重要。HFRS患者合并肾积水时早期无明显症状,易忽视,在护理过程中应严密监测生命体征和出入量,观察尿量和尿液性状等,若肾功能好转后再次加重,伴或不伴腰痛、尿量减少或排尿困难,需排除感染、自发性肾脏破裂等。本例患者感染得到控制,3次CRRT后肾功能明显好转,然而血尿素氮再次升高,肾功能恶化,复查B超示双肾积水进行性加重,结合膀胱镜下所见,除外其他因素后考虑肾积水所致肾脏持续损害。临床建议早期行床旁B超,必要时可行膀胱镜及输尿管镜检查,明确诊断及病因并早期干预。
HFRS多数病例可以完全康复,并发肾积水早期干预有利于肾功能恢复及预后。既往报道1例HFRS患者并发肾积水及输尿管血块,然而未详细描述诊疗过程,且患者最终因肾功能衰竭死亡。合并肾积水及输尿管扩张的治疗措施亦无指南推荐。本病例患者出现双侧肾积水并双侧输尿管上段扩张,膀胱镜下可见膀胱中巨大膜状物堵塞输尿管膀胱开口处,考虑机械因素造成的梗阻。放置输尿管支架是简单无创的方法,其在原发或继发性尿路梗阻解除及术后尿路引流中均显示出良好的作用[8]。本例患者在膀胱镜下留置双侧输尿管双J管,双J 管留置的优势在于:①扩张输尿管防止膜状物再次堵塞;②通畅引流减轻肾脏及输尿管压力。放置双J管时,尿液主要从管周扩张的输尿管排出,促使将形成或已存在的膜状物排出,肾积水和输尿管扩张得到缓解,有利于肾功能恢复。拔除双J管的时机尚无统一标准,不同的临床情况置管时间不同,对于输尿管损伤成形修复,为防止吻合口漏等,一般置管4~6周,也有报道称肾盂成形术后放置1周左右时间已足够[9-10]。不建议长期放置,超过4周可显著增加感染、支架定植、移位的风险,甚至可能加重肾积水[10-12]。本例患者无先天性解剖及输尿管损伤因素,由膜状物造成的暂时性梗阻解除后,每周定期复查肾功好转或B超示肾积水较前缓解后即可拔除双J管,为防止膜状物再次堵塞输尿管,于6周后拔除置管,患者恢复期肾功能已基本正常。
值得注意的是,本例患者B超示膀胱内不规则团块,膀胱镜下及后期排出物证实为巨大膜状物。曾有文献报道过1例HFRS患者并膀胱内巨大膜状物,患者进入多尿期后凝块逐渐变小排出至消失[13]。膀胱内凝块常见的处理方式包括导管冲洗及膀胱镜下相关器械清除,必要时需要开放式耻骨上血块清除术[14-15]。然而这些方法是复杂且有风险的,对于巨大或有一定硬度的含组织凝块,通过导管注入生理盐水冲洗难以碎解,且由于实际管腔大小的限制,可能无法通过导管排出甚至阻塞导管,而强大冲击力可能会引起膀胱损伤,操作费时费力,延长患者痛苦[16];对于一些顽固和巨大的凝块,膀胱镜鞘操作则须要全身麻醉以减轻严重的疼痛,剧烈的抽吸可能损伤膀胱三角区和后壁,严重者膀胱破裂[17]。出血热患者膜状物的成分决定其不易发生机化,我们最初尝试放置导管,期间未观察到膜状物排出,考虑到导尿管潜在被堵塞的风险,随后拔除了导尿管,患者尿量维持在约2000 ml/24 h,拔尿管2 d后膜状物经尿道自行排出。在治疗中未进行麻醉及任何有创操作,采取保守治疗的依据在于尿液中本身含有尿激酶,对于含组织血凝块具有一定的溶解作用[18],正常人的尿道具有一定的扩张度,松弛或崩解后的组织物凝血碎块可以自行排出,期间维持一定的尿量促进膜状物的排出是必须的。本例患者膀胱内4.5 cm×2.4 cm×3.2 cm大小膜状物经双J管置入术后在膀胱内自行崩解排出,不建议对HFRS患者膀胱中巨大膜状物进行导管冲洗,膜状物在尿激酶的作用下可分解成较小或相对较软凝块,可自行排出。若巨大膜状物无法自行排出或出现排尿困难可能需要进一步器械治疗。
综上,危重型HFRS患者肾脏损害严重者,可出现巨大膜状物并造成输尿管梗阻致单侧或双侧肾积水,膜状物进入膀胱可出现排尿困难、尿中断。患者进入多尿期后,如无其他诱因再次出现尿液和肾功能异常,须尽早行肾脏超声检查,出现肾脏积水或输尿管扩张时,建议早期行双J管置入避免加重肾损害。对于进入膀胱的巨大膜状物多数情况下无需特殊处理,出现排尿困难不建议长时间留置导尿,其可在尿激酶作用下分解成小的膜状物排出。

