2例AIDS相关弥漫性大B细胞淋巴瘤患者自体造血干细胞移植后的疗效观察并文献复习
王 聪,申娅媚,郭发慧,韩雪萍,李 倩,张玉霞,王晓琴,杨秀霞,赵 丽,张花花,赵海涛,杨子龙
非霍奇金淋巴瘤(non-Hodgins’s lymphoma,NHL)是造血系统常见的恶性肿瘤之一。最新研究显示,NHL是男性新发十大癌症中的第七位,女性新发十大癌症中的第六位,是威胁人类生命的十大癌症之一[1]。弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是NHL中最常见的病理亚型,随着对其研究的日趋深入,对于DLBCL的临床表现、诊断和治疗方面的认识已经日渐成熟。自利妥昔单抗时代以来,DLBCL患者的预后和生存期已经有了极大改善。NHL的每个亚型都受到不同因素影响,例如放化疗病史、肥胖和吸烟与DLBCL有关,HIV和人类疱疹病毒8是DLBCL几种亚型的易感病毒[2]。HIV感染人体后,引起CD4+T细胞计数持续性减少,导致机体细胞免疫功能严重受损,机体抵抗力极度下降,发生多种感染(如带状疱疹病毒感染,霉菌、念珠菌、肺孢子虫等真菌感染),而且容易继发卡波西肉瘤、淋巴瘤、鳞状细胞癌等恶性肿瘤[3-5]。AIDS相关性淋巴瘤(acquired immunodeficiency syndrome-related lymphoma, ARL)因其起病急、临床表现复杂、进展迅速、治疗时机难以把握等特点越来越受到临床医生的关注。ARL患者往往以NHL为主[6-7],合并霍奇金淋巴瘤[8]、伯基特淋巴瘤[9]、浆细胞淋巴瘤者目前多见于个案报道[10]。近年来由于抗反转录病毒联合疗法(combination antiretroviral therapy, cART)的临床应用,ARL患者的淋巴瘤病理类型发生变化,AIDS-DLBCL变得更加常见[11]。本文报告甘肃省武威肿瘤医院2例自体造血干细胞移植(auto-hematopoietic stem cell transplantation, ASCT)治疗AIDS-DLBCL患者的临床特征、治疗及预后,并复习国内外相关文献,探讨AIDS-DLBCL的临床特点、发病机制、治疗现状以及ASCT在AIDS-DLBCL治疗中的意义。
1 病例报告
患者1,男性,29岁,于2020年1月发现左侧胸壁无痛性包块,约2 cm×3 cm大小,质硬,活动度差,包块呈进行性增大至10 cm×8 cm大小(图1)。2020年2月4日在外院行“左侧胸壁包块切除术”,术后病理学检查提示:DLBCL,生发中心型。免疫组织化学(免疫组化)结果显示:瘤细胞Bcl-2(约20% +),Bcl-6(+),CD10(+),CD20(+),CD79a(+),CD31(-),CD3(-),CD4(-),CD5(-),CD8(-),Cyclin-D1(-),Mum-1(-),P53(约90% +),Ki67(约90% +)。2020年2月12日就诊于我院,查HIV抗体阳性;经武威市疾病预防控制中心(疾控中心)采用免疫印迹法确诊HIV抗体阳性。肿瘤负荷指标乳酸脱氢酶303 U/L,血沉45 mm/1 h,铁蛋白124.7 ng/ml,β2微球蛋白 3.43 μg/ml。诊断为“AIDS-DLBCL III期 A组,KPS评分80分,ECOG评分2分,IPI评分2分,低中危组”。随即给予“拉米夫定300 mg/d 口服,替诺福韦300 mg/d 口服”抗HIV治疗(因家属不愿患者知情HIV感染,故未在我市疾控中心领药,仅此2联药物抗病毒持续治疗),同时进行R-CHOP方案化疗6周期,2020年8月24日查高敏HIV RNA定量检测病毒转阴,评估病情完全缓解。2020年9月9日行环磷酰胺(cyclophosphamide, CTX)3.0 g +依托泊苷(etoposide, VP-16)500 mg方案动员化疗。2020年9月17—20日给予粒细胞刺激因子300 μg 2次/d,皮下注射动员造血干细胞。9月21—22日进行外周血造血干细胞采集、冻存,采集CD34+T细胞计数共计11.89×106/kg。2020年10月9—13日行全身照射(6 Gy)联合化疗药物(长春新碱+表柔比星+阿糖胞苷+依托泊苷+环磷酰胺)方案预处理。2020年10月15日行外周血造血干细胞回输,移植后未发生严重感染、肝静脉闭塞征等症状,于移植后+12 d(2020年10月27日)顺利出仓。2021年2月1日复查高敏HIV RNA定量检测为247 000 copies/ml,调整抗病毒药物为“拉米夫定300 mg/d,替诺福韦300 mg/d,依非韦伦600 mg/d”三联抗病毒治疗。此后患者每3个月复查1次,病情稳定,目前处于完全缓解状态。
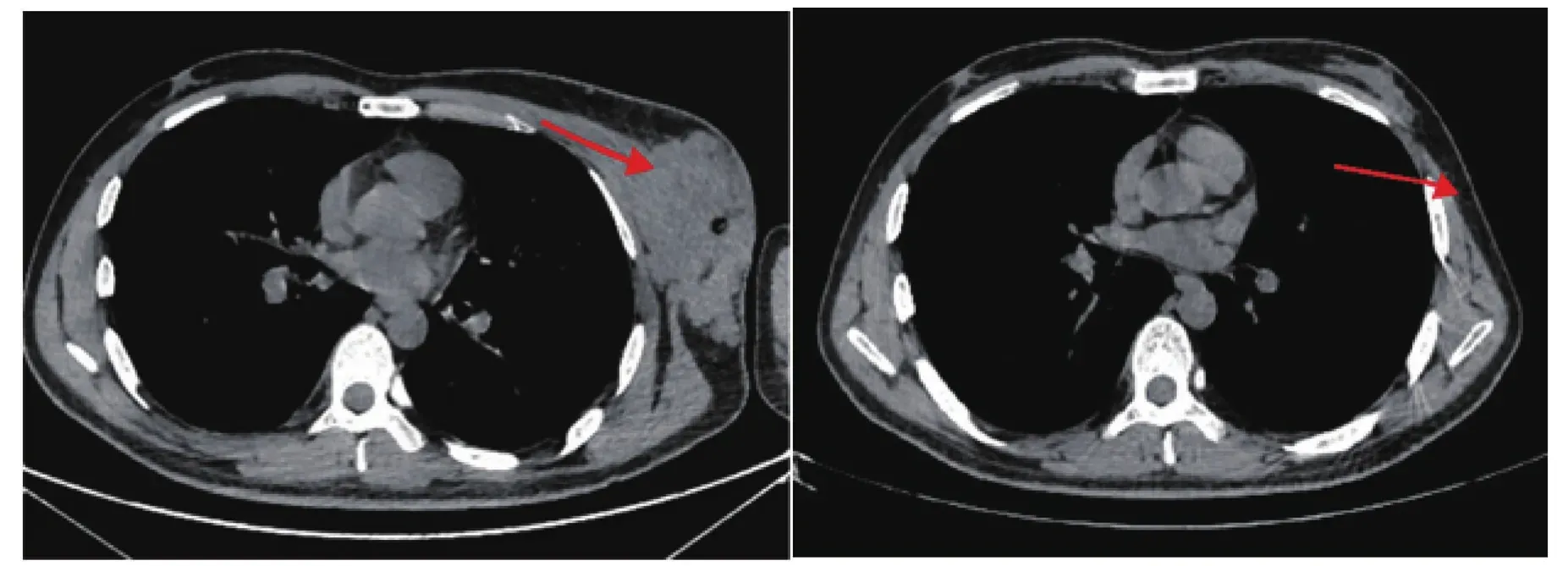
图1 患者1左侧胸壁包块治疗前(左图)后(右图)胸部CT图片肿块见红色剪头所示Figure 1 Chest CT image of patient 1 before and after treatment of left chest wall mass
患者2,男性,49岁,2020年9月右侧腋窝出现1个2 cm×1 cm大小肿物,当时无任何不适,后肿物进行性增大至4 cm×5 cm大小(见图2A),伴局部胀痛,外院检查发现HIV阳性(具体病毒载量不详),未行特殊治疗。2020年11月出现双眼视物模糊、复视,以右侧为著,右眼外展功能障碍。2020年11月24日就诊于武威市凉州医院感染科,口服“拉米夫定片300 mg/d,替诺福韦酯300 mg/d,依非韦伦片600 mg/d”三联抗病毒治疗。2020年12月7日前来我院就诊,遂行右侧腋窝肿物完整取检术(见图3),病理检查示:(淋巴结)NHL,DLBCL,生发中心来源(高侵袭性)(见图4)。免疫组化染色:瘤细胞示CD20(+),CD79(+),CK(-),CD3(+),CD10(+),Bcl-6(+),MUM-1(50% +),Bcl-2(+),MYC(40% +),Ki67(70% +),诊断为“AIDS-DLBCL Ⅲ期 B组,KPS评分70分,ECOG评分:2分,IPI评分3分 ,中高危组”。查CD4+T细胞计数为113 cells/μl,乳酸脱氢酶1711 U/L,血沉 102 mm/1 h,β2 微球蛋白 0.34 μg/ml,铁蛋白476.4 ng/ml。2020年12月7日采用R-CHOP方案化疗,化疗后患者右侧腋窝淋巴结明显缩小,疼痛症状减轻。2021年1月5日以R-CHOP方案行第2周期化疗,化疗后行腰穿+鞘内注射(甲氨蝶呤、阿糖胞苷、地塞米松)治疗中枢神经受侵,治疗后患者双眼视物模糊症状好转,右眼外展功能基本恢复。为进一步强化巩固治疗,为ASCT做准备,调整为R-MA方案化疗,化疗后患者视物模糊症状明显好转,右眼外展神经功能恢复正常。2021年3月1日患者查CD4+T细胞计数为206 cells/μl,高敏HIV RNA病毒载量检测小于最低检测下限(20 copies/ml),全面评估病情完全缓解(见图2B)。2021年3月4日行CTX 2.6 g + VP-16 500 mg方案动员化疗,2021年3月12—15日给予粒细胞刺激因子300 μg,2次/d,皮下注射动员造血干细胞,3月16—17日进行外周血造血干细胞采集、冻存,采集CD34+T细胞计数共计6.8×106/kg。2021年4月10日起行全身照射(6 Gy)联合化疗药物(长春新碱+表柔比星+阿糖胞苷+依托泊苷+环磷酰胺)方案预处理,2021年4月16日进行ASCT,过程顺利,移植后+ 10 d白细胞植入成功,移植后+13 d血小板植入成功后出仓。出院后患者按期来院复查,淋巴瘤病情处于完全缓解状态,移植后继续上述三联抗HIV治疗至今,2021年6月5日、2022年4月13日复查高敏HIV RNA载量均提示未检测到。
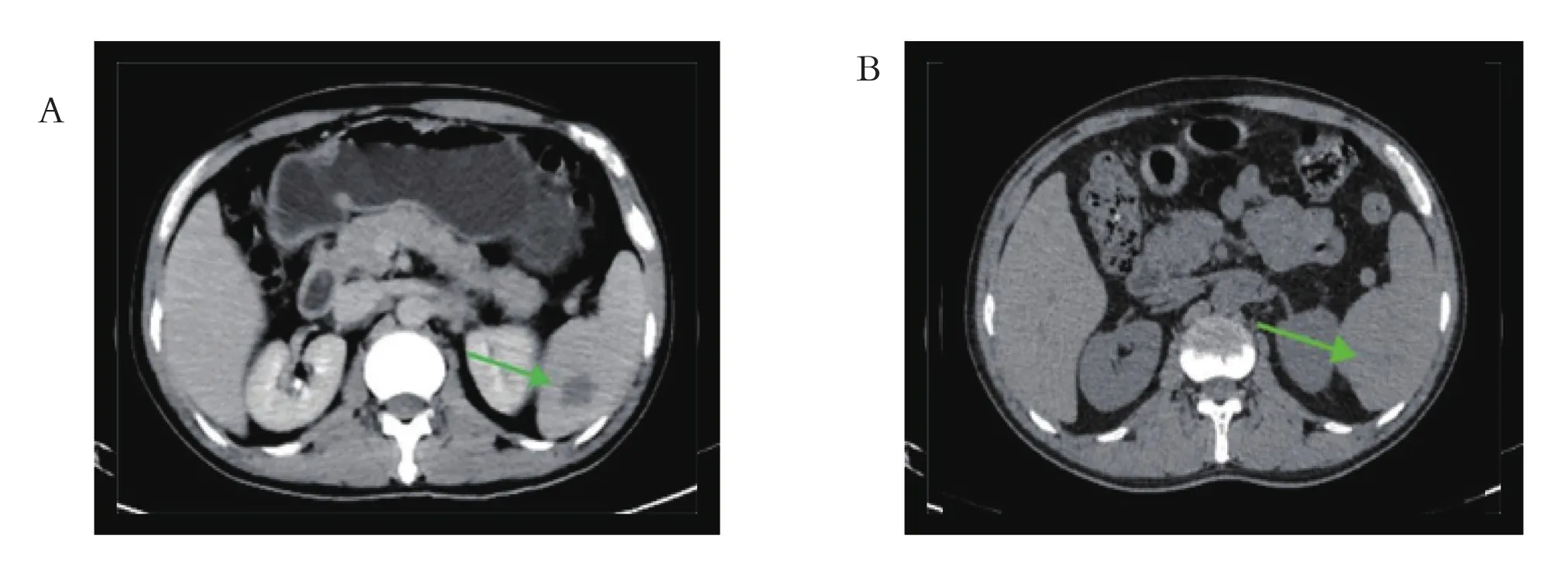
图2 患者2治疗前后腹部CT图片A.治疗前, 脾脏结节影(绿色剪头所示),考虑淋巴瘤;B. 治疗后,脾脏结节影消失(绿色剪头所示)Figure 2 Abdominal CT images of patient 2 before and after treatment
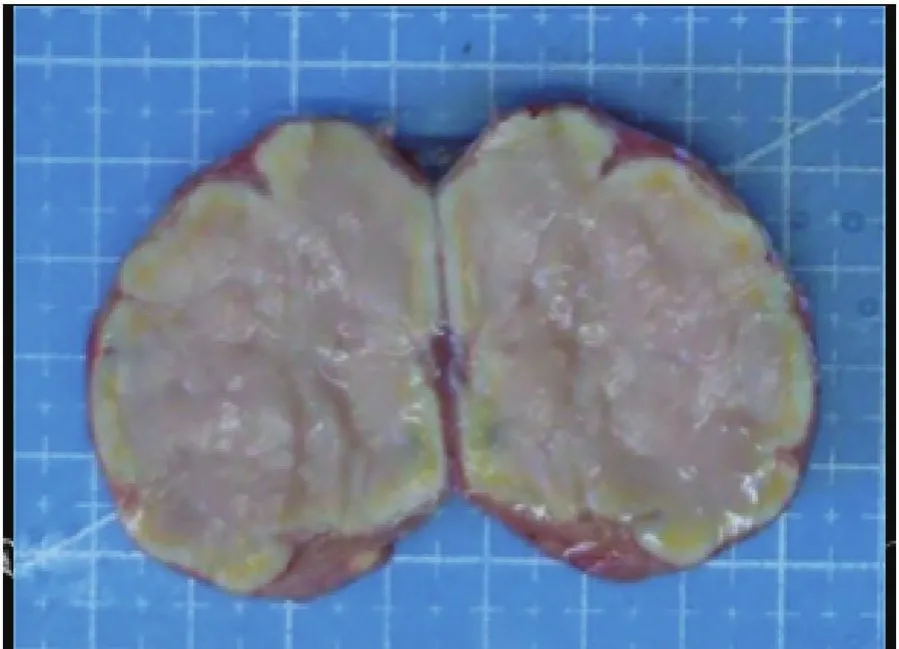
图3 患者2右侧腋窝肿物取检后肉眼观Figure 3 Macroscopic view of patient 2's right axillary

图4 患者2右侧腋窝肿物切片HE染色镜下图片Figure 4 HE stained microscopic image of patient 2's right axillary mass section
2 讨 论
AIDS-DLBCL为ARL的独特亚型之一,多发于中青年男性[12],原发部位多为淋巴结内[13-14]。cART的应用延长了AIDS患者的生存期,导致AIDS-DLBCL的发病率也较前升高,有研究显示ARL的发病率约为非AIDS人群的60倍[15],而未治疗的AIDS患者DLBCL患病风险高于经cART治疗的AIDS患者[16]。
AIDS-DLBCL发病机制至今尚不明确,可能与基因突变、EB病毒感染、慢性免疫激活(B淋巴细胞系统的慢性抗原刺激及细胞因子的过度分泌)等相关[17]。有研究证实HIV也能通过直接或间接的机制对B淋巴细胞施加影响,引起B细胞的异常增殖与分化[18]。在基因表达层面,Maguire等[19]研究显示,HIV相关生发中心亚型DLBCL当中与细胞周期进展相关的基因上调,与细胞周期抑制相关基因表达下调,DNA修复基因表达增强有关。Chao等[20]从免疫组化方面探索发现,AIDS-DLBCL患者的 c-MYC、BCL-6、PKC-b2、MUM-1和CD44蛋白水平显著升高,而p27水平降低,其中c-MYC阳性与AIDS-DLBCL患者较低的生存率相关。Thapa等[21]从细胞遗传学角度研究发现miRNA的差异性表达也与AIDS-DLBCL表型存在相关性,与非肿瘤性B细胞相比,HIV相关淋巴瘤中检测到miR-17、miR-106a、miR-106b、miR-18a和miR-19a的过度表达。
AIDS-DLBCL诊断时通常临床分期较晚,B组症状、高IPI评分以及结外器官受累为其常见表现。与HIV阴性的DLBCL患者相比,AIDSDLBCL患者发病年龄更早,B组症状发生率极高,临床症状重,分期以III-IV期居多,总生存期更短[18,22-23]。本文中2例AIDS-DLBCL患者在发病年龄、临床分期、易结外受累等方面与上述研究相符合,因2例病例均处于随访阶段,最终生存期如何有待于继续观察。
与HIV阴性淋巴瘤患者相比,ARL患者治疗的最大问题是严重的免疫抑制可能会导致化疗产生较大的风险,而这种风险主要来自于HIV相关并发症而非淋巴瘤本身,如机会性感染等[4,24]。因此,在进行淋巴瘤化疗之前,有必要进行有效的cART治疗以重建机体免疫功能,从而减少机会性感染的发生[25-26]。本文报告的2例患者一经诊断为AIDS-DLBCL即开始了cART治疗,在抗病毒、提升机体免疫功能的基础上进行淋巴瘤化疗,保证了患者有足够的免疫力耐受化疗,同时在HIV载量转阴、淋巴瘤缓解后进行ASCT治疗,整个治疗过程中2例患者均未发生病毒、真菌感染等不良并发症。
目前临床对于AIDS-DLBCL还没有标准的治疗方案[27-28]。现有研究显示,R-CHOP方案与ARL患者的总生存率和无进展生存率改善相关,且R-CHOP与cART使用不会影响患者的生存或治疗反应[29]。在接受cART治疗的AIDS-DLBCL患者中,R-CHOP方案显著提高了生存率,并降低了因淋巴瘤而导致的死亡率[25]。此外,6个周期的R-EPOCH方案被认为是AIDS-DLBCL、HHV8阳性DLBCL、原发性渗出性淋巴瘤一线治疗的首选方案,也是2019年NCCN指南中HIV相关伯基特淋巴瘤的首选方案之一[30-31]。然而,有研究发现,R-CHOP与R-EPOCH方案在改善AIDSDLBCL生存率方面无显著差异,R-CHOP方案能取得更快的应答率[32]。本文中2例AIDS-DLBCL患者初诊时偏年轻化,为了使患者取得较快的应答从而序贯ASCT治疗,选择R-CHOP方案作为首选治疗方案。
CD4+T细胞计数是AIDS患者cART疗效评价的主要指标之一,也是AIDS-DLBCL治疗时机及方案选择的重要依据。Kaplan[33]、Sparano等[28]报道CD4+T细胞计数<50 cells/μl的患者因感染性并发症而增加毒性和死亡风险,建议患者治疗时须CD4+T细胞计数≥50 cells/μl,并且第一个周期的环磷酰胺剂量根据基线CD4+T细胞计数设定(如果CD4+T细胞计数<200 cells/μl,则为375 mg/m2,如果 CD4+T 细胞计数≥ 200 cells/μl,则调整为<750 mg/m2)。本文2例患者在进行淋巴瘤治疗时,无论是治疗时机的选择还是药物剂量的应用,都参照了患者的CD4+T淋巴细胞计数和HIV RNA病毒载量(2例患者在进行淋巴瘤治疗前HIV RNA病毒载量均已转阴,且每周期化疗之前CD4+T细胞计数均>200 cells/μl)。HIV相关原发性中枢神经系统淋巴瘤(HIV-associated primary central nervous system lymphoma, HIVPCNS)通常发生在CD4+T细胞计数<50 cells/μl时,年发病率从cART时代前的1.7/1000下降到目前的0.7/1000[34]。在引入cART之前,HIV-PCNS的治疗是基于缓和性全脑放疗,反应率较低,中位生存期为3个月[35]。随着研究深入,大剂量甲氨蝶呤联合cART可用于治疗HIV-PCNS,必要时可采用鞘内注射[36],大大提高了患者的总生存率,改善了生活质量[37-38]。本文中的患者2采取了大剂量甲氨蝶呤联合阿糖胞苷和利妥昔单抗的巩固疗法,同时采用小剂量甲氨蝶呤、阿糖胞苷、地塞米松鞘内注射,显著改善了患者中枢神经系统受侵的症状,表明在cART治疗后患者免疫功能得以修复,在此基础上针对DLBCL使用利妥昔单抗联合大剂量甲氨蝶呤、阿糖胞苷治疗的安全性和有效性,并且验证了鞘内注射在治疗AIDSDLBCL患者中枢神经系统受侵中的作用。但此仅为个案报道,仍须大量临床案例进一步证实。
自从cART引入以来,高剂量强化治疗(high dose-intensive therapy, HDT)后进行外周血干细胞移植(peripheral stem cell transplantation, PBSCT)成为ARL患者的可行疗法。在一项对50例ARL患者进行的HDT和PBSCT的前瞻性研究中,中位总生存期为33个月,其中42%的患者在44个月后存活和无病生存[39],当ARL患者具备造血干细胞移植条件时,应考虑进行ASCT[40-41]。Ambinder等[41]也对异基因造血干细胞移植ART患者的安全性和有效性进行了评价,发现I级和IV级急性移植物抗宿主病的发生率及复发率高于ASCT。由此可见,HDT后进行ASCT对于治疗经cART的AIDS-DLBCL患者具有独特优势,有助于AIDS-DLBCL患者获得长期存活和无病生存。本文中的2例患者的治疗结果亦表明了上述治疗方案的临床可行性,为AIDS-DLBCL患者的治疗提供了真实世界的参考依据。然而国内外相关研究报道病例有限,且均在各种治疗的比较与探索阶段,还不能形成AIDS-DLBCL的标准治疗指南,有待于深入研究分析。
因cART治疗的应用,AIDS-DLBCL近年发病有增高趋势,其起病急、病情进展迅速、临床分期晚、治疗时机及方案难以把握。AIDS-DLBCL的发病机制涉及细胞免疫学、分子遗传学等诸多方面,有其独特的表面抗原标记、基因表达特征和miRNA水平的改变。目前,AIDS-DLBCL的治疗尚无具体指南和标准,但对于这种特殊病例的治疗探索已经取得显著成效,cART治疗是前提,也是开启DLBCL治疗的重要保障,R-CHOP方案是取得短期缓解的关键,此后的高强度化疗和ASCT已经被证实具有安全性和有效性。本研究中的2例AIDS-DLBCL患者一经确诊便开始cART治疗,通过CD4+T淋巴细胞计数来判断患者免疫功能恢复水平,选择淋巴瘤治疗时机,取得完全缓解后行ASCT,移植过程顺利,未发生严重不良反应,2例患者随访至今一般状况均良好,可为此类患者的治疗提供重要的临床资料支持。通过复习相关文献,阐述了AIDS-DLBCL的流行病学特征、发病机制、临床特点、治疗荟萃分析等供临床参考,希望让更多的AIDS-DLBCL患者获得更好的预后。

