微小RNA在原发性胆汁性胆管炎发病机制和诊疗中的作用
潘仕达,苏 楠,左焱玫,王福生,孟繁平
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是一种自身免疫介导的慢性炎症性、胆汁淤积性肝脏疾病[1],目前发病机制不明[2]。胆管上皮细胞损伤及碳酸氢盐伞受损在PBC的发病过程中较为关键[3]。临床上主要以生物化学指标升高、抗线粒体抗体阳性或肝脏组织病理学改变作为该病的诊断标准。
微小RNA(microRNA, miRNA)是一种长度为19~25个核苷酸的非编码单链小分子RNA,可通过与靶基因结合干扰mRNA翻译[4],且其异常表达与包括肿瘤、自身免疫病及感染性疾病在内的多种疾病密切相关[5-11]。据报道,miRNA在PBC患者的肝组织和血清中有显著变化[12-15],通过下游因子介导胆道损伤和免疫失调。其中,miRNA可介导胆管功能障碍,抑制胆管细胞增殖,造成肝脏纤维化。此外,miRNA也可影响机体自身抗体分泌,通过抑制调节性T淋巴细胞(regulatory T cell,Treg)、诱导辅助性T淋巴细胞(T helper cell, Th)增加、促进CD4+T细胞活化、调节外泌体介导免疫反应等方式参与PBC发病机制。不同miRNA表达差异也在PBC的诊断和病情评估中发挥作用[16]。本文将综述miRNA在PBC机制调控、诊断和治疗中的研究进展,为PBC相关miRNA研究提供思路。
1 miRNA与PBC发病机制
PBC的主要发病机制为免疫细胞被过度活化而特异性攻击小胆管细胞,导致胆管细胞功能障碍和胆道损伤。在PBC患者中有>200个miRNA表达存在异常,miRNA与PBC患者的免疫失调和胆道损伤具有重要的联系[12,16]。详见表1。
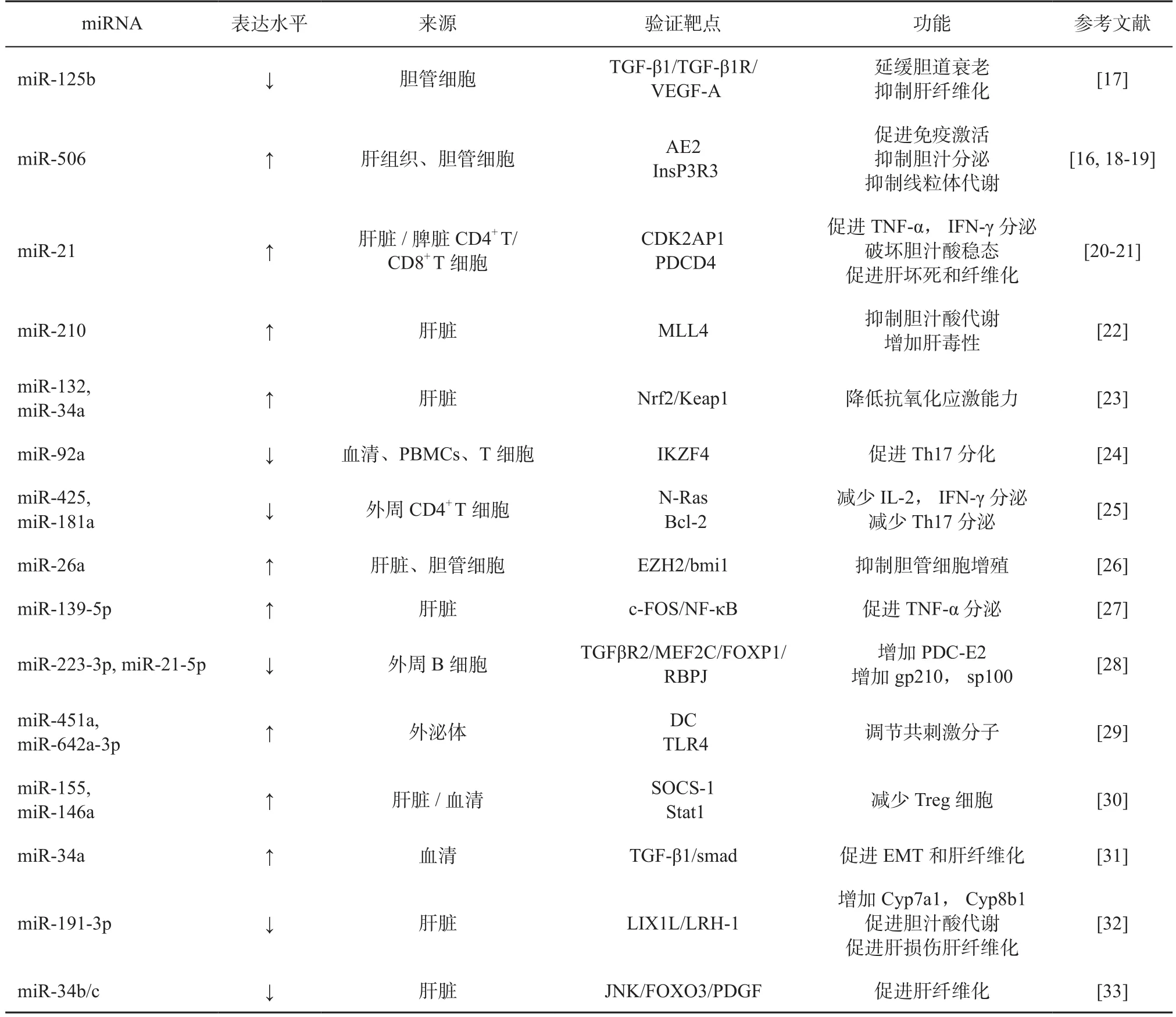
表1 参与PBC发病机制的miRNAsTable 1 miRNAs involved in PBC pathogenesis
1.1 miRNA介导PBC的胆管细胞功能障碍及胆道损伤 PBC患者中不同miRNA表达差异可介导靶基因促进胆道炎症、细胞凋亡和氧化应激[12],如 miR-506、miR-26a、miR-34、miR-125b、miR-139-5p等。其中,miR-506是参与PBC发病最重要的miRNA之一。胆管细胞顶膜的Cl-/HCO-3阴离子交换蛋白2(anion exchanger 2, AE2)能使细胞内HCO3-进入胆道,维持胆管上皮细胞(biliary epithelial cell, BEC)的碳酸氢盐伞,保护BEC免受有害胆汁酸影响[34-35]。而PBC患者胆管细胞中过表达的miR-506可与AE2结合,抑制其表达和转染,损伤胆管细胞,使其分泌功能受损[16]。IL-8、IL-12和TNF-a等促炎因子可促进miR-506表达,增强细胞应激和对胆汁酸的敏感性,并诱导胆管细胞产生PBC样特性,促进免疫激活[19]。miR-506参与III型肌醇1, 4, 5-三磷酸受体(type Ⅲ isoform of the inositol 1, 4,5-trisphosphate receptor, InsP3R3)对胆汁碳酸氢盐分泌的调节过程[18-19,35]。InsP3R3表达下调可导致胞内Ca2+信号传导和碳酸氢盐分泌障碍[36],而miR-506可特异性结合InsP3R3导致内质网Ca2+释放减少,引发胆汁淤积[16,18]。
此外,PBC中上调的miR-26a可降低多梳家族蛋白EZH2表达,抑制Bmi1对胆管细胞的增 殖[26,37]。 上 调的 miR-34a,miR-132 可 能 导致Nrf2/Keap1轴异常,影响正常氧化应激[23],而miR-34a还通过转化生长因子(transforming growth factor, TGF)-β1/smad通路靶向转化生长因子β同源诱导因子-2(transforming growth factor-beta-induced factor homeobox 2, TGIF2)促进PBC中上皮-间质转化和肝纤维化[31]。同样介导 TGF-β1 的 miR-125b则通过TGF-β1/TGF-β1R/血管内皮生长因子-A通路影响胆道衰老与肝纤维化[17]。高表达的 miR-139-5p通过 c-FOS/NF-κB信号通路介导TNF-α水平升高,加重PBC炎性反应[27]。然而也有研究报道称通过JNK-FOXO3通路上调miR-34b/c可防止肝纤维化[33]。
miR-191-3p、miR-21、miR-210等 miRNAs的异常表达可影响胆汁代谢。在PBC患者中,miR-191-3p下调促进肢体表达 1样蛋白表达,促进胆汁淤积性肝损伤,而过表达miR-191-3p可负性调控其靶基因肝受体同源物-1表达,抑制Cyp7a1和Cyp8b1表达,降低胆汁酸水平,减轻肝损伤[32]。此外,miR-21、miR-210也与坏死性凋亡和胆汁淤积有关,它们通过周期依赖性激酶2相关蛋白1或法尼酯X受体转录共激活因子—混合型白血病组蛋白甲基转移酶4促进肝细胞坏死变性和胆汁淤积[21,38-40]。其中,miR-21还与PBC中的免疫细胞活化有关,参与CD8+T细胞活化,高表达的miR-21增加了细胞因子TNF-α、IFN-γ和IL-17表达,并靶向程序性细胞死亡因子4,阻止细胞凋亡,促进 PBC 发病[20,35]。
1.2 miRNA介导PBC的免疫失调 PBC的具体发病机制尚不明,但可在病程进展中观察到免疫耐受失调[3]。miRNA异常表达可能与促进CD4+T细胞活化、抑制Treg免疫功能、诱导Th增加、持续激活B淋巴细胞影响自身抗体分泌、调节外泌体介导抗原特异性免疫反应有关。
研究证实,miR-425、miR-181a、miR-92a、miR-155、miR-146a等可通过特定信号通路促进CD4+T细胞活化。其中,下调的miR-425通过T细胞抗原受体(T cell receptor, TCR)信号通路上调N-Ras,促进CD4+T细胞活化,诱导IL-2、IFN-γ等促炎因子过度产生[25,41]。而miR-181a可通过下调靶基因bcl-2介导促炎Th17增加和抑炎Treg减少[42]。在PBC患者中下调的miR-92a也可增加促炎Th17活化,增加IL-17表达介导组织炎症发生[43],然而miR-92a的下调对Treg无明显影响[24]。上述研究表明,miR-181a和miR-92a在PBC中的下调以不同方式作用于促炎Th17,增加IL-17表达介导组织炎症发生。而miR-155和miR-146a参与对Treg的调控。高表达的miR-155与细胞因子信号抑制因子-1(suppressor of cytokine signaling, SOCS-1)和Treg标志物FoxP3表达水平呈负相关[44],而SOCS-1可增强Treg的免疫抑制功能[45]。作为Toll样受体(Toll-like receptor, TLR)的负调节因子,miR-146a可减少炎症介质响应TLR刺激[46-47],并靶向信号传导转录激活因子1(signal transducer and activator transcription-1, Stat1)控制Treg介导IFN-γ调节[48]。在PBC患者中,miR-155和miR-146a的表达显著增加[30],通过负调节SOCS-1/Stat1和TLR介导免疫反应破坏机体Th1和Th2动态平衡抑制Treg免疫功能,加重PBC炎性反应。
除参与T细胞调控外,miRNA也参与B淋巴细胞激活和相关抗体分泌。Zhang等[28]观察到在miR-223-3p、miR-21-5p下调的PBC患者中,线粒体抗丙酮酸脱氢酶复合体E2亚基(pyruvate dehydrogenase complex E2, PDC-E2)特异性B淋巴细胞被持续激活,抗核抗体(gp210、sp100)水平显著升高。miR-223-3p,miR-21-5p的潜在靶基因(TGFBR2、MEF2C、FOXP1和RBPJ)参与细胞分化、迁移、细胞凋亡、信号转导等途径,提示miR-223-3p,miR-21-5p可能与B细胞分化和激活、分泌及PDC-E2抗体相关[49]。
血清外泌体的miRNA可能在免疫调控中发挥作用,如miR-451a、miR-642a-3p等。miR-451a已被证明可调节树突状细胞(dendritic cell, DC)细胞因子[50],miRNA-642a可调节单核细胞TLR4翻译[51]。而PBC患者外泌体miR-451a和miR-642a-3p含量升高[29],提示miRNA可能参与适应性免疫反应,协调抗原递呈细胞,参与对DC的激活并上调表面标志物的表达。上述研究结果证实miRNA通过不同的信号通路参与PBC的发病,这也为PBC及胆汁淤积性肝病提供了潜在的治疗靶点。
2 miRNA在PBC中的诊断和治疗潜力
作为潜在的生物标志物,miRNA具有蛋白标志物无法比拟的优势,其能够稳定存在于循环中且与多种人类疾病密切相关。PBC患者miRNA的异常表达在诊断和评估治疗效果方面可能具有价值,详见表2。

表2 PBC潜在生物标志物的miRNATable 2 miRNA as potential biomarkers for PBC
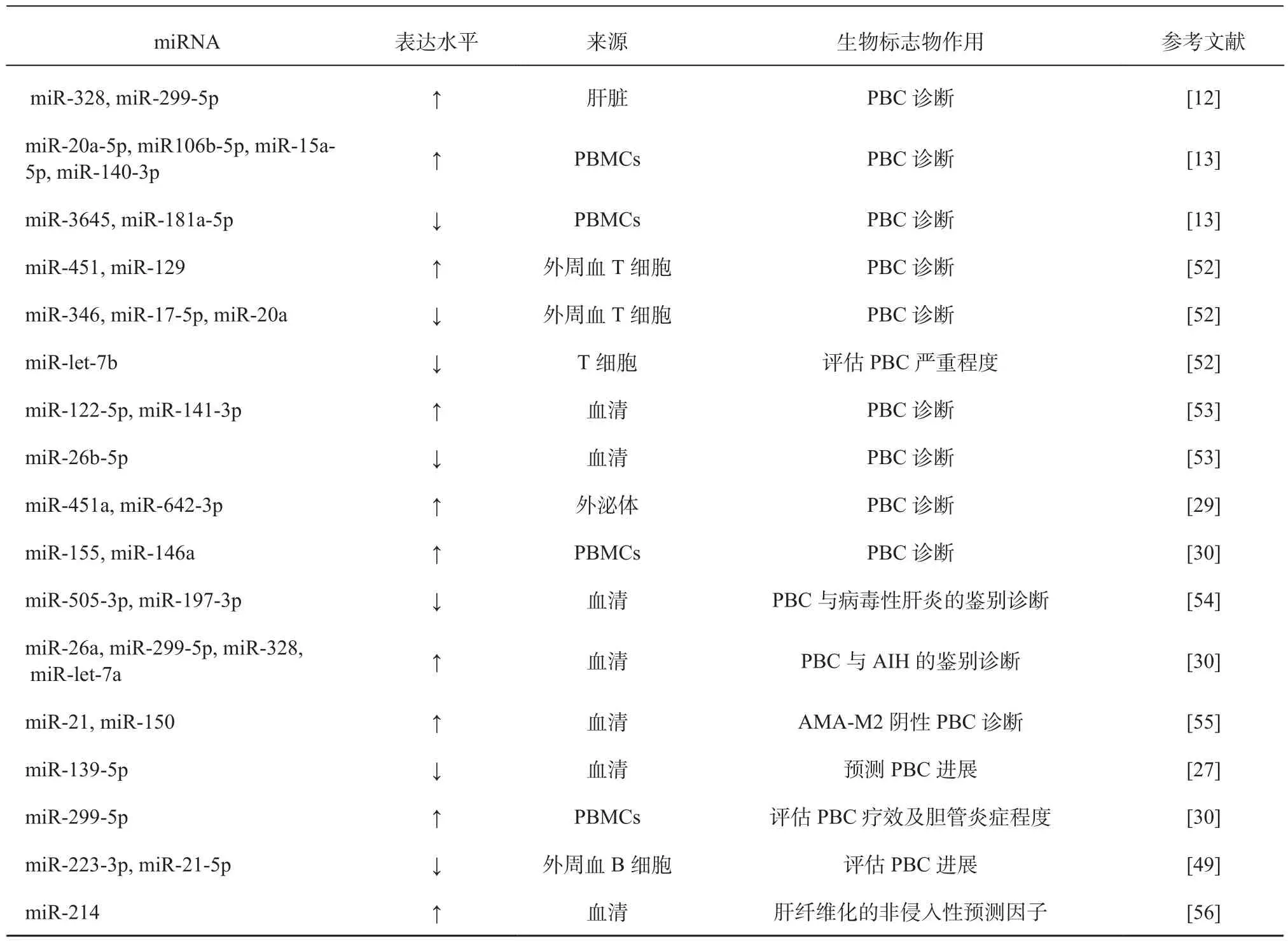
续表2
2.1 miRNA作为辅助早期诊断和鉴别诊断的生物标志物 PBC的临床诊断主要基于抗线粒体M2型(Anti-mitochondrial antibody subtype M2,AMA-M2)抗体、血清ALP、谷氨酰转肽酶(glutamyl transpeptidase, GGT)等生物化学指标以及组织病理学的改变。研究证实miRNA可辅助PBC诊断及与其他肝病的鉴别。
最早的研究报道称,在PBC患者肝组织中miR-122a,miR-26表达下调,而miR-328,miR-299-5p表达上调[12]。在PBC外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)中也发现了miRNA的表达异常,miR-15a-5p、miR-20a-5p、miR-140-3p、miR-106b-5p表达升高,而miR-3645、miR-181a-5p表达降低[13]。另有报道称在PBMCs中miR-155,miR-146a表达也显著增加[30]。最近研究报告了一组miRNA组合(miR-122-5p、miR-141-3p及 miR-26b-5p) 对 PBC 具有较高诊断准确性(AUC为0.905,95% CI:0.857~0.953,敏感度80.5%,特异度88.3%),该miRNA组合的诊断准确度高于ALP(AUC为0.537,95% CI:0.195~ 0.434,P < 0.001)、抗核抗体(antinuclear antibody, ANA)(AUC为0.739,95% CI:0.012 ~ 0.213,P=0.0282),但低于AMA-M2抗体(AUC为0.982,95% CI:0.0618~0.198,P=0.0002)。对PBC不同临床阶段(临床前、无症状、有症状和肝功能不全)患者分析后(AUC分别为0.835、0.879、0.867和0.901)得出,该组合诊断性能与疾病状态无关[53]。
在鉴别方面,下调的miR-505-3p,miR-139-5p,miR-197-3p可能作为PBC患者临床诊断和与病毒性肝炎鉴别诊断的重要标记分子[54],而miR-26a,miR-299-5p,miR-328,miR-let-7a在 PBC患者中的上调可能在鉴别自身免疫性肝炎与PBC中发挥重要作用[30]。在另一项研究中,AMA-M2阴性PBC患者血清miR-21,miR-150水平明显高于健康对照及AMA-M2阳性PBC患者,且与AMA-M2抗体滴度呈负相关(miR-21:r=0.4,P=0.001; miR-150:r=0.3,P=0.016);相比于肝硬化或肝纤维化患者,非肝硬化PBC患者miR-21表达显著增加(P<0.05)[55]。该结果也为AMA-M2阴性且无明显肝硬化的早期PBC诊断提供潜在检测指标。除miR-21外,miR-214在患有严重肝纤维化(F3~F4)胆道闭锁患者肝组织中表达显著上调,ROC分析显示,预测严重肝纤维化miR-214截点水平为0.805(P=0.0046)[56]。因此,miR-21,miR-214可能作为肝纤维化的非侵入性预测因子。
2.2 miRNA早期分期评估辅助预测PBC疾病进展 在PBC不同分期和亚型中,miRNA存在表达差异。研究显示,19个miRNAs在缓慢进展型PBC患者与肝功能衰竭和门静脉高压患者之间存在表达差异,而晚期PBC患者血清中miR-139-5p的表达明显低于早期PBC患者和健康对照,这也提示其在预测疾病进展方面具有潜在价值[27]。另一项研究报道了中重度胆管炎(2~3级)PBC患者的miR-299-5p表达水平显著高于轻度胆管炎(0~1级)[57]。相比之下,活动性肝炎的严重程度与miR-299-5p表达水平无相关性[30]。与上述研究结果相似的是,miR-223-3p和miR-21-5p从PBC I期到III期显示出一致的下调和表达抑制[49]。而在T细胞中,miR-let-7b的表达水平与Mayo风险评分、IL-18、ALP水平呈负相关,并随着PBC严重程度的增加而表达降低(I>II/III>IV期)[52]。上述miRNAs有可能成为预测疾病进展的关键生物标志物。
2.3 miRNA在PBC中作为疗效评价靶点的潜力 熊去氧胆酸(ursodeoxycholic acid, UDCA)是治疗PBC的一线药物,但仍有40%的PBC患者应用UDCA治疗效果不佳。目前采用的疗效评价存在耗时较长,检测指标多等问题。在研究难治性PBC相关miRNA时发现,血清DBIL、AST、ALT、GGT水平升高与miR-122、miR-378f表达上调有关,miR-4311表达降低与AST和ALT水平下降有关,miR-4714-3p水平与TBIL、LDH水平呈负相关。研究者指出miR-125b,miR-let-7b,miR-520a-5p等miRNAs可能成为难治性PBC的潜在生物标志物[15]。研究显示,对UDCA耐药的PBC患者PBMC中的miR-299-5p的表达增加,miR-299-5p表达与ALP、GGT和IgM水平正相关[30],提示通过miR-299-5p靶向蛋白与PBC的疾病活动和状况相关。另一项研究也表明UDCA的治疗反应与胆管减少症的关系更密切[58]。上述研究初步地对耐药PBC患者与健康人的miRNA表达差异进行讨论,后续仍需要在耐药组和敏感组PBC患者中进行进一步的对比和验证,同时注意UDCA治疗对PBC患者miRNA表达水平变化的影响。
2.4 基于miRNA作为靶点治疗PBC的进展 在dnTGF-βRII小鼠中,研究者利用依诺沙星上调miR-346-5p、miR-326-3p、miR-181a、miR-145a-5p等miRNAs的表达,从而下调关键效应T细胞转录因子的表达,来介导IFN-γ和穿孔素的CD8+T细胞效应功能下调,有效地阻止自身免疫性胆道疾病的进展[59]。部分miRNA抑制剂(反义寡核苷酸)和miRNA类似物如miR-375抑制剂、antagomiR-155和miR-24类似物等已应用于某些疾病的治疗。但目前仅有miR-125a纳米颗粒和miR-103-3p外泌体在系统性红斑狼疮和诱导肝星状细胞活化中应用的报道[60-61]。miRNA在体内不能保持有效抑制所需的高剂量,使得miRNA靶向药物在临床应用中受到限制[62],病毒介导的miRNA转染相关免疫反应的不良反应也未得到有效解决。
3 总结及展望
miRNA在PBC发病及进展的过程中具有关键作用,其机制研究将有利于探索PBC新的治疗靶点,且特定miRNA组合可能在临床实践中具有诊断价值。虽然miRNA在PBC疗效预测方面的作用也已被初步证实,但受限于样本量及标准治疗的影响,后续需要来自多个中心的更多人群以及接受治疗前后的对比差异研究,来评估miRNA与治疗反应以及预后预测的临床结果之间的相关性。miRNA作为无创生物标志物展现出独特优势,是早期病情评估的重要补充。而探究在PBC发病过程中参与的miRNA可提供潜在的治疗靶点选择,为PBC提供新的诊疗策略思路。

