PI3K和Notch信号途径对寻常型银屑病患者外周血CD4+T细胞的增殖和活化发挥协同调控作用
刘佳, 魏明
郑州大学第五附属医院检验科,河南 郑州 450052
银屑病是一种由免疫细胞异常导致的慢性炎性疾病,特别是CD4+T细胞和诸多相关炎性因子在其致病过程中发挥着主要作用[1-4]。有关银屑病相关信号转导途径及细胞调控信号的研究是目前热点和关注点[5]。磷酯酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)在寻常型银屑病患者外周血单个核细胞的表达较正常对照者显著增加,且其活性在寻常型银屑病患者皮损表皮表达较正常对照皮肤表皮升高明显[6-7]。也有研究显示寻常型银屑病患者骨髓造血干细胞Notch1表达较健康对照组显著升高,且Notch信号途径下游靶基因Hes-1蛋白水平显著增加[8]。这些研究结果均提示PI3K和Notch信号传导途径广泛参与了T细胞的表达[9-10]。为进一步了解PI3K和Notch信号途径与寻常型银屑病患者外周血CD4+T细胞极化和增殖关系,本研究以PI3K信号途径和Notch信号途径对寻常型银屑病患者外周血CD4+T细胞周期调节蛋白(Cyclin)D1、Cyclin A及P27kipl为切入点,探讨PI3K和Notch信号途径在寻常型银屑病患者外周血中CD4+T细胞增殖、分化及活化中的调控作用。
1 对象与方法
1.1 临床资料
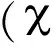
1.2 标本采集
于就诊次日清晨空腹使用肝素抗凝试管抽取所有受试者外周血10 mL,抗凝血用于分离CD4+T细胞。
1.3 使用试剂
主要抗体:兔抗鼠Cyclin D1-PE、兔抗鼠P27kipl-PE、兔抗鼠CyclinA、羊抗兔IgG-PE(美国Santa Cruz);Trizol(美国Invitrogen);兔抗鼠CD4+T细胞-FITC(美国eBioscience);引物Primer 5.0(上海基康);RT-聚合酶链反应试剂(美国Fermentas);小鼠CD4+T细胞阴性筛选试剂(挪威Dynal);改良型RPMI 1640(美国Hyclone);FBS(杭州四季青生物科技有限公司)。
1.4 细胞分离
应用聚蔗糖-泛影葡胺密度梯度离心法分离外周血单个核细胞;采用免疫磁珠法将单个核细胞中的CD4+T细胞进行分离,流式细胞术检测CD4+T细胞纯度;采用0.4%锥虫蓝对CD4+T淋巴细胞染色,以便观察存活细胞百分率。
1.5 实验分组和处理
10% FBS的RPMI1640培养基混悬细胞,CD4+T细胞含量稀释为1×106个/mL,分成4组:空白对照组(磷酸盐缓冲液+患者CD4+T细胞),LY294002组(10 μmol/L LY294002+患者CD4+T细胞),DAPT组(25 μmol/L DAPT+患者CD4+T细胞),LY294002+DAPT组(10 μmol/L LY294002+25 μmol/L DAPT+患者CD4+T细胞),各组每个孔均以PHA 10 μg/L和IL-2 1 000 U/mL刺激增殖6 h后进行干预,置于5% CO2、37 ℃恒温箱培养2 d,取出备用。
1.6 CD4+ T细胞Cyclin A、Cyclin D1和P27kipl蛋白水平的检测
每组各取3管,磷酸盐缓冲液清洗1次,4% PAF固定液固定10 min,用85%酒精溶液固定2 h,清洗后置入0.3% TritonX-100的磷酸盐缓冲液10 min以破坏细胞膜,向各组试管中分别加入0.1 mL稀释度为1∶60的兔抗鼠P27kipl、Cyclin A、Cyclin D1抗体,4 ℃过夜;加入稀释度为1∶50的羊抗兔IgG-PE荧光抗体0.1 mL,暗室孵育30 min;阴性对照加入正常兔IgG克隆抗体替代一抗,其余方法同上;清洗后加入0.2 mL 4% PAF固定液固定混悬细胞暗室保存,30 min内用FCM测定,每份样本检测细胞1×104个,FlowJo软件包对检测数据处理,用CD4+T细胞中PE激发的阳性细胞百分率计算Cyclin A、CyclinD1和P27kipl蛋白表达水平。
1.7 逆转录-聚合酶链反应检测CD4+ T细胞Cyclin A、Cyclin D1和P27kipl的mRNA表达水平
采用Trizol法对细胞匀浆RNA进行提取,按照PCR试剂说明书进行操作。聚合酶链反应体系容积25 μL,具体参数为:94 ℃预变性5 min后,94 ℃ 30 s,退火30 s,72 ℃延伸1 min,循环40次,72 ℃ 10 min;以Gel-pro32软件进行图像处理,以产物荧光强度与β-actin产物荧光强度比值来计算目的基因相对表达。逆转录-聚合酶链反应相关引物序列见表1。

表1 引物序列
1.8 统计学处理
所有数据采用SPSS 16.0处理分析,计量资料以均数±标准差表示。两组间Cyclin A、Cyclin D1、P27kipl蛋白、mRNA水平等比较采用t检验,多组间比较以One-way ANOVA分析,P<0.05为差异有统计学意义。
2 结果
2.1 实验获得CD4+ T细胞分析
流式细胞仪检测干预后CD4+T细胞纯度为(90.00±5.20)%;采用0.4%锥虫蓝对干预后CD4+T细胞进行染色,CD4+T细胞存活率为(94.80±4.10)%,符合实验要求。
2.2 CD4+ T细胞Cyclin A、Cyclin D1和P27kipl蛋白和mRNA表达
与健康对照组比较,寻常型银屑病患者组Cyclin A和Cyclin D1 mRNA水平及蛋白水平均明显升高(均P<0.05),而P27kiplmRNA水平及蛋白水平均明显降低(均P<0.05,表2)。
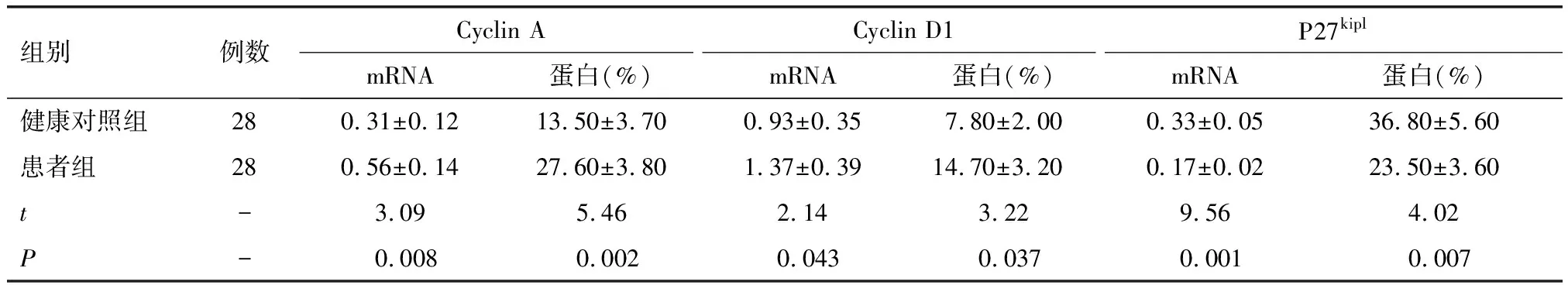
表2 健康对照组与患者组外周血CD4+T细胞Cyclin A、Cyclin D1和P27kipl表达水平 (mean±SD)
2.3 PI3K和Notch信号通路对寻常型银屑病患者外周血CD4+ T淋巴细胞Cyclin A、Cyclin D1、P27kipl mRNA表达水平的影响
与空白对照组CD4+T细胞Cyclin D1 mRNA表达比较,LY294002组、DAPT组和LY294002+DAPT组明显降低(均P<0.01),与LY294002组、DAPT组比较,LY294002+DAPT组CD4+T细胞Cyclin D1 mRNA水平降低更为明显(P值分别为0.022、0.002);与空白对照组CD4+T细胞P27kiplmRNA水平比较,LY294002组、DAPT组和LY294002+DAPT组表达明显升高(P值分别为0.018、0.002、0.003),且LY294002+DAPT组P27kiplmRNA表达水平较LY294002组、DAPT组更高(均P<0.01);空白对照组、LY294002组、DAPT组和LY294002+DAPT组CD4+T细胞Cyclin A mRNA表达无明显差异(P=0.059,表3)。
2.4 PI3K和Notch信号途径对寻常型银屑病患者外周血CD4+ T细胞Cyclin A、Cyclin D1、P27kipl蛋白的影响
与空白对照组CD4+T细胞Cyclin D1的蛋白表达比较,LY294002组、DAPT组和LY294002+DAPT组明显降低(P分别为0.005、0.006、0.001),与LY294002组、DAPT组比较,LY294002+DAPT组CD4+T细胞Cyclin D1的蛋白水平降低更为明显(P分别为0.031、0.024)。与空白对照组CD4+T细胞P27kipl的蛋白比较,LY294002组、LY294002+DAPT组表达明显升高(P分别为0.018、0.004),与LY294002组、DAPT组CD4+T细胞P27kipl的蛋白比较,LY294002+DAPT组显著升高(均P<0.01)。空白对照组、LY294002组、DAPT组和LY294002+DAPT组CD4+T细胞Cyclin A蛋白表达无差异(P=0.087),详见表3。
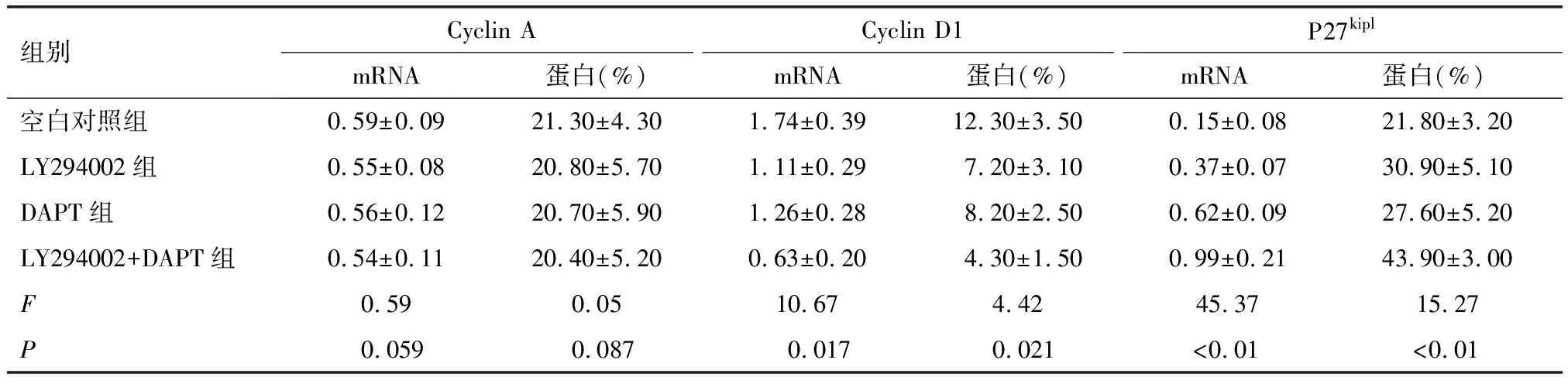
表3 联合干预后各组外周血CD4+T细胞Cyclin A、Cyclin D1和P27kipl的表达水平 (mean±SD)
3 讨论
目前普遍认为,银屑病是一种发病机制复杂的慢性炎症性皮肤疾病,T淋巴细胞异常增殖、分化和活化及相关炎性细胞因子的释放在慢性炎症反应中起着重要作用[12]。CD4+T细胞周期时相的变化反映了银屑病CD4+T淋巴细胞活化、增殖的情况,对维持细胞周期的正常运行、细胞周期蛋白的调控具有重要作用[13]。
细胞周期是细胞增殖的最终途径,细胞周期能否顺利进行依赖细胞周期调控蛋白调控,Cyclin A和Cyclin D1是调节G1期的一种细胞周期调控蛋白,可与细胞周期蛋白依赖激酶结合形成复合物,在细胞周期蛋白依赖激酶作用下发生磷酸化,可促使细胞通过G1-S调控点,使CD4+T细胞进入分裂程序,而P27kipl作为细胞周期蛋白依赖激酶抑制因子,通过抑制Cyclin A和Cyclin D1与细胞周期蛋白依赖激酶结合形成复合物的活性,从而抑制CD4+T细胞增殖。本研究结果显示,与健康对照组比较,寻常型银屑病患者外周血中CD4+T细胞内相关正向调节物质Cyclin A和Cyclin D1的mRNA表达及蛋白表达显著升高,而负向调节物质P27kiplmRNA表达及蛋白表达显著降低。研究显示,由体内干预和基因敲除研究显示,在P27kipl表达缺陷小鼠体内,外周血CD4+T细胞水平明显升高[18]。因此推测寻常型银屑病患者CD4+T细胞Cyclin A、Cyclin D1水平升高,同时P27kipl蛋白表达下降,可能加快了外周血CD4+T细胞周期,引起寻常型银屑病患者外周血CD4+T细胞异常增殖、分化及活化。
有研究表明,阻滞PI3K信号途径能加速诱导Treg细胞产生[7]。Notch信号途径活化后可影响T淋巴细胞的增殖、分化及活化,异常活化的Notch信号途径可引起机体免疫系统的紊乱[14-15]。Hes-1是Notch信号途径的靶向蛋白,在CD4+T细胞活化、分化进程中发挥重要影响[16]。当Notch信号途径异常诱导CD4+T细胞活化时,Hes-1通过调节CD4+T细胞活化基因的转录,从而对CD4+T细胞活化起到负反馈调节影响[17]。因此PI3K和Notch信号途径与CD4+T细胞的活化、增殖密切相关。
本研究采用LY294002和DAPT对寻常型银屑病患者外周血CD4+T细胞进行联合干预实验,结果显示,与LY294002组、DAPT组比较,细胞周期正向调节物质Cyclin D1水平明显下降,同时负向调节物质P27kipl水平明显升高。因此可推测PI3K和Notch信号途径对寻常型银屑病患者外周血CD4+T细胞增殖、分化及活化具有协同作用,其作用机制可能是通过协同介导CD4+T细胞内的正向调节物质Cyclin D1蛋白和基因水平升高,负向调节物质P27kipl蛋白和基因水平降低,而促使细胞增殖、分化及活化的进程中G1期向S期这一重要节点跨越,实现对CD4+T细胞增殖的协同调控。
综上所述,细胞周期蛋白Cyclin A、Cyclin D1、P27kipl可能参与了寻常型银屑病CD4+T细胞异常增殖、分化及活化的调控,Notch和PI3K信号途径对其具有协同调节作用。下一步尚需深入研究其具体作用机制,以便为相关靶向治疗寻常型银屑病的研究提供新思路。

