多年生黑麦草LpPIL5基因特征分析及转录调控
姚佳明,何悦,郝欢欢,黄心如,张敬,徐彬
(南京农业大学草业学院,江苏 南京 210095)
光是植物生长发育最重要的调控因子之一。植物长期处于黑暗条件下,会呈现茎细长柔弱、子叶不展开、叶片细小、叶片黄化等特征;而在正常光下,植物则呈现出茎粗壮、子叶展开和叶片发达等表型,这种受光强、光质或光周期调节的生长发育过程称为植物的光形态建成[1-2]。光敏色素是一种可溶性色素蛋白,以吸收红光的非活性形式(red-absorbing phytochrome,Pr)和吸收远红光的活性形式(far red-absorbing phytochrome,Pfr)存在,具有生理活性的Pfr能够快速地从细胞质转移到细胞核,通过结合光敏色素互作因子(phytochrome-interacting factors,PIFs),进而调控光响应基因的转录水平[3-4]。PIFs属于bHLH(basic helix-loop-helix)转录因子家族的一个亚家族,是光信号通路关键转录因子[5],通过直接调控其下游基因的转录来抑制种子萌发、促进幼苗光形态建成和提高植物耐荫性等[6]。PIFs中的bHLH功能域由约15个氨基酸组成的碱性区(basic region)和约60个氨基酸组成的螺旋-环-螺旋(helix-loop-helix)区组成,其中的碱性区能够与顺式作用元件G-box(CACGTG)特异性地结合,调控靶基因表达[7-15]。
近年来,越来越多的研究证实PIF家族成员不仅是光信号调节途径的关键转录因子,还常作为细胞信号枢纽,能够整合多种信号,成为其他信号通路的关键组成部分。例如,PIF在光信号和植物激素信号传导之间起到重要的桥梁作用[16]。PIF家族成员之间的功能也存在差异[17],例如,拟南芥(Arabidopsis thaliana)中有8个PIFs成员[18],包括PIF1(PIL5,At2G20180),PIF3(At1G09530),PIF4(At2G43010),PIF5(PIL6,At3G59060),PIF6(PIL2,At3G62090),PIF7(At5G61270),PIF8(At4G00050)和PIL1(At2G46970)。PIF1在黑暗条件下负调控叶绿素的合成和种子萌发,而光诱导PIF1的降解减缓了这一负调控作用,进而促进拟南芥光形态建成[12];将拟南芥pif4缺失突变体幼苗和野生型拟南芥幼苗从22℃转移到28℃时发现,pif4突变体幼苗明显缺乏下胚轴和上胚轴伸长以及叶片下垂的能力。此外,这种温度变化还会引起PIF4转录水平快速升高[19-20];在光照条件下,PIF3能通过诱导光敏色素B的降解来降低植物对光的响应从而调节拟南芥下胚轴的伸长[21]。小麦(Triticum aestivum)TaPIF3突变体和过表达株系的表型分析也表明,TaPIF3在茎的伸长和穗的生长调控中都发挥了作用[22]。PIFs不仅调控植物的光形态建成,还参与植物对逆境的响应。如Yong等[23]研究结果表明过量表达ZmPIF3在不影响玉米(Zea mays)产量的同时,能够提高玉米的耐旱性。过量表达水稻(Oryza sativa)OsPIL1基因不仅提高了转基因植物的耐旱性,还促进了细胞伸长生长[24]。Zhang等[25]研究发现拟南芥光敏色素互作因子AtPIF5具有正调控黑暗诱导叶片衰老和叶绿素降解的功能。另外,拟南芥AtPIF5也能够调控乙烯合成和植物激素信号传导[26]。基于以上研究结果,光敏色素互作因子(PIFs)在植物光形态建成、耐逆调控和激素信号传导中发挥着重要作用,因此,克隆多年生黑麦草(Lolium perenne)PIFs基因,并分析其转录调控模式,可为黑麦草的耐逆(耐荫、旱和盐等)生物技术育种提供重要的候选基因。
多年生黑麦草为禾本科早熟禾亚科黑麦草属植物,是重要的冷季型牧草和草坪草。常作为草坪建植的先锋草种,广泛应用于我国的南北过渡带及以北温带地区。目前,对于多年生黑麦草PIF基因家族成员的克隆、表达模式分析及功能的研究尚未见报道。本研究从多年生黑麦草中克隆得到一个光敏色素因子(PIFs)编码基因,命名为LpPIL5,并分析了其基因组结构,启动子顺式作用元件,亚细胞定位和不同组织下的表达特性以及在不同非生物胁迫下的表达规律。研究结果可为多年生黑麦草LpPIFs转录因子的功能分析奠定基础,也可为黑麦草耐逆育种提供基因资源。
1 材料与方法
试验于2020年6月-2021年6月在南京农业大学草业学院草类生理生化与分子生物学实验室进行。
1.1 试验材料与主要试剂
以多年生黑麦草(品种为Buena Vista,购买于美国Syngenta公司)为试验材料,在人工气候室中培养,基质为蛭石、珍珠岩和泥炭土(体积比为1∶3∶9)。气候室生长条件设定为:25/20℃(白天/晚上),光照14 h,湿度为70%,光合有效辐射为750 μmol·m-2·s-1。
RNA提取试剂盒、DNA琼脂糖凝胶回收试剂盒及质粒提取试剂盒购于OMEGA BIO-TEK公司;反转录试剂盒(MonScriptTMRTⅢSuper Mix with dsDNase)及荧光定量试剂盒(MonAmpTMChemoHS qPCR Mix)购于Monad公司;DNA聚合酶(Phanta®Max Super-Fidelity DNA Polymerase)购于诺维赞生物科技股份有限公司。
1.2 LpPIL5全 长cDNA扩 增 及 测 序
以拟南芥AtPIF5基因的bHLH功能域序列为诱饵,在多年生黑麦草基因组数据库(SRA号:PRJNA335527)进行检索(basic local alignment search tool,BLAST),筛选出LpPIL5基因,利用BioXM预测LpPIL5基因编码区序列,用Primer Premier 5设计基因全长引物(表1),以多年生黑麦草叶片cDNA为模板进行PCR扩增,扩增体系为30 μL,包括:2×Phanta Max buffer 15 μL,dNTP Mix(10 mmol·L-1)0.6 μL,LpPIL5-cDNAF(10 μmol·L-1)1.2 μL,LpPIL5-cDNAR(10 μmol·L-1)1.2 μL,Phanta Max Super-Fidelity DNA Polymerase 0.6 μL,cDNA模版1 μL,ddH2O 10.4 μL。扩增程序为:95℃预变性3 min,95℃变性15 s,60℃退火15 s,72℃延伸1 min,35个循环。将PCR产物切胶纯化,经BamHI和HindⅢ双酶切后连接至入门载体pEND-Linker,转化大肠杆菌感受态细胞,挑取阳性单克隆并测序。

表1 试验所用引物Table 1 Primers used in the study
1.3 LpPIL5基因序列分析
从TAIR和NCBI数据库中获取拟南芥、水稻、玉米等物种的PIF基因及其编码的蛋白质序列,利用MEGA 6.0软件中的ClustalW程序对LpPIL5与拟南芥、水稻和玉米等物种的PIF同源蛋白进行比对,利用Neighborjoining程序构建系统进化树。利用Protparam分析LpPIL5蛋白的分子式,利用NetPhos预测该蛋白可能的磷酸化位点,用SOMPA和SWISS-MODEL分别模拟LpPIL5的二维和三维结构,用Plant Care网站预测LpPIL5启动子上游1500 bp内所包含的顺式作用元件。
1.4 昼夜节律表达模式分析
昼夜节律设定为白天和黑暗各12 h,间隔4 h取样,试验周期为48 h(图1)。固定时间点取样,提取mRNA,采用1%琼脂糖凝胶电泳和紫外分光光度计(NanoDrop 2000,Thermo,美国)检测mRNA质量,将无明显降解的mRNA反转录成cDNA。用罗氏荧光定量系统(Roche Light Cycler®480Ⅱ)并结合2-ΔΔCT[27]计算方法检测LpPIL5基因的相对表达量,LpeLF4A[28]为内参基因(GenBank登录号为:G0924770)。

图1 取样时间Fig.1 Sampling time
1.5 基因表达模式及不同组织间的表达量分析
选取长势一致的种子苗(萌发后3周)进行水培处理,培养液为Hoagland营养液,1周后进行15%聚乙二醇(polyethylene glycol,PEG)6000、100 mmol·L-1NaCl、100 μmol·L-1CdCl2、50 μmol·L-1脱 落 酸(abscisic acid,ABA)、25 μmol·L-16-苄氨基嘌呤[N-(phenylmethyl)-9H-purin-6-amine,6-BA]和高温(38℃)处理,于0、0.5、2、6、12和24 h后剪取叶片和根,-80℃条件下冻存。相同时间点剪取未进行逆境和激素处理的叶片和根,作为平行对照。另外,选取多年生黑麦草的伸展叶、成熟叶、老叶、根、茎和根冠部位,用于分析目标基因在不同组织、器官中的表达模式。
1.6 亚细胞定位表达载体构建
将LpPIL5经BamHI和HindⅢ双酶切连接入门载体pEND-linker,然后用PvuⅠ将构建好的pEND-LpPIL5线性化,纯化后将其与表达载体(p2GWF7.0)进行LR重组反应,构建p2GWF7.0-LpPIL5亚细胞定位载体。
1.7 多年生黑麦草原生质体提取
参照Yu等[29]的方法提取多年生黑麦草原生质体,其中酶解液、W5溶液和MMg溶液配方见表2。

表2 提取并转化原生质体所用溶液Table 2 The solution used to extract and transform protoplasts
1.8 亚细胞定位分析
取原生质体溶液200 μL(约40000个原生质体),质粒p2GWF7.0-LpPIL5(1000 ng·μL-1)20 μL,PEG 4000溶液(见表2)220 μL加入2 mL无菌离心管中混匀。室温孵育5 min,加入800 μL的W5溶液,混匀后200 r·min-1离心2 min,去除上清液并加入400 μL的W5溶液重悬原生质体。室温下暗孵育12 h后,采用激光共聚焦显微镜(Zeiss LSM780 Exciter,德国)观察目标蛋白的亚细胞定位情况。
1.9 数据处理与分析
采用SPSS 23.0对基因定量数据进行统计和差异显著性分析(P<0.05),数据以平均值±标准误差的形式表示。利用SigmaPlot 12.5、MEGA 6.0和Excel 2013软件作图。
2 结果与分析
2.1 多年生黑麦草LpPIL5全长cDNA克隆与生物信息学分析
经PCR反应,从多年生黑麦草中扩增出LpPIL5基因序列(图2,GenBank登录号为MZ188927),其具有5个外显子,4个内含子,编码区长1410 bp(图3a)。NCBI数据库检索得到LpPIL5的直系同源蛋白,分别为大麦(Hordeum vulgare)HvPIL1、二穗短柄草(Brachypodium distachyon)BdPIF1、小米(Setaria italica)SiPIL1、柳枝稷(Panicum virgatum)PvPIL13、高粱(Sorghum bicolor)SbPIF1、玉米ZmPIL5和水稻OsPIL13,这些蛋白都具有保守的bHLH结构域(图3b)。进化结果表明,LpPIL5与单子叶植物的同源蛋白聚为一类,且与大麦HvPIL1的亲缘关系最近(图4)。
图2 部分样品的mRNA(a)及LpPIL5基因(b)全长克隆的电泳图Fig.2 Electrophoretogram of some samples’mRNA(a)and full length of LpPIL5 gene(b)

图3 LpPIL5的基因结构(a)和氨基酸序列(b)分析Fig.3 Gene structure(a)and amino acid sequence(b)analysis of LpPIL5
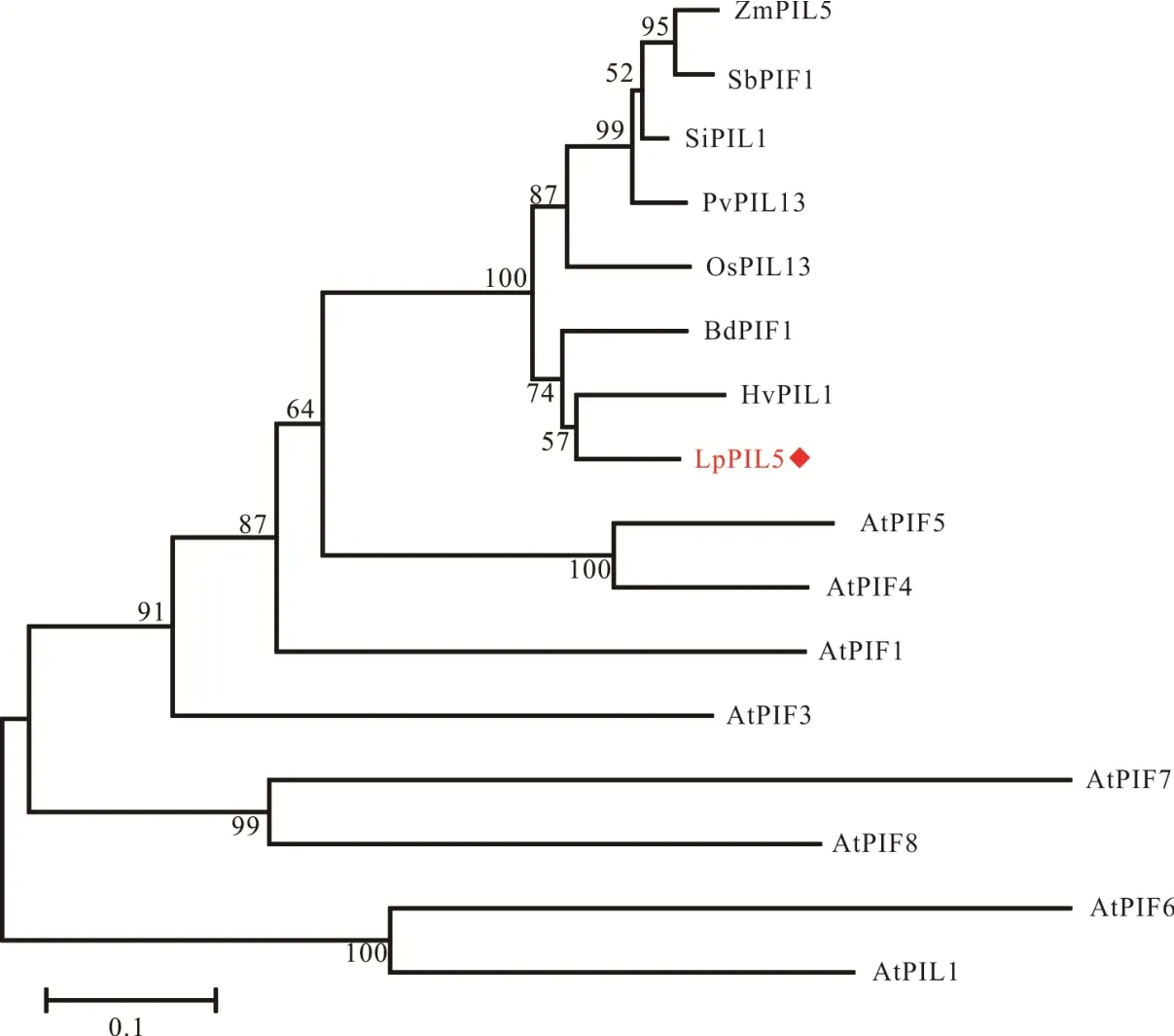
图4 LpPIL5及其同源蛋白的系统进化树分析Fig.4 Phylogenetic analysis of LpPIL5 and its homologous proteins
2.2 LpPIL5具有典型的bHLH三级结构
LpPIL5编码蛋白质的分子式为C2150H3368N652O686S28,原子总数为6884,相对分子质量为50.22 kDa,等电点为6.68;正电荷残基(精氨酸+赖氨酸)为43个,负电荷残基(天冬氨酸+谷氨酸)为46个;不稳定系数为61.84,属不稳定蛋白;平均亲水性系数为-0.657。且其结构中含有49个磷酸化位点(阈值>0.5),其中28个丝氨酸、19个苏氨酸及2个酪氨酸。
LpPIL5蛋白的二级结构如图5a所示。其中α-螺旋由137个氨基酸残基组成,占29.15%;延伸链由38个氨基酸残基组成,占8.09%;β-转角由14个氨基酸残基组成,占2.98%;无规则卷曲由281个氨基酸残基组成,占59.79%。LpPIL5蛋白的三维立体结构如图5b所示,该蛋白具有典型的bHLH转录因子结构,且位于该蛋白两端的α-螺旋可以形成拉链结构,嵌入到DNA双链的大沟里,而在这两个α-螺旋末端均富含碱性氨基酸,以识别DNA序列。

图5 LpPIL5蛋白的二级结构和空间三维结构Fig.5 Secondary structure and three-dimensional structure of LpPIL5
2.3 LpPIL5定位于细胞核
将p2GW7.0-LpPIL5-GFP融合表达载体瞬时转化多年生黑麦草原生质体,用激光共聚焦显微镜观察绿色荧光蛋白(green fluorescent protein,GFP)信号的定位。结果表明GFP信号与4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)信号重叠(图6),说明LpPIL5定位于细胞核。

图6 LpPIL5蛋白在多年生黑麦草原生质体中的亚细胞定位Fig.6 The subcellular localization of LpPIL5 protein in protoplasts of perennial ryegrass
2.4 LpPIL5启动子具有激素、逆境和光响应顺式作用元件
LpPIL5启动子区含有响应逆境、植物激素和光响应相关的顺式作用元件,如与脱落酸有关的顺式调控元件ABRE、干旱诱导相关的MYB结合位点MBS、启动子和增强子区域的共同顺式作用元件CAAT-box、调控启动子转录的基本元件TATA-box等。另外,启动子区域也含有如G-box、I-box、BoxⅡ、TCCC-motif等多个光响应元件(表3),说明LpPIL5可能参与植物的激素信号传导、耐逆响应和昼夜节律调控。

表3 LpPIL5启动子顺式作用元件分析Table 3 The analysis of cis-acting regulatory elements in the LpPIL5 promoter
2.5 LpPIL5的表达具有组织特异性,且受昼夜节律调控
LpPIL5在多年生黑麦草伸展叶、成熟叶、老叶、根、茎、叶鞘和根冠中均表达(图7a)。叶片中LpPIL5的表达量显著高于根、茎、叶鞘和根冠,其中,在成熟叶中的表达量最高。另外,LpPIL5的表达受光周期调控,如在光下的相对表达量要明显高于黑暗。在光照开始0~4 h,其表达量上升最为明显,随后会有不同程度的下降。而在黑暗条件下,该基因的表达量显著低于光照条件,且处于较低水平(图7b)。
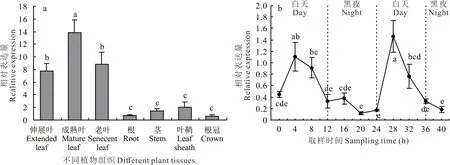
图7 LpPIL5在不同组织(a)和光照条件(b)下的相对表达量Fig.7 Relative expression of LpPIL5 gene in different tissues(a)and light or dark conditions(b)
2.6 干旱、盐、镉和高温逆境调控LpPIL5的表达
PEG、NaCl、CdCl2和高温胁迫处理条件下叶片中LpPIL5基因的相对表达量均低于对照,说明4种非生物胁迫的逆境处理均抑制了叶片中LpPIL5基因的表达(图8)。在根中PEG、NaCl、CdCl2和高温胁迫处理6 h内,LpPIL5基因的相对表达量也低于对照,然而在处理24 h后,LpPIL5基因在根中的表达量均高于对照。

图8 4种非生物胁迫处理下多年生黑麦草叶片和根中LpPIL5的相对表达量Fig.8 The relative expression of LpPIL5 in leaves and roots in response to four different abiotic stresses
2.7 细胞分裂素和脱落酸调控LpPIL5的表达
两种激素处理条件下,LpPIL5在根和叶片中的表达模式也具有差异(图9)。LpPIL5在叶片中的表达均受ABA和6-BA的抑制,但抑制程度不同。如:6-BA处理0.5~2 h时,LpPIL5表达量呈上升的趋势,但ABA处理0.5~2 h,LpPIL5表达量呈下降的趋势。在根中,LpPIL5在6-BA和ABA处理下的表达模式是相似的,均表现为前12 h内,该基因的表达受到抑制,但在24 h时,该基因的相对表达量高于对照。
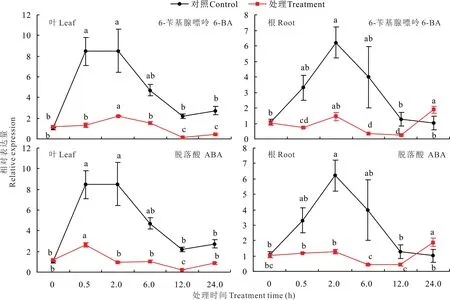
图9 ABA和6-BA处理下多年生黑麦草叶片和根中LpPIL5的相对表达量Fig.9 The relative expression of LpPIL5 in leaves and roots in response to ABA and 6-BA
3 讨论
光在植物生长发育中起着至关重要的作用,不仅参与植物的光合作用,还作为信号调节多种生理反应,如光形态建成等。光敏色素主要在细胞质中合成,在红光照射下会快速移动到细胞核中,然后与PIFs蛋白发生相互作用,促进它们的快速降解来调节植物的生长发育过程[30]。光敏色素互作因子作为bHLH转录因子的亚家族,是参与光信号通路的关键调控因子,在植物生长发育中发挥着重要作用[6]。随着生物技术的不断发展,目前,越来越多的PIF转录因子家族在植物中被发现并研究。如PIF转录因子已经在水稻[31]、番茄(Solanum lycopersicum)[32]、拟南芥[18,33]、小立碗藓(Physcomitrella patens)[34]和玉米[35-36]等多种植物中被发现并分离。但是,多年生黑麦草的PIF转录因子家族成员尚未被克隆。
本研究从多年生黑麦草中克隆得到一个PIF基因LpPIL5,其编码蛋白具有碱性螺旋-环-螺旋(basic helix-loop-helix)蛋白保守的bHLH结构域和APB功能域。前人研究结果表明,光敏色素A和B可以与PIFs的APA和APB功能域互作,促进PIF降解进而发挥生物学功能[37-38]。然而,本研究发现LpPIL5不含有APA功能域,说明其可能不与光敏色素A直接互作。对LpPIL5蛋白进行空间三维立体结构模拟,发现其具有典型的bHLH结构域特征,位于该蛋白两端的α-螺旋形成拉链结构,能够嵌入DNA双链结构的大沟,而在这两个α-螺旋末端均富含碱性氨基酸,以识别DNA序列。前人研究发现,PIFs可以通过其bHLH结构域的基本区域与下游基因的顺式作用元件结合[39]。基于以上结果,并结合LpPIL5定位于细胞核,推测LpPIL5是一个转录激活子,通过bHLH功能域与其下游基因启动子结合并促进下游基因的表达,进而发挥生物学功能。
分析LpPIL5基因的表达模式有助于揭示其调控多年生黑麦草耐逆反应、激素响应和光形态建成的机制。Wang等[40]的研究表明两对AhPIF3基因(AhPIF3A1/B1,AhPIF3A4/B4)在黑暗下的转录水平要高于在光下的转录水平。与上述结果相似的是葡萄(Vitis vinifera)VvPIFs在光下的转录水平也会被抑制,并且暗处理可诱导其表达[41]。除此之外,AtPIF3在黑暗条件下的拟南芥幼苗中表达量高,但在红光和远红光条件下都会被降解[42]。本研究结果表明LpPIL5的表达受光调控,表现为白天的表达量显著高于夜晚,并且在其启动子区发现了许多与光响应相关的顺式作用元件,如G-box、I-box、BoxⅡ、TCCC-motif等。因此,推测LpPIL5基因功能发挥与光信号密切相关,是植物光信号通路的核心调控因子,且LpPIL5启动子为光诱导型启动子,光照能够驱动或诱导LpPIL5基因的表达,进一步调节植物的光形态建成[43]。因此,LpPIL5是调控多年生黑麦草光形态建成及耐荫响应的重要候选基因。前人研究显示,AdPIF3A4/AiPIF3B4基因在雌蕊发育早期的表达量高于其他组织[44],本研究发现LpPIL5基因在植物叶片中的表达量显著高于其他部分,并且在叶片不同时期内的表达量也有所不同,其中在成熟叶片中表达量最高,说明该基因在多年生黑麦草发育过程中可能具有不同的生物学功能。
不同非生物胁迫和两种外源激素处理的定量数据结果表明,LpPIL5基因在叶片中受NaCl、CdCl2、高温、干旱、ABA和6-BA处理后均表现为先上升后下降的表达趋势。而在聚乙二醇(PEG)处理后的0.5 h内其基因表达量出现了先下降,随后上升再下降的趋势。但与对照组相比,不管在哪种非生物胁迫处理下,其叶片中该基因的相对表达量都下降,但下降的程度不相同,表明该基因在多年生黑麦草叶片中对逆境胁迫的响应具有重要作用,且不同逆境下其响应程度不同。在根中,不同处理下也出现了相似的表达模式,但与叶片中不同的是,在处理24 h后,该基因的相对表达量均超过了对照组。尤其是在NaCl处理下,该基因在6 h后表达量快速上升,说明LpPIL5在根部受NaCl的影响要高于其他处理组。根和叶的相对表达量数据分析也表明,LpPIL5基因在根和叶中均有不同的表达模式。LpPIL5基因表达对上述逆境及植物激素处理的响应可能与其启动子中含有的ABRE,MBS,CGTCA-motif和TGACG-motif等顺式作用元件相关,但与其启动子互作的逆境和激素响应转录因子仍需进一步挖掘。综上所述,LpPIL5不仅具有参与光信号转导的能力,而且在响应盐、镉、高温、干旱等非生物胁迫方面也发挥着重要作用。
4 结论
本研究克隆了多年生黑麦草LpPIL5基因,发现LpPIL5与大麦HvPIL1遗传距离较近,且具有bHLH蛋白保守的结构域和APB功能域;LpPIL5定位于细胞核;与其他组织相比,LpPIL5在多年生黑麦草叶片中表达量较高;并且其在叶片和根中表达量均受NaCl、CdCl2、PEG、高温、ABA和6-BA等调控。另外,LpPIL5基因的表达受昼夜节律调控,如LpPIL5在白天的表达量显著高于夜晚。本研究初步明确了LpPIL5不仅在光信号通路中起着至关重要的作用,而且还参与多年生黑麦草耐逆调控,研究结果为后续揭示LpPIL5基因调控多年生黑麦草光形态建成和耐逆(如耐荫)机制提供了理论基础。

