末次刈割时间对苜蓿根颈抗氧化系统及抗寒性的影响
陈卫东,张玉霞,2*,张庆昕,刘庭玉,王显国,王东儒
(1.内蒙古民族大学农学院,内蒙古 通辽 028041;2.内蒙古自治区饲用作物工程中心,内蒙古 通辽 028000;3.中国农业大学草业科学与技术学院,北京 100193;4.呼和浩特市农牧技术推广中心种业发展科,内蒙古 呼和浩特 010000)
紫花苜蓿(Medicago sativa)作为优质的多年生豆科牧草,是我国种植面积最大的牧草之一,在我国畜牧业生产中发挥着至关重要的作用[1-2]。科尔沁沙地位于中国农牧交错带东段,频繁的风沙灾害加之不合理的人为活动导致科尔沁沙地成为中国北方地区沙漠化最典型的地区之一[3-4]。近几十年来农耕界限不断北移,大面积草原被开垦为农田,昔日波状起伏的疏林沙质草原逐渐变为今日典型的农牧交错区[5]。在“十三五”期间通过机械播种、切割压扁搂晒、打捆机械化技术、节水灌溉体系,在科尔沁沙地稳固地建立了700 hm2苜蓿生产基地[6]。科尔沁沙地冬季少雪,冬春土壤温湿度变化剧烈[7-8],在科尔沁沙地种植苜蓿面临严重的低温冷冻和倒春寒问题[9-10]。冻害是限制这一地区苜蓿持续稳定生产的关键问题,安全越冬是我国北方干旱地区实现苜蓿稳产高产的基础。影响苜蓿越冬率的因素有很多,如气温、降水、土壤质地与肥力、品种选择、刈割制度、灌溉措施等,其中末次刈割时间是影响苜蓿越冬率的重要栽培管理因素之一[11-14],目前关于苜蓿的末次刈割时间,许多学者有不同见解,有学者认为第1次“杀霜(气温首次降至-20℃)”之前4~6周是中、高维度地区苜蓿刈割秋季敏感期(fall critical period),此时期刈割将降低苜蓿草地的持久性和来年的草产量[15-16];也有一些学者的研究表明,如果苜蓿品种秋眠和抗病性强、土壤肥力高、刈割次数和生育时期(或间隔期)适宜,秋季刈割就不会造成草地持久性和产草量降低[17-18]。这种有关末次刈割做法的争议,究竟孰是孰非,还是需要因地制宜,还有待于更多的研究去佐证。根系是植物吸收养分、转化和储藏营养物质的重要器官[19],研究表明,根颈中抗氧化系统与植物抗逆性存在密切关系[20]。孙浩等[21]研究表明,末茬秋季敏感期刈割导致阿鲁科尔沁旗苜蓿越冬率降低,但未对苜蓿根颈中抗氧化系统做深入研究,苜蓿根系中的抗氧化酶活性在植物越冬期间存在怎样的变化规律及其与越冬有无直接联系还需进一步探究。为此,开展末次刈割时间调控科尔沁沙地苜蓿越冬的生理机制研究,探究苜蓿根颈抗氧化系统变化,分析科尔沁沙地秋末是否应该刈割及最佳刈割时期,对确定该地区适宜的末次刈割时间,确保苜蓿安全越冬,指导苜蓿生产具有重要意义,亦可为苜蓿抗寒越冬研究提供理论基础。
1 材料与方法
1.1 试验地概况
试验地位于内蒙古通辽市开鲁县东风镇林辉草业公司(43°37′N,121°34′E),年平均气温为6.2 ℃,最低气温为-30~-25 ℃,>10 ℃年活动积温为3137 ℃,<0 ℃的天数为86~98 d,年平均日照时数为3000 h,无霜期为135~145 d,年平均降水量为376.1 mm,蒸发量是降水量的4.8 倍,年平均风速为3.1~4.3 m·s-1,为典型的温带大陆性季风气候。试验田土壤为沙土,新开垦沙化草地,0~20 cm 土层土壤理化性质为:pH 值8.2,有机质含量6.3 g·kg-1,全氮含量 0.37 g·kg-1,碱解氮含量 36.17 mg·kg-1,速效钾含量 76.78 mg·kg-1,速效磷含量 3.68 mg·kg-1。
1.2 试验设计
试验材料为公农1 号紫花苜蓿品种,来自吉林省农业科学院草原所。于2019 年7 月30 日进行播种,播种量22.5 kg·hm-2,条播行距15 cm,试验小区面积为16 m2(4 m×4 m),3 次重复,共设30 个小区,小区之间设0.5 m过道。施肥量为 75 kg·hm-2K2O,100 kg·hm-2P2O5,翌年再次施入 150 kg·hm-2K2O 与 200 kg·hm-2P2O5,K2O 分两次施入,分别为 4 月 3 日和 6 月 3 日各施入 75 kg·hm-2,P2O5于 4 月 3 日一次性施入,磷肥为过磷酸钙(P2O5含量为44%),钾肥为氯化钾(K2O 含量为60%),所有小区分别于2020 年5 月1 日和7 月3 日进行第一与二茬刈割。采用随机区组试验设计,于 2020 年 8 月 25 日-11 月 5 日,每 10 d 一个刈割时间,分别为 8 月 25 日,9 月 5、15、25 日,10月5、15、25 日,11 月5 日,共设置8 个刈割时间,以未刈割为对照(CK)。紫花苜蓿生长过程中进行适时喷灌、除草、防治病虫害等田间管理。于封冻前期(11 月15 日)挖取紫花苜蓿越冬材料(苜蓿根系),每个小区挖取90 株(粗细均匀一致),平均分成6 份。将其中1 份越冬材料放在4 ℃冰箱进行低温冷藏处理,剩余5 份于可程式恒温恒湿试验箱(东莞市昊昕仪器设备有限公司)模拟低温冷冻处理,处理时将根系先用脱脂棉包裹,加适量水,再用锡纸包裹,注明编号,处理温度分别为-10,-15,-20,-25 和-30 ℃,以 0 ℃为起点,4 ℃·h-1的速率降温,到达预设温度后保持6 h,再以4 ℃·h-1的速率升温至0 ℃,取出置于4 ℃下保持12 h。低温处理结束后,分别切取根颈(根颈及根颈下主根1 cm),测定相对电导率及抗氧化特性。
1.3 测定指标及方法
采用DDS-302 电导率仪(产地:成都)测定电导率[22],采用硫代巴比妥酸比色法测定丙二醛(malondialdehyde,MDA)含量[22],采用愈创木酚比色法测定过氧化物酶(peroxidase,POD)活性[22],采用氮蓝四唑比色法测定超氧化物歧化酶(superoxide dismutase,SOD)活性[22],采用紫外吸收法测定过氧化氢酶(catalase,CAT)活性[22]。
1.4 数据处理
采用Microsoft Excel 2010 软件进行数据处理、作图和制作表格,结果用“平均值±标准差”表示,各低温处理下的相对电导率数据使用 SPSS 17.0 软件拟合 Logistic 回归方程[23-24]:y=k/(1+ae-bx),其中y为相对电导率值,x为处理温度,k为当x趋于无穷大时的值,a 与b 为方程参数,相对电导率的极大值与极小值的中位数对应的温度为低温半致死温度(semi-lethal temperature,LT50)。
2 结果与分析
2.1 不同末次刈割时间对苜蓿根颈半致死温度(LT50)的影响
不同末次刈割时间的苜蓿受不同低温胁迫后相对电导率拟合Logistic 回归方程均不同,差异显著水平均小于0.05(表 1)。结果显示,在未刈割、8 月 25 日、9 月 5 日、9 月 15 日、9 月 25 日、10 月 5 日、10 月 15 日、10 月 25 日、11 月5 日进行末次刈割时,半致死温度分别为-18.03、-17.61、-17.03、-16.59、-15.80、-15.82、-16.83、-16.34、-17.12 ℃。由此说明,在不同末次刈割时间的苜蓿抗寒能力强弱为:未刈割>8 月25 日>11 月5 日>9月 5 日 > 10 月 15 日 > 9 月 15 日 > 10 月 25 日 > 10 月 5 日 > 9 月 25 日 。

表1 不同末次刈割时间苜蓿根颈相对电导率拟合Logistic回归方程及LT50Table 1 The Logistic regression equation and LT50 of relative conductivity of alfalfa root-neck under different last cutting time
2.2 不同末次刈割时间的苜蓿根颈在不同低温处理下MDA 含量的变化
随着温度的降低,苜蓿根颈的MDA 含量呈逐渐升高的变化趋势(表2),在-30 ℃下MDA 含量最高,且均与-20℃及以上温度处理差异显著(P<0.05)。除9月5日刈割时间处理下-30与-25℃处理差异不显著外(P>0.05),其他刈割时间处理二者均差异显著(P<0.05),由此说明在低温胁迫下,苜蓿根颈会受到伤害,且低温胁迫温度越低,苜蓿根颈受伤害程度越大,说明MDA含量可以评价苜蓿受伤害程度。

表2 不同末次刈割时间苜蓿根颈在低温处理下MDA含量的变化Table 2 Changes of MDA content in alfalfa root-neck at different last cutting times under low temperature treatment(nmol·g-1 FW)
在-15与-20℃处理下,9月25日末次刈割时间处理根颈的MDA含量最高,其中-15℃处理下均显著高于其他刈割时间处理,-20℃处理下显著高于未刈割、8月25日、9月5日、10月15日、11月5日刈割(P<0.05);在-25与-30℃低温胁迫处理下,10月5日末次刈割时间处理根颈的MDA含量最高,且均显著高于其他刈割时间(P<0.05),未刈割处理苜蓿根颈的MDA含量最低,除8月25日末次刈割时间处理外均显著低于其他刈割时间处理(P<0.05);由此说明,不同刈割时间处理下的苜蓿根颈的MDA含量在低温胁迫下存在明显差异,9月25日与10月5日刈割处理MDA含量较高,未刈割、8月25日、9月5日、10月15日、11月5日刈割处理的MDA含量较低。由此进一步说明,9月25日与10月5日刈割的苜蓿抗寒性较弱,与其在低温胁迫下MDA含量较多有关,反之未刈割、8月25日、9月5日、10月15日、11月5日刈割处理抗寒性较强与其在低温胁迫下MDA含量较少密切相关;因此,苜蓿根颈的MDA含量可以反映其抗寒性强弱。
2.3 不同末次刈割时间苜蓿根颈在不同低温处理下SOD活性变化
随着温度的降低,苜蓿根颈的SOD活性呈逐渐升高的变化趋势(表3),在-30℃低温胁迫下SOD活性最强,且均与-20℃及以上温度处理差异显著(P<0.05),除9月25日、10月25日、11月5日刈割处理-30与-25℃低温胁迫处理差异不显著外(P>0.05),其他刈割时间处理二者均差异显著(P<0.05),由此说明在低温胁迫下,苜蓿根颈受到伤害从而产生超氧阴离子,植株通过增强SOD活性,清除超氧阴离子,维持活性氧平衡,且在-30℃低温冷冻胁迫处理下,仍具有较强的清除能力,由此说明SOD是苜蓿抵御低温冷冻胁迫的抗氧化酶之一。
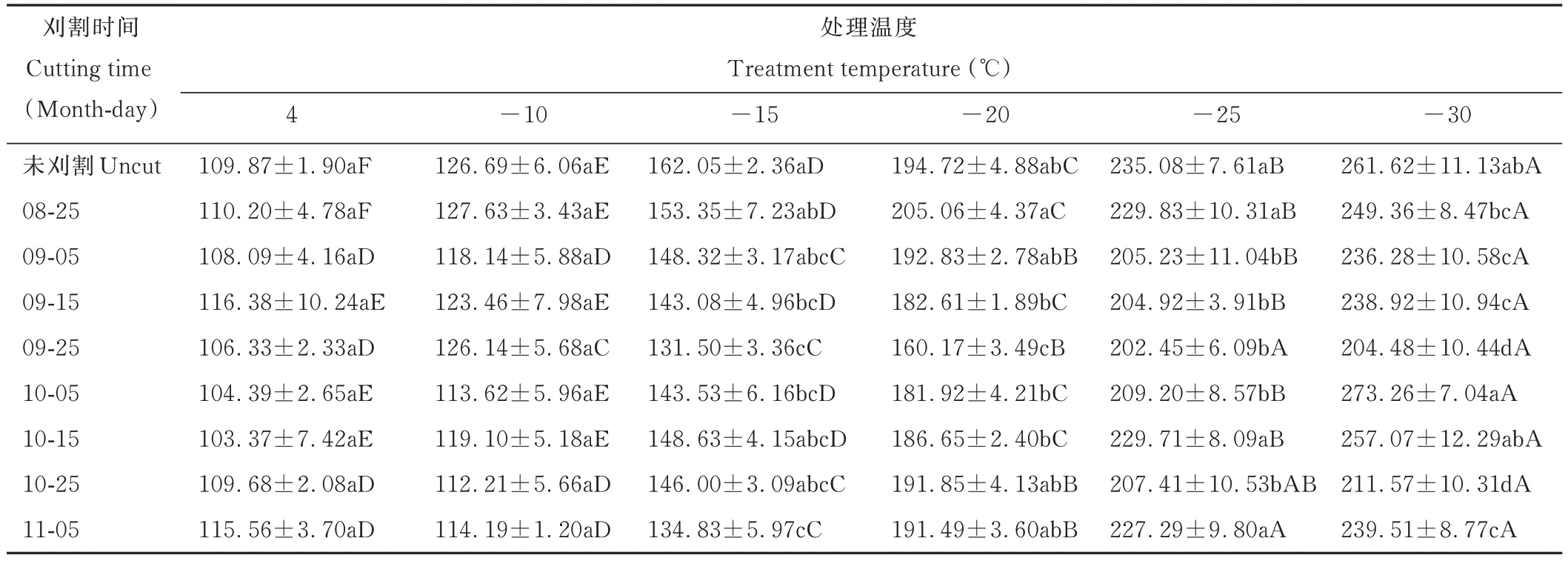
表3 不同末次刈割时间苜蓿根颈在低温处理下SOD活性的变化Table 3 Changes of superoxide dismutase activity in alfalfa root-neck with different last cutting time under low temperature treatment(U·g-1 FW)
在-30~-15℃低温胁迫下,9月25日末次刈割处理苜蓿根颈的SOD活性最弱,在-15℃低温胁迫处理下显著低于未刈割、8月25日刈割处理,-20℃处理下显著低于其他刈割处理(P<0.05),-25℃处理下则显著低于未刈割、8月25日、10月15日、11月5日刈割处理(P<0.05),-30℃处理下显著低于除10月25日刈割外的其他处理(P<0.05),由此说明,不同刈割时间苜蓿根颈的SOD活性在低温胁迫下存在明显差异,9月25日刈割处理相对较弱,未刈割、8月25日、10月15日、11月5日刈割则相对较强。由此进一步说明,9月25日刈割的苜蓿抗寒性较弱,与其在低温胁迫下SOD活性较弱有关,反之未刈割处理、8月25日、10月15日、11月5日刈割处理抗寒性较强与其在低温胁迫下SOD活性较强密切相关。
2.4 不同末次刈割时间的苜蓿根颈在不同低温处理下POD活性变化
随着温度的降低,苜蓿根颈的POD活性呈先升高后降低的变化趋势(表4),在-25℃下POD活性最强,其中未刈割、9月5日、9月25日、10月5日、10月25日、11月5日刈割处理均与其他低温差异显著(P<0.05),由此说明在低温胁迫下,苜蓿根颈受到伤害会产生过氧化物,植株通过增强POD活性,清除过氧化物,维持活性氧平衡,且在-25℃处理下,清除能力最强,在-30℃处理下,POD活性减弱,说明苜蓿根颈清除过氧化物的能力减弱,由此说明POD亦是苜蓿抵御低温冷冻胁迫的抗氧化酶之一。
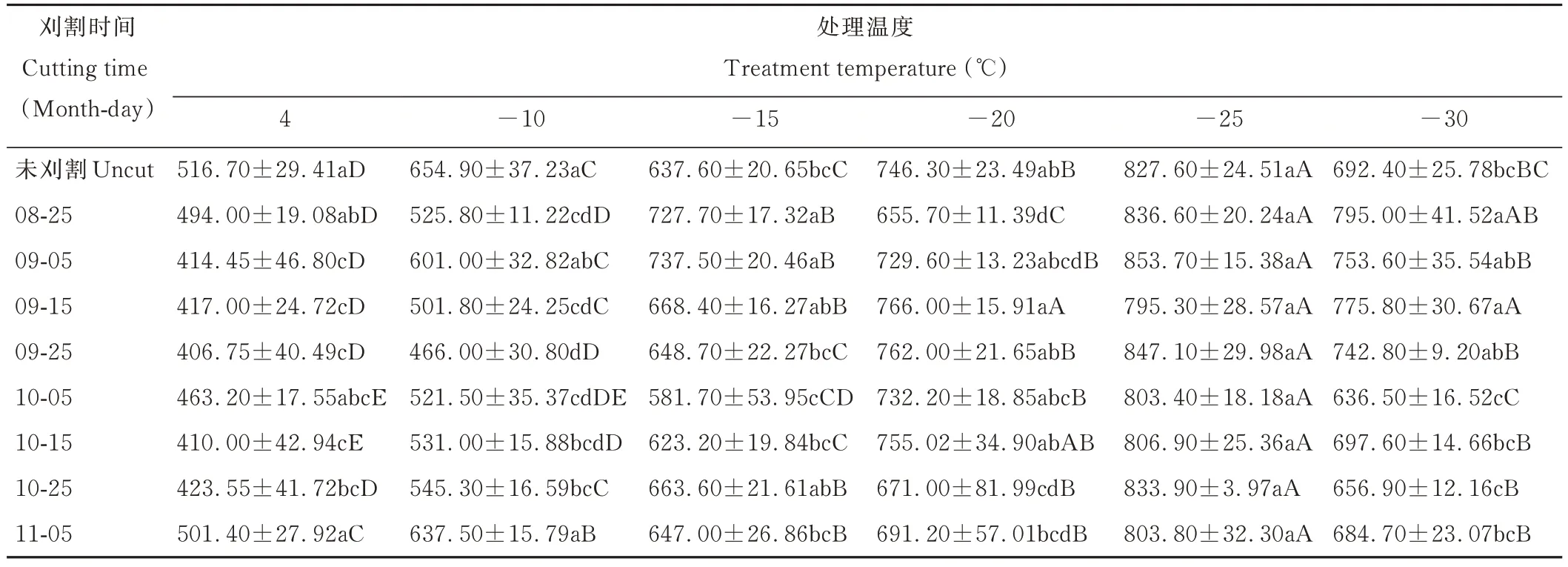
表4 不同末次刈割时间苜蓿根颈在低温处理下POD活性的变化Table 4 Changes of peroxidase activity in alfalfa root-neck with different last cutting time under low temperature treatment(U·min-1·g-1 FW)
在-30和-15℃处理下,10月5日刈割处理苜蓿根颈的POD活性最弱,在-15℃处理下显著低于8月25日、9月5日、9月15日、10月25日刈割(P<0.05),但在-20和-25℃处理下与其他处理差异不显著(P>0.05),在-30℃处理下显著低于8月25日、9月5日、9月15日、9月25日刈割处理(P<0.05)。由此说明,在不同刈割时间处理下的苜蓿根颈的POD活性在-15和-30℃低温胁迫下存在明显差异,但在-20和-25℃间差异不明显,说明POD活性在-20℃及以下温度处理下对刈割时间的响应不明显。
2.5 不同末次刈割时间苜蓿根颈在不同低温处理下CAT活性的变化
随着温度的降低,苜蓿根颈的CAT活性呈先升高后降低的变化趋势(表5),在-20℃下CAT活性最强,且均与其他温度处理差异显著(P<0.05),由此说明在低温胁迫下,苜蓿根颈受到伤害产生H2O2,通过增强CAT活性,清除H2O2,维持活性氧平衡,且在-20℃低温胁迫下,清除能力最强,在-20℃以下,CAT活性减弱,说明苜蓿根颈清除H2O2的能力减弱,由此说明CAT亦是苜蓿抵御低温冷冻胁迫的抗氧化酶之一。
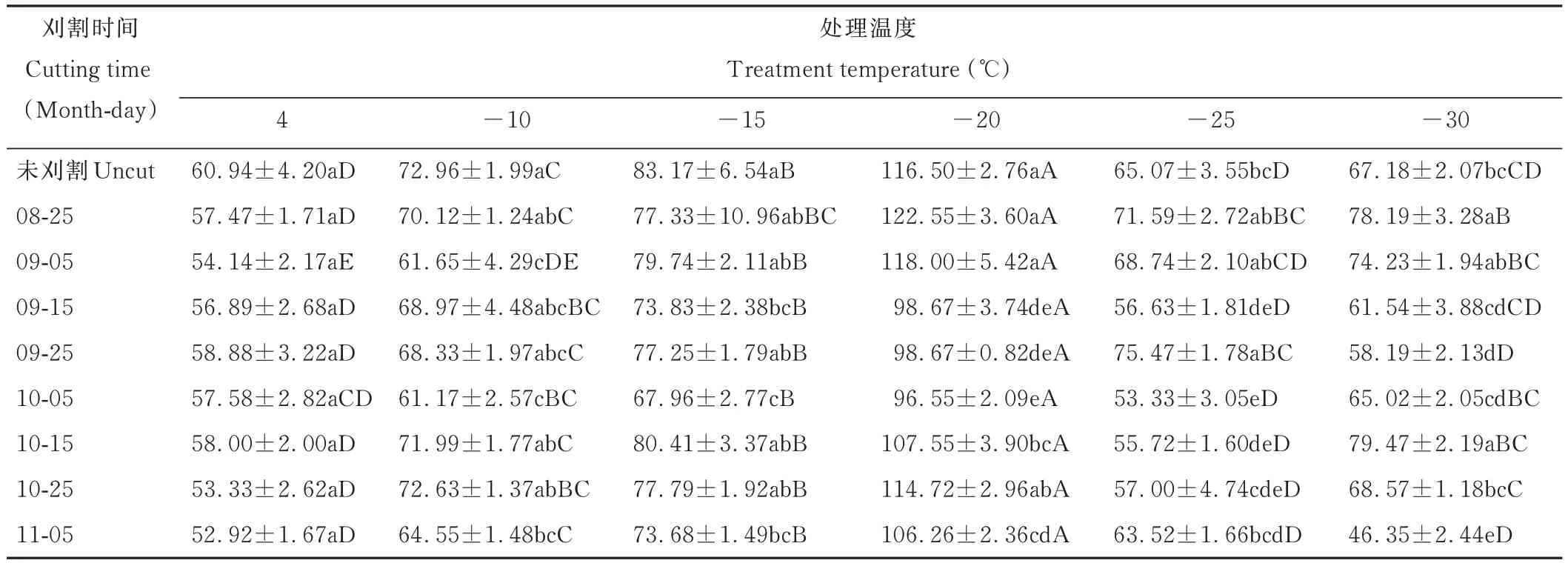
表5 不同末次刈割时间苜蓿根颈在低温处理下CAT活性的变化Table 5 Changes of catalase activity in alfalfa root-neck with different last cutting time under low temperature treatment(U·min-1·g-1 FW)
在-25~-10℃低温冷冻处理下,10月5日末次刈割时间处理苜蓿根颈的CAT活性最弱,在-10℃处理下显著低于未刈割、8月25日、10月15日、10月25日刈割处理(P<0.05),-15℃处理则显著低于未刈割、8月25日、9月5日、9月25日、10月15日、10月25日刈割处理(P<0.05),-20℃处理显著低于未刈割、8月25日、9月5日、10月15日、10月25日刈割处理(P<0.05),-25℃处理下显著低于未刈割、8月25日、9月5日、9月25日、11月5日刈割处理(P<0.05),但均与9月15日刈割处理差异不显著(P>0.05)。由此说明,不同刈割时间处理下的苜蓿根颈的CAT活性在低温胁迫下存在明显差异,9月15日和10月5日刈割相对较弱,未刈割、8月25日、9月5日、10月15日、10月25日刈割则相对较强。由此进一步说明,9月15日和10月5日刈割的苜蓿抗寒性较弱,与其在低温胁迫下CAT活性较弱有关,反之未刈割处理、8月25日、9月5日刈割处理抗寒性较强与其在低温胁迫下CAT活性较强密切相关。
2.6 苜蓿根颈的半致死温度与其抗氧化系统的相关性
由表6可知,不同低温胁迫下紫花苜蓿根颈的LT50均与MDA含量呈正相关,且在-15℃及以下温度呈显著或极显著正相关,与抗氧化酶活性呈负相关(除-20℃的POD活性);紫花苜蓿根颈的半致死温度与-10℃低温条件下的POD活性呈显著负相关(P<0.05),与-20℃下的CAT活性呈显著负相关(P<0.05),与-15、-20和-25℃条件下SOD活性呈显著或极显著负相关。
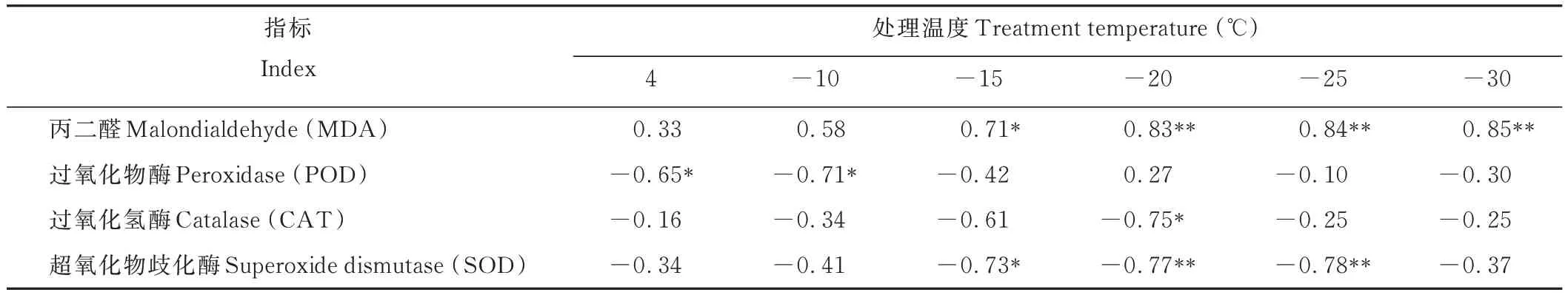
表6 不同末次刈割时间苜蓿根颈的半致死温度与其抗氧化系统的相关性Table 6 Correlation between the semi-lethal temperature of alfalfa root-neck and its antioxidant system in different last cutting times
3 讨论与结论
关于末次刈割处理对苜蓿抗寒性的研究主要采用田间自然降温胁迫处理的方法[25],通过测定翌年的越冬率衡量苜蓿抗寒性的强弱,抗氧化系统指标通过越冬期不同自然降温处理时期取样测定,这种方法易受外界环境影响,且冬季取样困难。近年来,末次刈割处理对苜蓿抗寒性的研究开始采用可程式恒湿恒温试验箱人工模拟低温处理的方法[26],利用半致死温度衡量苜蓿的抗寒性强弱,这种方法能够有效避免外部环境因素的影响,取样测定抗寒生理指标简单方便且更加准确。为此,本试验通过大田培养紫花苜蓿材料,采用人工模拟低温胁迫的方法,获得半致死温度判定不同末次刈割时间处理紫花苜蓿抗寒性的差异。结果表明,不同末次刈割时间处理的紫花苜 蓿 抗 寒 性 强 弱 为:未 刈 割>8月25日>11月5日>9月5日>10月15日>9月15日>10月25日>10月5日>9月25日;因此,在科尔沁沙地9月5日之前与11月5日之后进行末次刈割为相对安全期,9月5日-9月25日与10月5日-11月5日进行末次刈割为相对危险期,9月25日-10月5日进行末次刈割为危险期。
植物受到低温胁迫时,会导致细胞内活性氧增加[27-28],植物细胞膜系统在受到氧化伤害后产生MDA,其含量多少可反映细胞膜脂过氧化的程度,也常用来反映细胞膜受破坏的程度[29]。有研究表明,植物在逆境条件下,其细胞可通过多种途径产生超氧阴离子、H2O2等活性氧,超氧阴离子和H2O2可进一步反应生成毒性更强的羟自由基(OH-),它能转化脂肪酸为有毒的过氧化物,使得生物膜被破坏,造成MDA的累积[30]。本研究中,紫花苜蓿根颈的MDA含量随着温度的降低均增加,这与徐洪雨等[31]、程嘉惠等[32]的研究结果一致,且在-15、-20、-25与-30℃处理下,紫花苜蓿根颈在9月25日或10月5日末次刈割时MDA含量最高,表明此时紫花苜蓿根颈细胞膜破坏最严重,受伤程度最大,因此,此时刈割处于危险期。
逆境胁迫下,植物会启动一系列生理响应来应对活性氧过量积累所形成的过氧化胁迫,有研究表明,SOD、POD、CAT等抗氧化酶在植物抵御低温氧化损伤方面起着至关重要的作用[33-34]。李春燕等[35]研究表明,随低温胁迫持续时间的延长,小麦(Triticum aestivum)SOD、POD和CAT活性均呈先上升后下降的变化趋势。本试验表明,随着温度的下降,紫花苜蓿根颈的POD、CAT活性呈先升高后降低的变化趋势,而SOD活性呈一直增加的趋势,说明低温胁迫可激发紫花苜蓿根颈中POD、CAT、SOD活性,SOD活性的一直升高可能是由于其在低温冷冻下依然起到保护作用,这与亓春宇等[36]的研究结果一致。通过苜蓿根颈的半致死温度与抗氧化系统的相关分析表明,在4与-10℃处理下,紫花苜蓿根颈的POD活性与其半致死温度呈显著负相关,在-20℃处理下,紫花苜蓿根颈的CAT活性与其半致死温度呈显著负相关,在-15、-20与-25℃处理下,紫花苜蓿根颈的SOD活性与其半致死温度呈显著或极显著负相关,因此末次刈割时间通过调控苜蓿根颈的SOD、POD、CAT活性,协同作用清除活性氧、过氧化物、过氧化氢,降低膜脂过氧化程度,从而提高其抗寒性。

