胃镜下酚红染色对幽门螺杆菌感染的诊断价值
自1983年幽门螺杆菌(Helicobacter pylori,
)被发现后,上消化道疾病的诊治发生了巨大的变化
,1994年被WHO列为Ⅰ类致癌因子
。目前临床诊断
的常用方法包括尿素呼气试验(
C/
C -urea breath test,
C/
C-UBT)、粪便抗原检测、血清抗体检测等。通常认为
C-UBT是一种准确、无创、半定量的方法
。然而,UBT有其固有的非侵入性方法的局限性,即无法查明上消化道疾病的病因及提供组织病理学信息。近年来胃镜下进行诊断或分类胃炎、木村-竹本分型、新悉尼系统分类和京都胃炎评分被广泛应用,因此,有必要探讨胃镜下可视化诊断
感染的临床应用。
通过强的脲酶活性降解人体组织中的尿素导致黏膜损伤,由此产生的氨能提高感染部位的pH值
。因此,Kohli等提出了一种使用酚红和尿素评估
在胃黏膜上分布的胃镜检查方法
,该方法使胃镜下可视化诊断
感染和精确活检成为可能。本研究旨在以免疫组化为金标准,通过与
C-UBT对比来评价胃镜下酚红染色诊断
感染的临床价值。
1 资料与方法
收集2021年5月至2022年5月在我院接受胃镜下酚红染色试验、
C-UBT及组织病理学检查的门诊或住院患者110例,男56例,女54例,年龄(47.2±12)岁(19~73岁)。排除标准:(1)过去2个月内曾接受过根除
治疗或使用过铋剂、质子泵抑制剂、抗生素或抗分泌药物者;(2)患有肝胆、肺或代谢性疾病或既往胃外科手术者;(3)有胃镜检查或活检禁忌者。本研究经武汉大学人民医院医学伦理委员会批准(编号:WDRY2021-K106),所有患者签署胃镜检查及参与试验的知情同意书。
1.2.1
C-UBT:经过一夜空腹或禁食2 h以上后行
C-UBT检测,诊断标准:DOB<4‰为阴性,DOB≥4‰为阳性。
1.2.2 胃镜下酚红染色检查:检查心肺功能,禁食8 h,禁水2 h,常规服用蛋白酶制剂、去泡剂等准备产品并接受静脉麻醉。由1名高级水平的内镜医师(工作超过10年,胃镜操作超过5 000例)完成,使用日本Qlympus 290系统及290胃镜,检查前尽可能抽吸胃液及冲洗黏液以提高可视性,常规观察并记录内镜下表现后通过活检通道插入喷雾导管(PW-5L-1;Qlympus,东京,日本)进行全胃均匀喷洒20 ml由浓度为0.1%的酚红和0.5%尿素组成的混合溶液,记录3~5 min后的染色反应,出现由黄色到红色的变化,提示
感染。染色模式分为4种类型,1~3分为阳性,0分为阴性。0分:无染色(见图1A);1分:斑块状染色,在胃的局部(如胃窦、胃体或贲门)观察到红色区域(见图1B);2分:局部染色,在胃的两个部分(如胃窦和胃体或胃体和贲门)观察到红色区域(见图1C);3分:弥漫性染色,在所有区域均可见红色区域(见图1D)。使用一次性活检钳于染色阳性患者的红色区域和阴性患者的胃窦或胃体取1块标本送至病理科行组织病理学检查;另于阳性患者的红色及非红色区域和染色阴性患者的胃窦和胃体分别取1~2块标本送至病理科行免疫组化检查。取材后的样本由操作医师放入装有甲醛并标记患者标号、日期及取材部位的瓶子中送至病理科。

本研究结果表明,胃镜下酚红染色在染色阳性黏膜上表现出较高的敏感度(酚红染色和UBT阳性率分别为84.0%、78.0%),染色阴性黏膜特异度较低(酚红染色和UBT阴性率分别86.7%、90.0%)。结果表明,染色阳性黏膜的
检出率高于染色阴性黏膜。与目前的盲活检方法相比,酚红染色有助于活检部位的选择,从而降低假阴性率。以免疫组化为金标准,酚红染色在诊断
感染方面比
C-UBT敏感度高,准确率高,但特异度低。两种方法与免疫组化的一致性均较强(酚红染色:Kappa=0.707,
<0.001;
C-UBT:Kappa=0.662,
<0.001)。同时,胃镜下酚红染色与
C-UBT诊断
的结果一致性也较强(Kappa=0.776,
<0.001),胃镜下酚红染色内镜诊断阳性率为45%,高于
C-UBT(41.3%),但两者差异无统计学意义(
=0.388)。
目前我校系统解剖学教学基本都采用小班授课,且网络教学平台建设完善,这都为新的教学模式的应用提供了保障。
最常见的胃镜下表现为胃炎106例,96.4%),其中98例慢性糜烂性胃炎,6例慢性萎缩性胃炎,2例急性糜烂性胃炎。另有37例(33.6%)胃息肉;十二指肠球炎和十二指肠球部溃疡各6例;5例反流性食管炎;黄斑瘤、食管裂孔疝及食管乳头状瘤各4例;Barrett食管和食管胃黏膜异位各3例。免疫组化阳性50例(45.5%),阴性60例(54.5%)。酚红染色阳性50例(45.5%),阴性60例(54.5%)。
C-UBT阳性45例(40.9%),阴性65例(59.1%)(见表1)。
2 结果
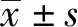
艾滋病相关肿瘤主要有非霍奇金淋巴瘤和卡波西肉瘤,也需关注非HIV定义性肿瘤如肝癌、肺癌、肛周肿瘤等的筛查、诊治和处理。肿瘤的确诊依赖病理活检。治疗需根据病情给予个体化综合治疗,包括手术、化疗、介入和放疗(具体请参考相关指南)。所有的艾滋病合并肿瘤的患者均建议尽早启动HAART,需要注意抗病毒药物和抗肿瘤药物之间的相互作用,尽量选用骨髓抑制作用和药物间药物相互作用小的HAART方案如含INSTIs的方案。肿瘤的诊治不应因感染HIV而降低要求,应提倡多学科合作诊治(MDT)模式的应用,应与肿瘤科、介入科、外科等专家一同制定诊治方案。治疗中注意预防各种并发症尤其是感染的发生。

胃黏膜活组织检查最常见的显微镜检查结果是110例(100%)慢性炎症,其次中性粒细胞浸润97例(88.2%),肠化39例(35.5%),而萎缩仅3例(2.7%)。根据免疫组化半定量结果评估显示,
感染与中性粒细胞浸润、慢性炎症和萎缩有相关性(
<0.05)(见表3)。
是一种由Warren和Marshall在1983年分离出来的一种定植于胃黏膜上皮管腔表面的革兰氏阴性细菌
。全世界约有一半人口感染,中国的患病率估计值为55.8%(51.8%~59.9%)
。1%~10%的幼年感染者形成慢性进行性胃炎,导致包括消化性溃疡、胃黏膜萎缩、肠化的临床并发症,最终导致胃癌或胃黏膜相关淋巴组织淋巴瘤
。胃癌是全球第五大最常见的癌症,也是第三大癌症相关死亡的原因
,目前广泛认为
是导致非贲门型胃癌的最常见危险因素
。鉴于胃癌的高发病率与
的高感染率密切相关,胃镜下酚红染色同时进行
感染的可视化诊断和针对性的组织学评估对胃癌的筛查并制定治疗策略至关重要。既往研究证实
在胃黏膜上呈斑片状的不均匀分布
,因此,出现由经验性采样所导致的假阴性结果不可避免。
速冻。保证冷冻食品食物感觉处于良好状态极为重要,为实现该目标,在冷冻食品时主要可以应用两种方法:一种为快速冻结,另一种为深度冻结。同时严格控制冻结温度,使其位于-35℃-45℃。设定一定时间限制,通常为30秒,使中心温度上升到-18℃。
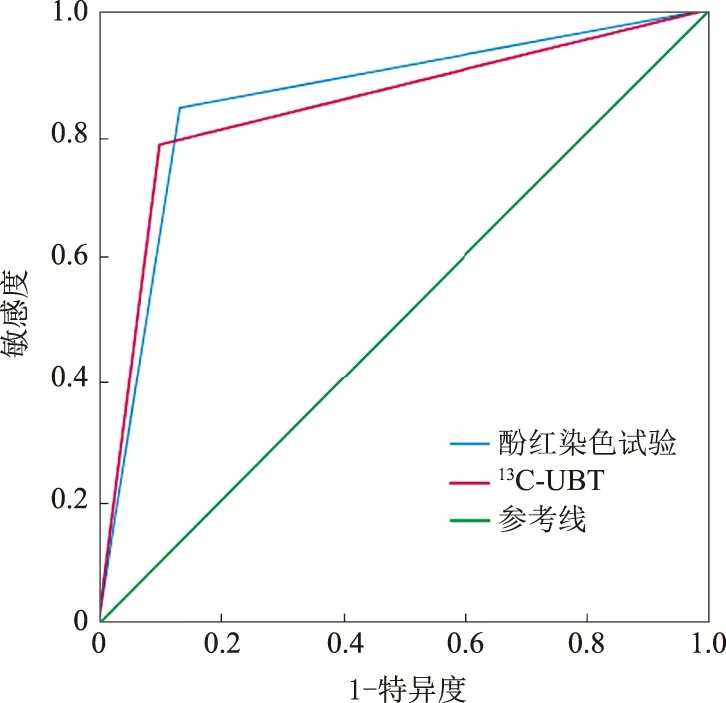


以免疫组化为金标准,胃镜下酚红染色诊断
感染的敏感度、特异度、阳性预测值、阴性预测值、准确率分别为84.0%(42/50)、86.7%(52/60)、84.0%(42/50)、86.7%(52/60)、85.5%(94/110);
C-UBT诊断
感染的敏感度、特异度、阳性预测值、阴性预测值、准确率分别为78.0%(39/50)、90.0%(54/60)、86.7%(39/45)、83.1%(54/65)、84.5%(93/110)。胃镜下酚红染色及
C-UBT与免疫组化的Kappa一致性指数分别为0.707和0.662,两组的一致性均较好。胃镜下酚红染色及
C-UBT诊断
感染的
曲线如图2所示,两种方法诊断
感染的
值均>0.8,且
值均<0.05(见表2)。
对于患病的狗,应该首先咨询狗的主人,包括上周狗的精神状态、是否吃得过多、是否接种了疫苗、是否遭受了严重的创伤、是否吃了发霉的食物、有毒物质(如砷、汞)。尿、磷等)和他最近排出的尿量。尿液的颜色、弓背的姿势、先前感染细小病毒、犬瘟热病毒、喂养次数和喂养质量。在诊断之前,了解疾病的先决条件是很重要的。

3 讨论
根据材料和方法,胃镜下酚红染色分为4种模式,其中未染色组60例(54.5%)最常见,其次为弥漫性和区域性染色模式均为18例(16.4%),另14例(12.7%)为斑片状染色。染色模式对应的Δ
C-UBT:弥漫性(38.27±17.32)、区域性(26.35±10.96)、斑片状(26.79±11.40)、未染色(2.97±6.95)。染色模式评分与Δ
C-UBT呈中度正相关(
=0.78,
<0.001)(见图3)。
1.2.3 组织病理学:由经验丰富的病理学家(检测者不清楚标本的临床、胃镜检查、胃镜下酚红染色及
C-UBT结果)进行免疫组化染色后阅片进行半定量评分:0(未找到菌体)、1+(轻度感染;细菌密度低,散在分布)、2+(中度感染;密度中等,小群状分布)或3+(重度感染;密度高,成群分布)
。另根据苏木精和伊红染色结果评估中性粒细胞浸润、慢性炎症、萎缩、肠化及
感染情况,并根据新的悉尼系统对结果进行半定量评分(无,0;轻度,1+;中度,2+;重度,3+)
。
胃镜下酚红染色方法利用
所分泌的尿素酶将外源性尿素分解为氨,从而提高胃黏膜表面的pH,与酚红起化学反应即可使酚红-尿素溶液由黄色变成红色。当细菌量少、尿素酶活性弱时,这种由黄至红的变色反应不是十分清楚,因此,观察及判断困难可能是导致假阴性的原因。虽然我们排除了近2个月有抗菌、抑酸等药物使用史的患者,但由于部分患者有长期间断服用此类药物史,可能导致菌量减少且形态发生由S型到球形的转变,这均可能导致尿素酶的活性减弱。本研究中出现的8例假阳性,其中6例为斑片状染色,且多为局限于胃窦的点状染色。考虑可能与检查中的胆汁反流有关,这对有经验的内镜医师不难辨别,因此,胃镜下酚红染色诊断
感染的特异度也会随之增大。假阳性可能与内镜检查时损伤局部胃黏膜导致细胞外液泄漏、喷雾导管高压导致局部胃黏膜损伤、胃镜检查前出现的胆汁反流冲洗不彻底及染色后局部胆汁反流有关。为了避免假阳性,我们排除了检查前胆汁反流及出血患者。对斑片状染色的患者而言,观察者之间的差异可能会影响结果。但本研究只有一个观察者,所以无法评估观察者间一致性,由于该方法只涉及由黄至红的变色反应,我们认为这并不存在较大争议且易于分析。
研究指出UBT值与细菌密度相关
尽管也有与之相矛盾的报道
,这可能与胃黏膜活检取材局限于胃窦或UBT采样时间<30 min有关。本研究根据染色结果取材行组织学检查,染色模式半定量评分与Δ
C-UBT呈正相关(
=0.78,
<0.001)。免疫组化证实
阳性的50例患者中,弥漫性染色的Δ
C-UBT显著高于区域性、斑片状和未染色的患者。这为内镜下根据染色模式直接评估细菌密度提供可能性。Moshkowitz等
的研究指出,UBT值较高的患者细菌更难根除。因此,染色模式为弥漫性或区域性的患者抗菌治疗可能比斑片状困难。未来有望通过胃镜下酚红染色诊断
感染,根据染色模式预估细菌密度并进一步评估除菌困难程度同时指导除菌方案。这还需要进一步的临床随访证据支持。
组织病理学结果提示
感染与中性粒细胞浸润、慢性炎症及萎缩显著相关,这与Xu等
的研究结果一致,该研究指出,中性粒细胞浸润可能是
感染的一个敏感的标志指标。然而,Tanko等
的一项100例消化不良患者的组织学检查发现,
定植强度与中性粒细胞浸润、慢性炎症和肠化之间存在统计学相关性。本研究发现肠化的腺体中未观察到细菌定植,但在同一组织切片内的非肠化腺体局部观察到细菌,这可能是本研究未发现与肠化之间存在显著关系的原因。本研究中萎缩与
有显著相关性,但限于仅3例。这与Tanko等
研究结果不一致。因为萎缩腺体的黏液分泌减少,可能无法为
的持续定植提供合适的环境。即
感染可能会导致萎缩或肠化,但并不一定会在萎缩或肠化区域定植。
日本药品注册收费标准评介及其对我国完善相应收费制度的启示 ………………………………………… 褚淑贞等(12):1585
本研究局限性在于病例数较少、内镜下病种欠丰富,胃镜下酚红染色模式评分与细菌载量之间关系仍需进一步研究。我们尚未观察到任何并发症。结果表明,胃镜下酚红染色是诊断
感染的一种经济、安全且有效的方法,其价值与
C-UBT相当。随着内镜技术的普及和发展,该方法在
的可视化诊断、组织学评估、基于染色模式的菌量及根除疗效的评估及指导活检的取材方面均有潜在价值。
综上,胃镜下酚红染色是一种诊断
感染的敏感、相对特异、快速、安全和低成本的有效方法,尤其适用于有活检禁忌的患者,使经验欠缺的内镜医师也可以快速诊断。
[1] Warren JR, Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis [J]. Lancet, 1983, 1(8336): 1273-1275. PMID: 6134060.
[2] Malfertheiner P, Megraud F, O′morain CA, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report [J]. Gut, 2017, 66(1): 6-30. DOI: 10.1136/gutjnl-2016-312288.
[3] Skrebinska S, Mégraud F, Bessède E. Diagnosis of Helicobacter pylori infection [J]. Helicobacter, 2018, 23 Suppl 1: e12515. DOI: 10.1111/hel.12515.
[4] Malaty HM, El-Zimaity HM, Genta RM, et al. Twenty-minute fasting version of the US 13C-urea breath test for the diagnosis of
infection [J]. Helicobacter, 1996, 1(3): 165-167. DOI: 10.1111/j.1523-5378.1996.tb00032.x.
[5] Woo HJ, Yang JY, Lee P, et al. Zerumbone inhibits Helicobacter pylori urease activity [J]. Molecules, 2021, 26(9): 2663. DOI: 10.3390/molecules26092663.
[6] Kohli Y, Kato T, Ito S, et al. Helicobacter pylori distribution in human gastric mucosa with chronic, atrophic gastritis [J]. Digestive Endoscopy, 1992, 4(4): 376-381. DOI: 10.1111/j.1443-1661.1992.tb00102.x.
[7] Kohli Y, Kato T, Iwaki M, et al. The distribution of Helicobacter pylori in human gastric mucosa in vivo [J]. Digestive Endoscopy, 1991, 3(4): 457-460. DOI: 10.1111/j.1443-1661.1991.tb00311.x.
[8] Kocsmár É, Szirtes I, Kramer Z, et al. Sensitivity of Helicobacter pylori detection by Giemsa staining is poor in comparison with immunohistochemistry and fluorescent in situ hybridization and strongly depends on inflammatory activity [J]. Helicobacter, 2017, 22(4). DOI: 10.1111/hel.12387.
[9] Kim SS, Kook MC, Shin O, et al. Factors to improve the interobserver agreement for gastric atrophy and intestinal metaplasia: consensus of definition and criteria [J]. Histopathology, 2018, 72(5): 838-845. DOI: 10.1111/his.13442.
[10] Hooi JKY, Lai WY, Ng WK, et al. Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis [J]. Gastroenterology, 2017, 153(2): 420-429. DOI: 10.1053/j.gastro.2017.04.022.
[11] Yamaoka Y. How to eliminate gastric cancer-related death worldwide? [J]. Nat Rev Clin Oncol, 2018, 15(7): 407-408. DOI: 10.1038/s41571-018-0029-8.
[12] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492.
[13] Wroblewski LE, Peek Jr RM, Wilson KT. Helicobacter pylori and gastric cancer: factors that modulate disease risk [J]. Clin Microbiol Rev, 2010, 23(4): 713-739. DOI: 10.1128/CMR.00011-10.
[14] Wang YK, Kuo FC, Liu CJ, et al. Diagnosis of Helicobacter pylori infection: current options and developments [J]. World J Gastroenterol, 2015, 21(40): 11221-11235. DOI: 10.3748/wjg.v21.i40.11221.
[15] Zagari RM, Pozzato P, Martuzzi C, et al.
C-urea breath test to assess Helicobacter pylori bacterial load [J]. Helicobacter, 2005, 10(6): 615-619. DOI: 10.1111/j.1523-5378.2005.00358.x.
[16] Rauws EA, Royen EA, Langenberg W, et al.
C-urea breath test in C pylori gastritis [J]. Gut, 1989, 30(6): 798-803. DOI: 10.1136/gut.30.6.798.
[17] Chang MC, Chang YT, Sun CT, et al. Quantitative correlation of Helicobacter pylori stool antigen (HpSA) test with 13C-urea breath test (
C-UBT) by the updated Sydney grading system of gastritis [J]. Hepatogastroenterology, 2002, 49(44): 576-579. PMID: 11995501.
[18] Logan RP, Polson RJ, Misiewicz JJ, et al. Simplified single sample 13Carbon urea breath test for Helicobacter pylori: comparison with histology, culture, and ELISA serology [J]. Gut, 1991, 32(12): 1461-1464. DOI: 10.1136/gut.32.12.1461.
[19] Moshkowitz M, Konikoff FM, Peled Y, et al. High Helicobacter pylori numbers are associated with low eradication rate after triple therapy [J]. Gut, 1995, 36(6): 845-847. DOI: 10.1136/gut.36.6.845.
[20] Xu XQ, Wang ZH, Liao JX, et al. Predictive value of neutrophil infiltration as a marker of Helicobacter pylori infection [J]. World J Gastroenterol, 2012, 18(36): 5101-5105. DOI: 10.3748/wjg.v18.i36.5101.
[21] Tanko MN, Manasseh AN, Echejoh GO, et al. Relation between Helicobacter pylori, inflammatory (neutrophil) activity, chronic gastritis, gastric atrophy and intestinal metaplasia [J]. Niger J Clin Pract, 2008, 11(3): 270-274. PMID: 19140368.

