钴银双金属表面电催化析氢和析氧性能研究*
张红玲,祁梦洁,刘锰钰,段孟言,昝灵兴
(1.延安大学 化学与化工学院,陕西省化学反应工程重点实验室,陕西 延安 716000;2.西安长庆化工集团有限公司,陕西 咸阳 712000)
2019年,我国氢产量已达2000万t,其中绝大部分是经天然气、醇类、水煤气转化而来,此类工艺能耗高、原料受限、产品纯度低并伴随着高碳排放[1,2]。为“争取2060年前实现碳中和”排放,电解水制氢是完成此目标的有效策略之一[3]。但目前,电解水析氢过电势高,能耗大且催化剂活性低和稳定性差,限制了其发展。为了进一步推进其在实际生产生活中的应用,利用高效的催化剂来降低电解槽阴极析氢过电位,从而实现降低能耗的途径已成为普遍共识。
由于单金属的催化活性受自身性质的限制,因此,双金属以及多金属催化剂被大量研发用来提高电解水析氢和析氧反应活性[4-10]。Li等[11]通过多步合成法制备出纳米片阵列结构的CoNiN析氢催化剂,相比单纯的金属Co而言,其催化活性显著提高;Xiao等[12]也报道他们制备的Co-Fe-Se三元金属超薄纳米片用于电解水制氢;Liu等报道MOF衍生的RuO2/Co3O4异质结电催化剂,在碱性条件下,对HER和OER的催化性能均有显著提升[13]。由此可见,Co基双金属催化剂在电解水催化析氢方面表现优异,具有非常广阔的应用价值与市场前景。
本文采用恒电位沉积法制备出Co/Ag双金属表面,通过沉积时间来控制Co在Ag电极表面的沉积量和覆盖度,并通过SEM和EDS分别对其表面形貌进行观测和表面元素的定性和定量分析。此外,将Co/Ag双金属表面用于电解水催化析氢和析氧反应进行评估。结果表明,Co/Ag双金属表面呈现出较强的协同催化效应,且具有对HER和OER双功能催化作用。
1 实验部分
1.1 试剂与仪器
CoCl2·6H2O(AR 99%天津欧博凯化工有限公司);H3BO3(AR 99.5%西安化学试剂厂);KOH(GR 95%天津市科密欧化学试剂有限公司);γ-氧化铝纳米抛光粉(0.05μm,>99%长沙欣辉电子科技有限公司);Ag电极(99.99%武汉高仕睿联科技有限公司)。
CH1750E型电化学工作站(上海辰华仪器有限公司);JEOL-6701型扫描电子显微镜(日本电子公司);PH5400型能谱仪(美国PE公司)。
1.2 溶液的配制
钴溶液的配制(0.05mol·L-1CoCl2·6H2O+0.5mol·L-1B(OH)3)称取CoCl2·6H2O 11.8979g,B(OH)330.9248g,置于烧杯中溶解后,转移至1000mL容量瓶,定容至刻度线,备用。
0.1mol·L-1KOH溶液的配制 称取KOH 5.6108g,置于烧杯中溶解后,转移至1000mL容量瓶,定容至刻度线,备用。
1.3 Co/Ag双金属催化剂的制备
将三电极体系置于已配制好的钴溶液中,商业化Ag盘电极(直径:3mm,纯度:99.99%,武汉高仕睿联科技有限公司)作为工作电极,Ag/AgCl和碳棒分别作参比电极和对电极(武汉高仕睿联科技有限公司)。采用计时电流法,沉积电位为-1.5 V(vs.Ag/Ag),沉积时间分别为0、15、30、45、60和120s,制备出具有不同粒径、沉积量和覆盖率的Co/Ag电极表面。然后将其迅速转移到0.1mol·L-1KOH电解质溶液中,研究其对HER和OER的催化性能。
1.4 电化学测试
使用CHI750E型电化学工作站对样品的电化学性能进行表征。测试系统采用三电极体系,Ag/AgCl参比电极、碳棒对电极和上述已制备好的Co/Ag工作电极。电解质溶液为0.1mol·L-1KOH,对析氢和析氧反应电位扫描范围分别设在0~-0.5V(vs.RHE)和1.4~1.6V(vs.RHE),扫描速率为10mV·s-1,灵敏度为1×10-3A·V-1,扫描圈数为2圈。
2 结果与讨论
2.1 Co/Ag催化表面构筑
恒电位沉积法被用来制备Co/Ag双金属表面,并通过控制沉积时间来控制Co在Ag表面的沉积量和覆盖率。本实验沉积电位控制在-1.5V(vs.Ag/AgCl),沉积时间分别为:0、15、30、45、60和120s来获得不同沉积量和覆盖率的Co/Ag双金属表面。图1为Co在Ag电极表面的沉积时间与电荷密度以及沉积量的关系图。
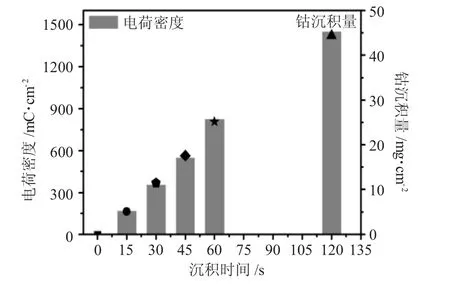
图1 Co在Ag表面的沉积时间与电荷密度和Co沉积量关系图Fig.1 Relationship between the deposition time of Co on Ag surface,the charge density,and Co loading
由图1可见,沉积时间与沉积量呈现较完美的线性关系,实现了不同沉积量的Co/Ag双金属表面。当沉积时间为60s时,Co的沉积量大约为25.16mg·cm-2。
2.2 Co/Ag催化表面对HER和OER的催化性能研究
图2为Co/Ag催化表面的HER和OER极化曲线和在电流密度为10和100m·cm-2时的HER/OER电位变化图。
由图2A和C可知,对于HER来讲,起始电位越正,过电势越小。由图2A、B可见,析氢反应的起始电位和电流密度在10mA·cm-2时的过电位随着Co在Ag表面沉积时间的增加先正向移动,然后再负向移动。Co(60s)/Ag电极表面表现出最佳的催化性能,这时Co在Ag表面的覆盖度达到66%,HER在10mA·cm-2时的过电位为~0.34V。这表明,适量的Co在Ag电极表面形成的双金属表面的活性位点最多。沉积量或覆盖度较小或者较大时,形成的双金属Co/Ag活性位点较少,从而致使其催化活性较低。
对于OER来说,起始电位越负,过电势越小。众所周知,纯Ag电极表面对OER以及HER的催化性能较差。然而,当Ag电极表面修饰一定量的金属Co时,其析氧反应在10和100mA·cm-2时的电位随着Co在Ag表面的沉积时间的增加而先降低,然后又略有增大(图2C、D)。在沉积时间达到60s时,Co(60s)/Ag对OER的催化活性显著提高,在10和100mA·cm-2时的电位分别在1.53和1.61V,其值略微负于活性较高的Co3O4。上述结果表明,Co/Ag双金属表面能够显著提高电解水析氧反应的活性。
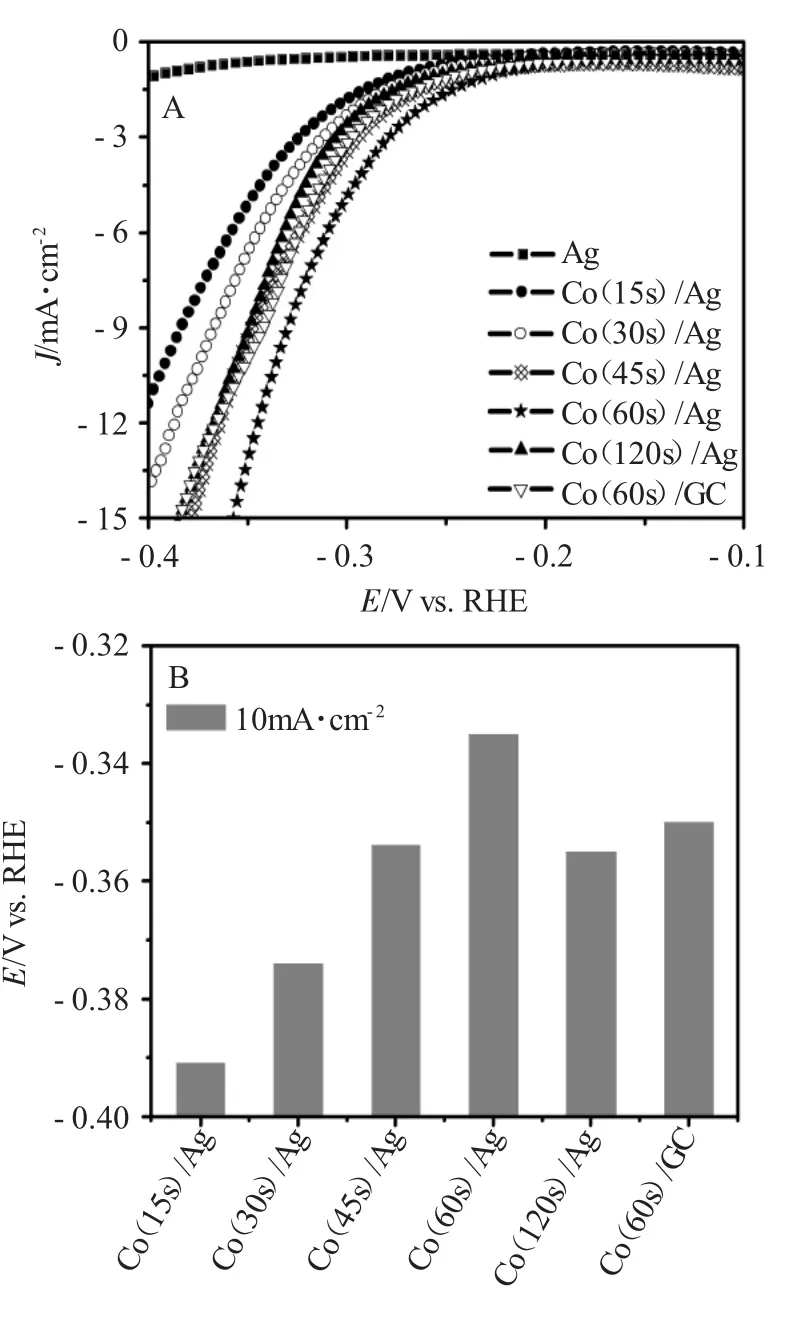
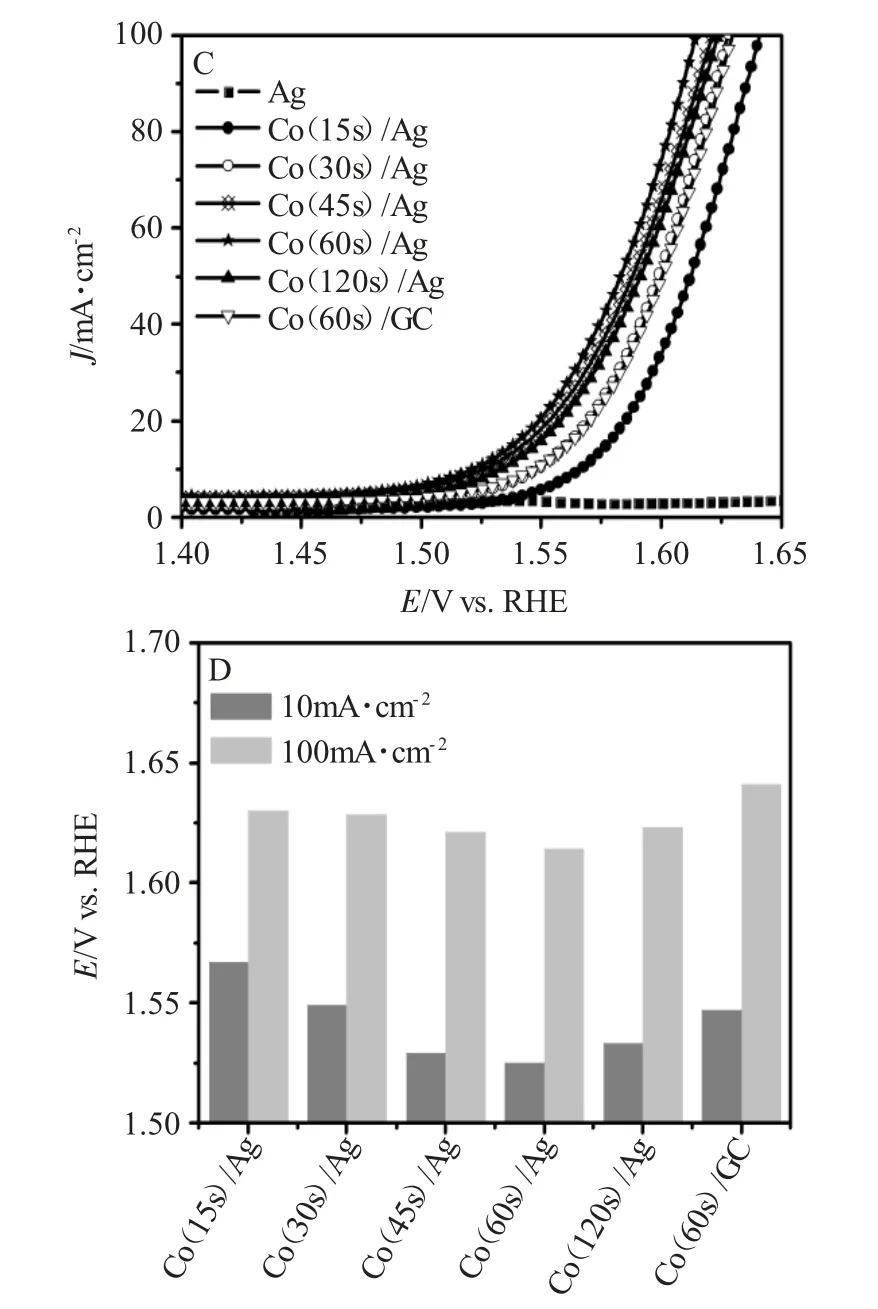
图2 Co/Ag催化表面的HER(A)和OER(C)极化曲线和在电流密度为10和100m·cm-2时的HER(B)/OER(D)电位变化图Fig.2 HER(A)and OER(C)polarization curves on Co/Ag catalytic surfaces and HER(B)/OER(D)potentials at current densities of 10 and 100m·cm-2
综上所述,Co/Ag双金属表面具有一定的双功能催化作用,且相对于单金属而言,Co/Ag双金属表面能够增强彼此对HER和OER的催化活性,因而,表现出较强的协同催化效应。这种协同催化效应很可能归因于d带电子中心的转移和溢出效应。溢出效应主要体现在:Co能够有效的吸附物种;然后吸附的氧物质溢流到Co/Ag两相界面发生反应,形成的O2会被排挤到对其吸附较弱的Ag表面,从而释放出更多的吸附和反应活性位点,有利于进一步的反应,因而提高了反应动力学。
Tafel斜率是分析电化学反应机理和反应动力学的主要方法之一。因此,对Co/Ag电极表面进行了Tafel斜率测试。结果见图3。
由图3可见,对于析氢过程来讲,在催化活性 较 高 的Co(60s)/Ag电 极 表 面,Tafel斜 率 为98mV·dec-1,接近1e-转移过程(且α=0.5)的Tafel斜率(120mV·dec-1)。众所周知,Tafel斜率为120,40和30mV·dec-1分别说明析氢反应的速率控制步骤为Volmer,Heyrovsky和Tafel反应步骤[5]。对于析氧过程来讲,Tafel斜率为60mV·dec-1时,表明水的去质子过程(OH→O+H++e-)为析氧反应的速率控制步骤;当斜率为120mV·dec-1时,水的解离过程(H2O→OH+H++e-)为析氧反应的速率控制步骤。然而,大多数催化剂析氧过程的Tafel斜率均大于或等于60mV·dec-1。通过测试发现,Co(60s)/Ag电极表面析氧过程的Tafel斜率为94mV·dec-1。
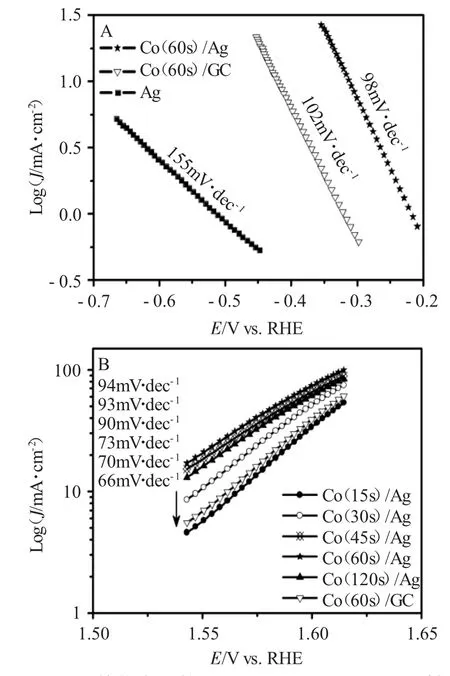
图3 Co/Ag催化表面的HER(A)和OER(B)Tafel斜率图Fig.3 Tafel slopes of HER(A)and OER(B)on Co/Ag surface
2.3 Co/Ag双金属表面分析
场发射扫描电子显微镜(SEM)被用来观测Co在多晶Ag表面的沉积结构和形貌。图4为Co(60s)/Ag电极表面放大不同倍数的SEM形貌图。

图4 Co(60s)/Ag电极表面SEM形貌图Fig.4 SEM images of Co(60s)/Ag electrode surface
由图4A可见,颗粒状和片状的Co较均匀地沉积在多晶Ag电极表面,其粒径大约在1μm以下。由图4B可见,片状沉积物的长短不一,厚度也有明显的差异。有趣的是,形成的片状金属Co是竖立在多晶Ag电极表面。然而,部分较为平整的区域(图5中椭圆区域)可能是未被Co完全覆盖的Ag电极表面。结果表明,在沉积时间为60s时,Co在Ag电极表面出现了大量沉积,形成不同结构和形貌的Co/Ag双金属表面,其在多晶Ag表面是以3D岛状(或Volmer-Weber(VW))生长模式进行沉积。
为了进一步对Co/Ag电极表面元素进行定性和定量分析,利用X射线能谱(EDS)来分别检测Co/Ag电极表面上Co和Ag的分布情况及其含量比。图5为在Co(60s)/Ag电极表面Co、Ag和O元素分布图(Mapping图)和能谱图。
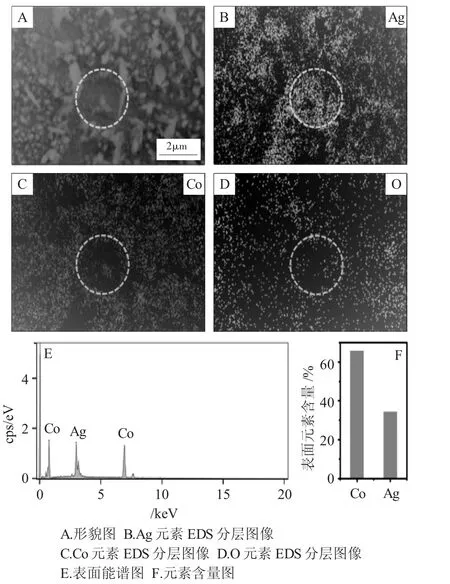
图5 Co(60s)/Ag表面Co、Ag元素Mapping图和X射线能谱图Fig.5 Co and Ag mapping diagram of Co(60s)/Ag surface and X-ray energy spectrum(EDS)diagram
由图5可见,颗粒状和片状的沉积物是Co元素,分布比较均匀,这表明所采用的方法及其电位能够实现Co在Ag表面的沉积。然而,在比较平整的区域(见椭圆区域),检测结果显示是大量的Ag元素和少量的O元素,这表明Co并未完全覆盖在Ag电极表面上且电极表面存在部分氧化,以及Co是以3D模式在多晶Ag电极表面进行沉积。图5E、F是Co(60s)/Ag的表面能谱图和元素百分含量图。当Co在Ag电极表面沉积60s时,其表面Co的含量大约在66%左右,Ag的含量在34%左右,Co和Ag表面含量比大约为2∶1,这时形成的Co/Ag双金属表面具有最佳的催化活性。
3 结论
Co在多晶Ag表面沉积是3D岛状(或Volmer-Weber(VW))生长模式,从而形成颗粒状和片状结构。电化学催化析氢和析氧研究表明:Co/Ag双金属表面的催化活性是随着Co的沉积量或覆盖量的增加先增强而后较弱。当Co在Ag电极表面沉积时间达到60s时,其表面Co的沉积量约为25.16mg·cm-2,覆盖率约为66%。此时,形成的Co(60s)/Ag双金属催化表面对HER和OER的催化活性最佳。这表明相对于单金属而言,Ag电极表面修饰适量的Co而形成的Co(60s)/Ag双金属表面,能够大幅度提高HER和OER的催化活性,表现出一定的双功能催化作用和较强的协同催化效应。

