超高效液相色谱-串联质谱检测猪胆粉中黄曲霉毒素的2种前处理方法比较研究
廖予菲,王 萍,张瑞瑞,程茜菲
(陕西国际商贸学院 ,陕西 咸阳 712046)
黄曲霉毒素(Aflatoxins,AFs)是一类结构类似的真菌(黄曲霉Aspergillus flavus和寄生曲霉A.parasiticus等)代谢产物,目前发现的20余种黄曲霉毒素中毒性较强主要有B1、B2、G1、G2等[1]。黄曲霉毒素具有致癌、致畸、致突变作用,可导致动物全身性损害,其中黄曲霉毒素B1被联合国确定为Ⅰ类致癌物[2]。传统中药材储存运输中极易发生霉变,滋生黄曲霉毒素,其中以种子果实类为最。现行的2020版《中国药典》规定24种中药材应检测黄曲霉毒素,相对2015版《中国药典》增加了土鳖虫、延胡素等5个品种。本文研究对象猪胆粉是中医药传统药物,来源于猪胆汁的干燥品,虽未纳入中国药典规定应检测的药材品种,但其生产加工过程较易产生黄曲霉毒素,同样值得关注。
现行中国药典规定的黄曲霉毒素检测方法包括HPLC-FLD(高效液相色谱-荧光检测法)、UPLC-MS/MS、ELISA(酶联免疫法)。因黄曲霉毒素为痕量检测,中药往往基质复杂,易出现假阳性结果[3]。较其他两种方法,UPLC-MS/MS法灵敏高、专属性强,能有效排除强干扰基质影响,适用于中药黄曲霉毒素的检测[4]。
药典中与色谱法配套的样品前处理方法为免疫亲和柱法,该方法利用高度专一性的抗体与黄曲霉毒素产生特异性结合,从而达到有效分离干扰物质的作用,净化效果较好,但该法操作步骤多,成本较高,较难实现快速高效检测中药中黄曲霉毒素。QuEChERS法是一种快速高效的样品前处理方法,近年来,在以农药残留量检测为代表的中药外源性污染物检测领域该方法得到了广泛应用,中国药典2020版中将该方法作为禁用农药残留测定的前处理方法之一,也有部分学者将其应用于中药黄曲霉毒素检测中[5]。
笔者对比了免疫亲和柱法及QuEChERS法两种样品前处理方法,以期为快速高效测定中药中的黄曲霉毒素提供思路。此外,准确快速检验国药,对于“三农”中家畜猪的养殖,充分利用家畜副产品具有重要意义。
1 仪器与材料
1.1 实验仪器
Acquity UPLC H-Class XEVO TQD超高效液相色谱-三重四极杆质谱联用仪(Waters科技有限公司);TE124S型电子天平(赛多利斯科学仪器有限公司); PriboFast固相萃取装置(普瑞邦科技有限公司); HC-3018R型高速冷冻离心机(安徽中科中佳科学仪器有限公司)。
1.2 实验材料
黄曲霉毒素混合对照品溶液(Bepure,批号D0017654),其中黄曲霉毒素G2浓度为0.3 μg/mL;黄曲霉毒素G1浓度为1.0 μg/mL;黄曲霉毒素B2浓度为0.3 μg/mL;黄曲霉毒素B1浓度为1.0 μg/mL。
免疫亲合柱(美国Romer Labs);QuEChERS dSPE 样品萃取净化管(岛津制作所),甲醇、乙腈(美国Fiher公司,色谱纯)、乙酸铵(德国Merck公司,色谱纯),氯化钠(国药集团化学试剂有限公司,优级纯)。猪胆粉(批号:Y1-190102,Y1-191013,福建省仙游县南丰生化有限公司),由陕西国际商贸学院王萍副教授鉴定为猪科动物猪Sus scrofa domestica Brisson.胆汁的干燥品,其中经前期检测Y1-190102未检出黄曲霉素污染,可作为阴性空白,Y1-191013检出黄曲霉毒素B2。
2 实验过程
2.1 质谱条件
离子源模式(ESI源):正电离模式;扫描方式为多反应离子监测(MRM);离子源温度:150 ℃;毛细管电压:0.5 KV;脱溶剂气温度:450 ℃;脱溶剂气流速:900 L/Hr;锥孔气流速:30 L/Hr。质谱采集参数信息见表1。

表1 质谱采集参数信息
2.2 色谱条件
色谱柱:waters ACQUITY UPLC C18(2.1×100 mm,1.7 μm);柱温:40 ℃;流速:0.3 mL/min;进样体积:2 μL。以10 mmol/L乙酸铵溶液为流动相A , 以甲醇为流动相B,按表2中的规定进行梯度洗脱。

表2 液相色谱梯度条件
2.3 对照品溶液配制
精密吸取1 mL黄曲霉毒素混合对照品溶液,加70%甲醇定容于10 mL量瓶,制备成黄曲霉毒素G2浓度为29.55 ng/mL、黄曲霉毒素G1浓度为99.50 ng/mL、黄曲霉毒素B2浓度为29.70 ng/mL、黄曲霉毒素B1浓度为99.80 ng/mL的混合对照品储备溶液。
移取上述混合对照品储备溶液适量,加70%甲醇稀释得黄曲霉毒素G2浓度分别为0.06、0.15、0.30、0.59、1.48、2.36、2.96 ng/mL,黄曲霉毒素G1浓度分别为0.20、0.50、1.00、1.99、4.98、7.96、9.95 ng/mL,黄曲霉毒素B2浓度分别为0.06、0.15、0.30、0.59、1.49、2.38、2.97 ng/mL,黄曲霉毒素B1浓度分别为0.20、0.50、1.00、2.00、4.99、7.98、9.98 ng/mL的1-7号标准系列工作溶液。
2.4 样品前处理
2.4.1 免疫亲和柱法 取供试品粉末约2 g,精密称定,置于均质瓶中,加入氯化钠3 g,精密加入70%甲醇溶液75 mL,高速搅拌2 min(搅拌速度大于11 000 r/min),离心5 min(离心速度4 000 r/min),精密量取上清液15 mL,置50 mL量瓶中,用水稀释至刻度,摇匀,离心10 min(离心速度4 000 r/min),精密量取上清液20 mL,通过免疫亲合柱,流速每分钟3 mL,用淋洗缓冲液10 mL洗脱,再用水10 mL洗脱,弃去洗脱液,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱收集洗脱液,置2 mL量瓶中,加甲醇稀释至刻度,摇匀,用微孔滤膜(0.22 μm)滤过,取续滤液,即得。
2.4.2 QuEChERS法 取供试品粉末2 g,精密称定,置50 mL离心管中,加入乙腈20 mL,涡旋1 min,超声10 min,离心5 min(离心速率10 000 r/min),取上清液,倒入QuEChERS dSPE 净化管,充分涡旋振荡2 min,离心5 min(离心速率5 000 r/min),取上清液1 mL用50 ℃氮气吹干,快速加入甲醇1 mL,过微孔滤膜(0.22 μm),取滤液,即得。
2.5 测定法
按“2.2”项下色谱条件,分别精密吸取“2.3”项下对照品溶液和“2.4”项下两种前处理方法所制供试品溶液注入液相色谱仪,测得色谱图见图1、图2。
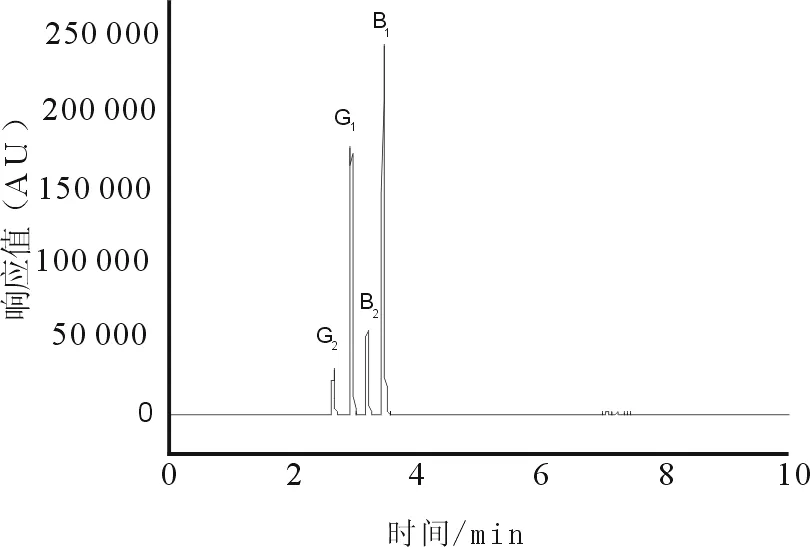
图1 黄曲霉毒素混合对照品总离子流
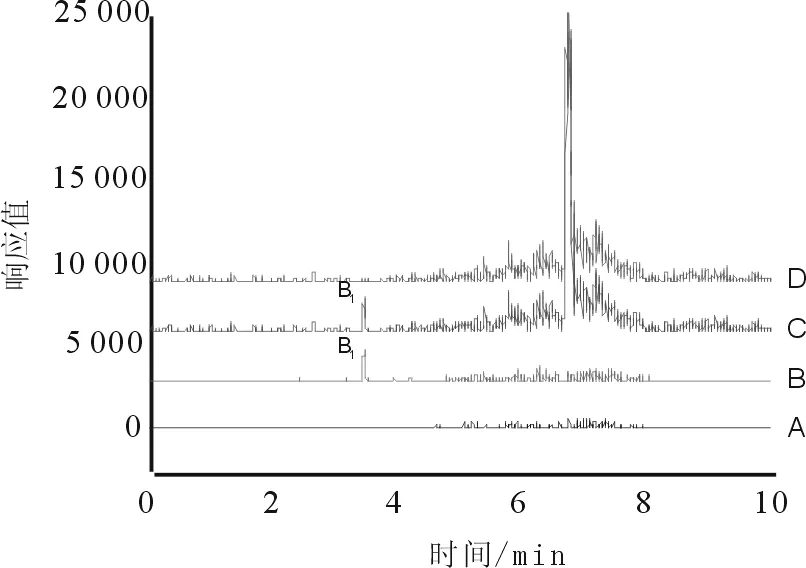
图2 猪胆粉供试品总离子流
2.6 线性关系
精密吸取“2.3项”下标准系列工作溶液各浓度2μL分别注入高效液相色谱-串联质谱仪,每个浓度重复测定2次,以峰面积为纵坐标,进样浓度为横坐标,绘制标准曲线,结果如表3所示。

表3 标准曲线回归方程
结果表明黄曲霉毒素G2在0.06~2.96 ng/mL、黄曲霉毒素G1在0.20~9.95 ng/mL、黄曲霉毒素B2在0.06~2.97 ng/mL、黄曲霉毒素B1在0.20~9.98 ng/mL浓度范围内相关系数r>0.999,浓度与峰面积呈良好线性关系,可用于标准曲线法定量。
2.7 重复性对比研究
取批号为Y1-191013的供试品分别按照“2.4” 项下两种前处理方法各制备6份样品,每份重复测定2次,按标准曲线法计算出样品中黄曲霉毒素B2含量,结果显示免疫亲和柱法RSD为3.9%、QuEChERS法RSD值为2.7%。
2.8 回收率对比研究
2.8.1 免疫亲和柱法 取批号为Y1-191013的供试品粉末,精密称定9份,分别按表4加入高、中、低浓度的 “2.3”项下混合对照品储备溶液各三份,按“2.4.1”项下的方法制备,每份重复测定2次。
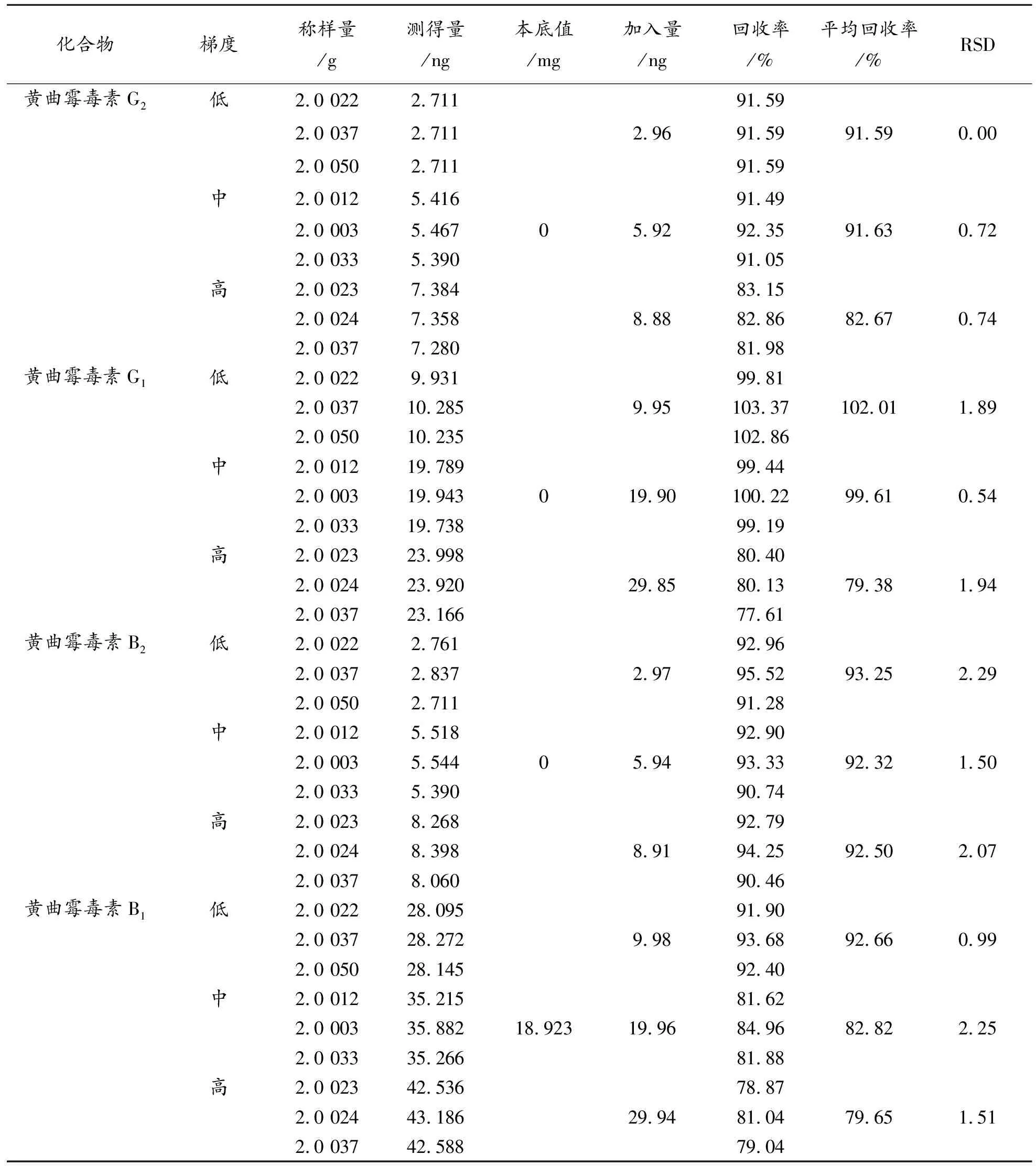
表4 免疫亲和柱法加标回收率结果
2.8.2 QuEChERS法 取批号为Y1-191013的供试品粉末,精密称定9份,分别按表5加入高、中、低浓度的 “2.3”项下混合对照品储备溶液各三份,按“2.4.2”项下的方法制备,每份重 复测定2次。
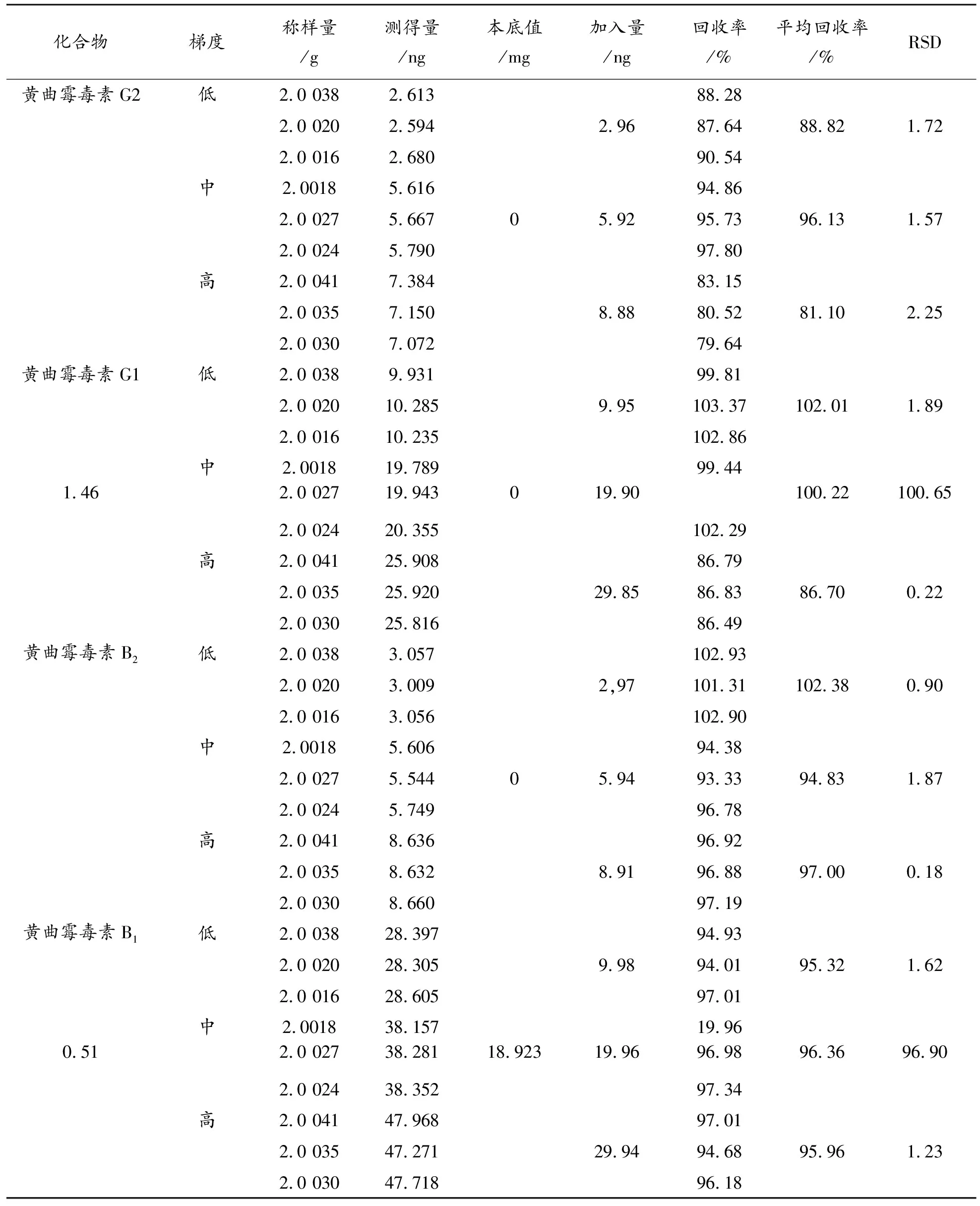
表5 QuEChERSF法加标回收率结果
2.9 检测限对比研究
取批号为Y1-190102的供试品粉末,通过比较低浓度分析物样品与空白样品测量的信号,依据信噪比为3∶>1对应的最低浓度为检出限的规定,倍比稀释相应浓度的对照品溶液加入供试品,分别按照“2.4”项下两种前处理方法各制备3份样品,分析可知,免疫亲和柱法检测限为黄曲霉毒素G2∶0.0 294 μg/kg,黄曲霉毒素G1∶>0.0 988 μg/kg,黄曲霉毒素B2∶>0.0 212 μg/kg,黄曲霉毒素B1∶0.0 888 μg/kg;QuEChERS法检测限为黄曲霉毒素G2∶>0.0 344 μg/kg,黄曲霉毒素G1∶>0.1 256 μg/kg,黄曲霉毒素B2∶>0.0 279 μg/kg,黄曲霉毒素B1∶0.1 162 μg/kg。
3 结果与讨论
3.1 前处理方法对比研究结果
两种前处理方法所制样品中杂质对四种黄曲霉毒素峰均无干扰,能专属的测定黄曲霉毒素,相对而言,免疫亲和柱法处理效果更佳,杂质较少,这与该方法能特异性结合黄曲霉毒素有关。
回收率对比实验结果采用SPSS 25.0软件对数据进行统计学处理。计量资料采用均数±标准差表示。数据均采用独立样本t检验,P≤0.05认为有显著性差异。分析结果见表6。
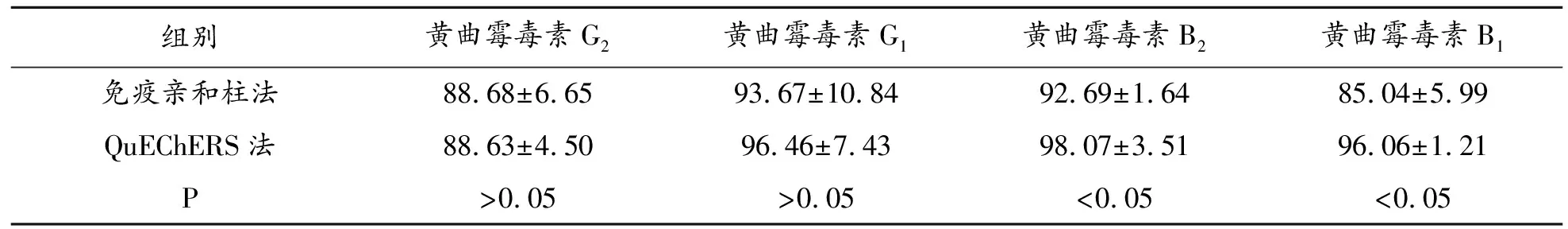
表6 两种前处理方法回收率结果比较
两种方法对黄曲霉毒素G族回收率结果无显著性差异,对黄曲霉毒素B族则QuEChERS法回收率更高,该方法操作简单,步骤少,能相应减少样品处理过程中分析对象的损失。重复性、检测限对比实验结果,免疫亲和柱法则略优于QuEChERS法。整体来看,两种方法均能专属、快速、灵敏、准确的实现样品处理分析,均可作为猪胆粉黄曲霉毒素测定的前处理方法,但综合经济成分和时间成本分析,QuEChERS成本低、操作方便、回收率高、污染小,更符合“绿色化学”的理念[6]。
3.2 提取方法考察
好的提取方法能够充分提出待测组分,有利于后续的分离纯化,对于黄曲霉毒素这种痕量污染物提取方法的优劣直接影响分析结果。实验分别对高速均质法和超声提取法进行了考察,发现对免疫亲和柱处理的样品,超声提取法效果不如高速均质法,而QuEChERS法两者差异不大,因此在免疫亲和柱处理前选择了高速均质法,QuEChERS法则出于方便考虑选择涡旋后超声处理样品。
3.3 中药猪胆粉黄曲霉毒素污染情况
实验对不同厂家生产的15批次猪胆粉药材进行了黄曲霉毒素的测定,结果显示6批次有黄曲霉毒素检出,虽均未超过中国药典对黄曲霉毒素设定的限量:黄曲霉毒素B1不得超过5 μg/kg,黄曲霉毒素G2、黄曲霉毒素G1、黄曲霉毒素B2和黄曲霉毒素B1的总量不得超过10 μg/kg[7]。作为动物来源药材,猪胆粉虽未作为《中国药典》2020年版中规定测定黄曲霉毒素的品种,其生产加工过程中易产生黄曲霉毒污染,药品的安全值得我们关注。
4 结论
实验以中药猪胆粉作为研究对象,采用UPLC-MS/MS作为测定方法,分别通过免疫亲和柱法及QuEChERS法进行样品前处理,通过考察方法的稳定性、重复性、回收率、检测限,对两种前处理方法进行评价,结果表明两种前处理方法各有优劣,但整体而言,从操作简便,节约成本的角度来讲,QuEChERS法更优。该方法可考虑进一步推广到其他药材及中成药黄曲霉毒素检测中,但中药往往基质复杂,基质对痕量物质检测结果影响较大,QuEChERS法在黄曲霉毒素测定中是否具有普适性,仍需实验验证。

