苦荞FtCBL基因的鉴定及对干旱与高钙胁迫的响应
关志秀 汪燕 梁成刚 韦春玉 黄娟 陈庆富
(贵州师范大学生命科学学院荞麦产业技术研究中心,贵阳 550001)
植物类钙调磷酸酶B蛋白(calcineurin B-like protein,CBL)是细胞中游离钙的感受器,在调控植物生长发育和响应逆境胁迫中发挥重要作用[1-2]。CBL具有典型的EF-hand结构,EF-hand结构及其结构数目与Ca2+结合有着密切关系[3-4]。1998年,在拟南芥中首次发现了CBL蛋白,与动物的钙调神经素调节B亚基和神经细胞的钙感受蛋白序列高度同源,能响应盐胁迫[5]。植物中CBL家族蛋白成员数量具有明显差异,例如,在水稻[6]、玉米[7]中发现CBL家族包含10个成员。Li等[8]在茄子中共鉴定到5个CBL蛋白,能响应Na+、Mg2+、K+、Cl-离子胁迫。Feng等[9]在甜根子草中鉴定出9个CBL基因,其中SsCBL01蛋白参与低K+胁迫响应。Xi等[10]在葡萄中鉴定出了8个CBL基因,VvCBLs基因在低温胁迫下起重要作用。Jung等[11]在白菜中鉴定的BrCBL基因能响应冷、干旱以及盐胁迫。另外,不同CBLs基因响应非生物胁迫的表达模式也存在差异。例如,Su等[12]研究表明ScCBL2-1和ScCB L3-1在PEG、NaCl、CuCl2等胁迫下表达上调,而ScCBL4基因表达下调。玉米ZmCBL9基因可负调控ABA信号、生物合成与分解代谢途径的基因表达[13]。
苦荞起源于中国的西南部,是我国重要的特色杂粮作物[14-15]。苦荞富含的黄酮类化合物对改善糖脂代谢以及预防糖尿病等具有积极作用[16-19]。苦荞主要栽植于西南高寒山区,其种植区大多为典型的喀斯特石漠化地域[20]。喀斯特地貌是由碳酸类的岩石发育而来,特殊的地质使得水土流失严重[21-22]。土壤退化且时常伴有干旱发生,土壤中高浓度的Ca2+严重影响了植物的生长[23-24]。长期的栽培驯化使得苦荞具备了较好的耐瘠薄、抗干旱等生长特性,能够很好的适应干旱高钙环境生长[25]。植物CBL蛋白为Ca2+感受器,在响应逆境胁迫中起重要作用。本研究利用生物信息学方法鉴定苦荞FtCBL基因,并通过干旱高钙胁迫处理,研究苦荞FtCBLs基因的表达量变化规律,为解析苦荞耐干旱高钙机理以及FtCBL基因功能提供科学参考。
1 材料与方法
1.1 材料
选用苦荞品种晋荞麦2号种子为材料,将饱满度一致的种子放入装有预灭菌珍珠岩的发芽盘(25 cm ×15 cm ×5 cm)里,置于人工智能光照培养箱(25℃/20℃,12 h/12 h)中种植培养。待种子出苗后第10天分别使用浓度为15%聚乙二醇(PEG)[26]、0.15 mol/L CaCl2[27]、15% PEG+0.15 mol/L CaCl2分别模拟干旱、高钙、干旱高钙的胁迫,以添加蒸馏水为对照,3次重复。分别于处理后8 h、24 h取整株幼苗,迅速使用液氮速冻,然后置于-80℃超低温冰箱保存备用。
1.2 方法
1.2.1 苦荞FtCBL基因序列分析 登录拟南芥基因库网站(https://www.arabidopsis.org/about/datasources.jsp)查询AtCBL基因序列。利用苦荞基因组(http://mbkbase.org/Pinku1/)与转录组数据库(https://ngdc.cncb.ac.cn/search/?dbId=&q=PRJNA007201),基 于基因功能注释与AtCBL同源序列分析,筛选和鉴定 苦 荞FtCBL基 因。使 用ExPASy-ProtParam tool(https://web.expasy.ory/protparam/)对筛选到的5个FtCBL基因(无剔除)进行理化性质预测。运用MapChart 2.32绘制基因在染色体上的定位图。利用http://xfam.org/网站对苦荞FtCBL进行结构域分析。利用http://gsds.gao-lab.org/在线网站对FtCBL进行基因结构分析。使用TBtools软件和PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线工具分析FtCBL启动子顺式元件。分别运用https://npsa-prabi.ibcp.fr/NPSA/npsa_sopma.html与SWISS-MODEL(https://swissmodel.expasy.ory)在线工具预测FtCBL二级与三级结构。将苦荞FtCBL蛋白序列置于NCBI(https://www.ncbi.nlm.nih.gov)网站进行Blast选出与苦荞同源的CBL蛋白,使用MEGA5.0软件ClustalW进行多重序列分析,Neighobr-joining构建系统进化树,重复次数5 000次。利用DNAMAN比较分析FtCBL及其同源蛋白序列。
1.2.2 苦荞酶活性与FtCBL基因表达分析 称取鲜样约0.200 g,置于预冷的研钵中,加入1.6 mL 50 mmol/L预冷的磷酸缓冲液(pH 7.8)研磨成匀浆,后转入离心管中在4℃、12 000×g下离心20 min,取上清液进行酶活性测定。参考李合生[28]方法测定过氧化氢酶(CTA)活性,以PBS为对照。参照曾秀存等[29]方法进行抗坏血酸过氧化物酶(APX)活性测定,以不加H2O2为空白对照。
按照EASYspin Plus植物RNA快速提取试剂盒步骤进行苦荞RNA的提取,按照TaKaRa反转录试剂盒步骤合成cDNA。使用Primer premier 5软件设计特征引物(表1)。参考梁成刚等[30]方法进行RT-qPCR分析,以FtActin为内参基因,3次生物学重复。

表1 RT-qPCR基因表达的引物序列Table 1 Primer sequences for RT-qPCR of gene expression
1.2.3 数据统计分析 使用Excel 2003软件进行数据整理,使用SPSS 19.0软件中t-test进行差异显著性分析。
2 结果
2.1 苦荞FtCBL序列分析
2.1.1 苦荞FtCBL基因理化性质与序列分析 利用生物信息学方法共鉴定到5个苦荞FtCBL的基因,cDNA序列长度在642-684 bp间,编码氨基酸213-227个,分子质量为24 305.5-26 265.9 Da,等电点在4.7-4.9间,脂肪族氨基酸指数在86.01-90.62间(表2)。

表2 苦荞FtCBL基因理化性质分析Table 2 Physicochemical properties analysis of FtCBL in F. tataricum
苦荞FtPinG0007340500.01和FtPinG00039819-00.01分别位于第3条染色体的20859357-20862492和4518499-4521025区域,FtPinG0008915000.01位于第4条染色体的55388613-55393127区域,FtPin G0000638500.01和FtPinG0003042400.01分 别 位 于第5条染色体的3296504-3300052和14628581-14634047区域(图1)。基因结构分析发现,5个FtCBL基因均含有7个内含子和8个外显子(图2-A)。启动子顺式作用元件分析发现苦荞FtCBL基因启动子区域存在光响应元件、茉莉酸甲酯响应元件、水杨酸响应元件、赤霉素响应元件、生长素响应元件、脱落酸响应元件、低温响应元件以及防御胁迫响应元件,其中,FtPinG0000638500.01基因含有6类共18个顺式元件,FtPinG0003042400.01存在3类共16个顺式元件,FtPinG0003981900.01含有6类共15个顺式元件,FtPinG0007340500.01含有6类共24个顺式元件,FtPinG0008915000.01含有3类共14个顺式作用元件(图2-B)。

图1 苦荞FtCBL的染色体定位图Fig.1 Chromosome location of FtCBL in F. tataricum
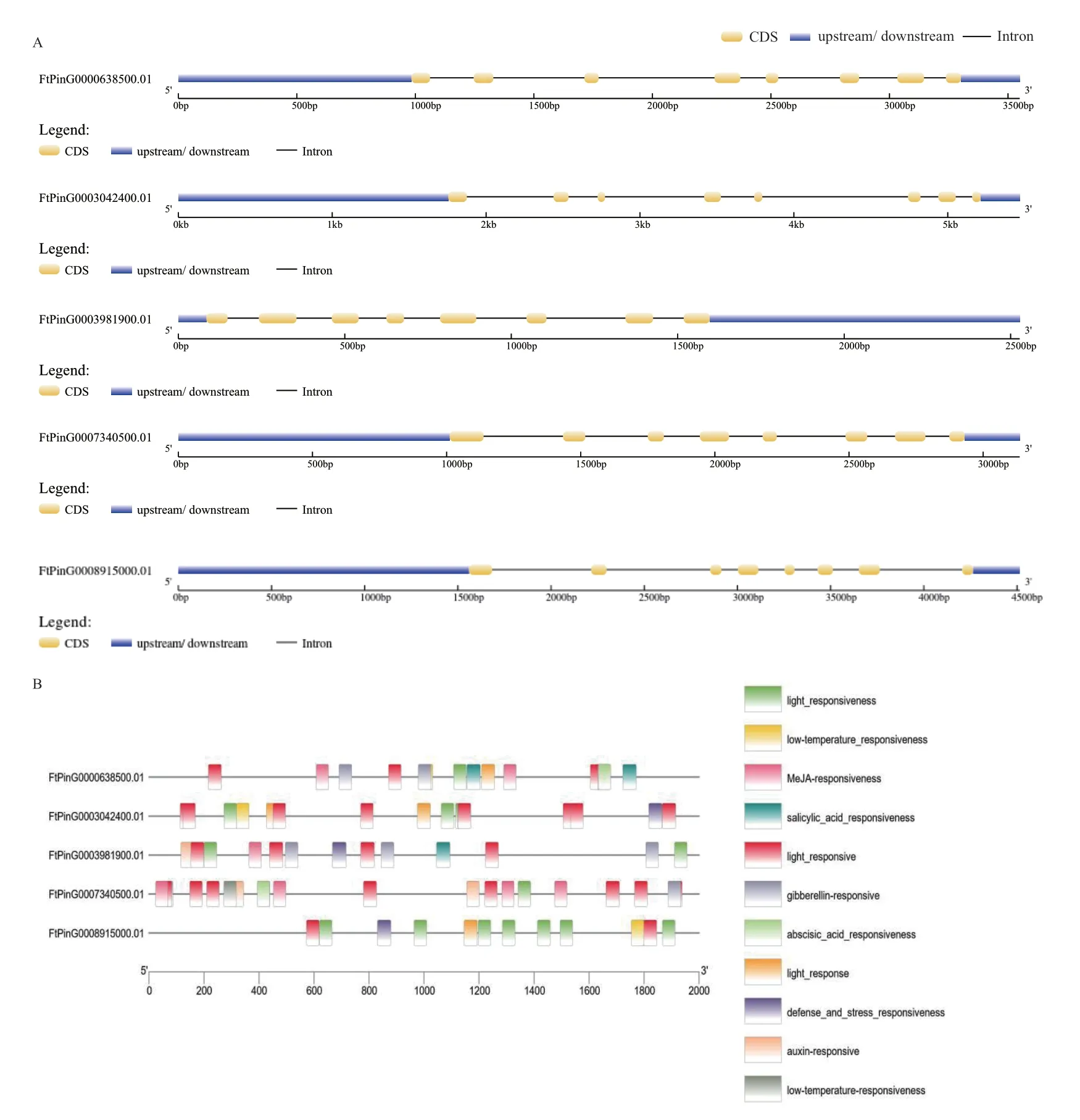
图2 苦荞FtCBL基因结构分析Fig.2 Analysis of FtCBL gene structure in F. tataricum
2.1.2 苦荞FtCBL蛋白的聚类与结构分析 利用苦荞FtCBL蛋白与其同源的蛋白序列进行聚类分析,结果发现20个蛋白被聚成4组,组II中包括3个苦荞FtCBL蛋白,其中苦荞FtPinG0007340500.01(FtCBL2)与葡萄VvCBL2、拟南芥AtCBL2、油菜BnaCBL2聚在一起,苦荞FtPinG0003042400.01(Ft-CBL3-1)和FtPinG0008915000.01(FtCBL3-2)与葡萄VvCBL3聚在一起。类III中包括2个苦荞FtCBL蛋白,FtPinG0003981900.01(FtCBL1)和FtPinG00-00638500.01(FtCBL9)聚在一起(图3)。将拟南芥AtCBL与苦荞FtCBL蛋白进行多重序列比对发现,苦荞与拟南芥CBL蛋白序列相似度达到75.25%,序列保守度较高(图4)。
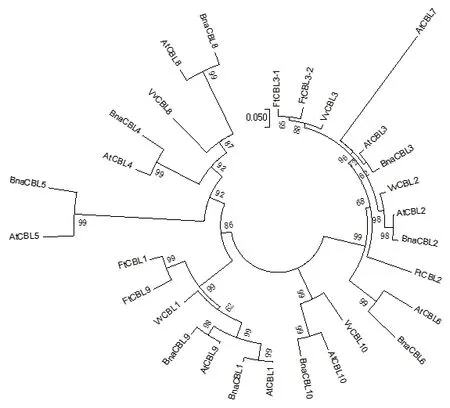
图3 苦荞CBL家族蛋白序列的聚类图Fig.3 Dendrogram of CBL family protein sequence inF. tataricum

图4 苦荞与拟南芥CBL家族蛋白序列的多重比较分析Fig.4 Multiple comparison analysis of CBL family protein sequence in F. tataricum and Arabidopsis
蛋白结构域预测发现,苦荞5个FtCBL蛋白均含有EF-hand-7结构域,其中FtCBL9蛋白还含有EF-hand-8结构域。蛋白二级结构分析发现,FtCBL蛋白中α-螺旋占49.3%-56.0%,延长链占4.44%-7.51%,β-折叠占6.1%-8.37%,无规卷曲占30.84%-36.15%(表2,图5)。FtCBL蛋白三维结构均以α-螺旋为主,其中FtCBL9蛋白构象与其余4个FtCBL蛋白差异较明显,这可能与FtCBL9蛋白具有两个EF-hand结构域有关(图5)。

图5 苦荞FtCBL蛋白结构域(A)与三维结构(B)预测Fig.5 Prediction of domain(A)and tertiary structure(B)in FtCBL protein in F. tataricum
2.2 干旱高钙对苦荞逆境响应代谢酶活性的影响
使用15% PEG、0.15 mol/L CaCl2、15% PEG+0.15 mol/L CaCl2分别模拟干旱、高钙和干旱高钙环境对苦荞幼苗进行处理。结果发现,干旱胁迫后8 h苦荞过氧化氢酶(CAT)与抗坏血酸过氧化物酶(APX)活性急剧升高,在8 h和24 h时活性均显著或极显著高于对照;高钙胁迫后8 h和24 h苦荞CAT和APX活性与对照差异未达到显著水平;干旱+高钙胁迫后8 h和24 h苦荞CAT和APX活性均显著或极显著高于对照(图6)。
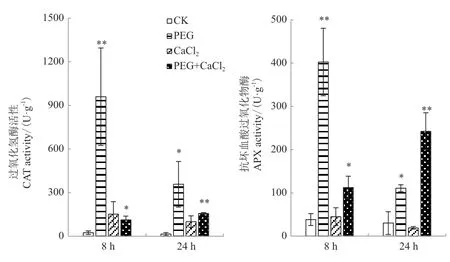
图6 不同胁迫对苦荞CAT与APX活性的影响Fig.6 Effects of different stress on the CAT and APX activities in F. tataricum
2.3 干旱高钙对苦荞FtCBL基因表达的影响
由图7可知,干旱胁迫下FtCBL1基因在8 h、24 h表达量显著下降,FtCBL2基因表达量在处理后8 h、24 h均极显著提高,FtCBL3-1基因表达量在处理后8 h极显著提高,但FtCBL3-2和FtCBL9基因表达量差异不显著;高钙胁迫下FtCBL1基因在8 h、24 h表达量显著下降,FtCBL2在8 h、24 h表达量显著或极显著提高,FtCBL9基因在24 h表达量显著下降,但FtCBL3-1、FtCBL3-2基因表达量差异不显著;干旱+高钙胁迫下FtCBL3-1在8 h、24 h表达量显著和极显著提高,FtCBL1、FtCBL2、FtCBL3-2、FtCBL9基因表达量与对照差异不显著。

图7 不同胁迫下苦荞FtCBL基因的表达分析Fig. 7 Analysis of FtCBL expression in F. tataricum under different stress
3 讨论
植物CBL是一类钙感受器,可参与特定信号转导。研究发现,CBL被Ca2+激活后,可与CIPK结合,进而激活下游基因,参与逆境响应[9]。植物CBL蛋白具有特殊的EF-hand结构,该结构与Ca2+的结合位置有关[3,12,31]。一般认为,EF-hand结构的数目与Ca2+结合能力有关[4]。本研究共鉴定到5个苦荞FtCBL蛋白,均包含有EF-hand结构域。其中FtCBL9存在两个结构域,推测该蛋白与Ca2+的结合能力更强。
赵晋锋等[32]在谷子中鉴定到7个SiCBL基因,其序列非常保守,与拟南芥、水稻、高粱、玉米、苔藓和火炬松CBL一起被聚为4个组,存在垂直同源基因对与平行同源基因对。黄瓜CBL4则与拟南芥CBL2为直系同源,且蛋白序列的相似度高达89.82%[33]。另外,蒺藜苜蓿CBL[34]、马铃薯CBL[4]等都存在直系的同源基因也存在垂直同源基因对。本研究发现,苦荞5个FtCBL蛋白序列与拟南芥相似度达75.25%,高度保守。聚类分析将苦荞与其同源CBL蛋白序列聚为4组,这与赵晋锋等[32]研究结果一致。不过,苦荞中仅包含两组CBL蛋白,但同样存在垂直同源基因对与平行同源基因对。
我国苦荞主产区大多在喀斯特区域,长期的栽培驯化使得苦荞具备了较好的非生物胁迫耐受力。本研究发现PEG模拟的干旱胁迫使苦荞CAT与APX活性急剧升高,但在CaCl2处理下APX活性变化不明显,说明苦荞较能适应在喀斯特地区高钙环境下生长。近年来已经克隆到一些与苦荞耐逆境胁迫相关的基因[35]。植物CBL基因能响应逆境环境,但在不同逆境程度与不同逆境胁迫下的表达模式并不相同[36]。例如,甜菜CBL基因在低浓度盐胁迫下表达量高,而高浓度盐胁迫下降低[31]。Wang等[37]研究发现,在PEG处理下玉米ZmCBL4表达量在2 h、6 h上升,但在12 h下降,不过随后又上升,到24 h达到峰值。转基因拟南芥中AtCBL1受干旱胁迫诱导表达上调,但受冷胁迫表达量下调[38]。本研究发现苦荞FtCBL1在干旱胁迫下表达量显著下调,推测不同物种间CBL1基因对干旱的响应存在差异。此外,苦荞FtCBL1在高钙胁迫下表达量显著下调,不过,在干旱高钙双重胁迫下表达量与对照无明显差异。韩玉燕等[39]研究发现莲藕CBL2受NaCl与ABA诱导表达,推测CBL2基因可能参与ABA信号转导途径,进而调控莲藕耐盐能力。本研究发现,苦荞FtCBL2在干旱和高钙单独胁迫下表达量均极显著上调,推测FtCBL2在响应干旱或高钙胁迫下发挥重要作用,但在干旱高钙双重胁迫下FtCBL2表达量同样差异不显著。蔡琼等[40]研究指出马尾松PmCBL3基因受干旱胁迫诱导,在15 d表达量最高,但随干旱胁迫加剧表达量逐渐降低。本研究发现,苦荞FtCBL3-1在干旱胁迫8 h、干旱高钙胁迫8 h、24 h显著或极显著上调;但不同胁迫下FtCBL3-2表达量与对照均未达到显著水平,表明FtCBL3-1可参与响应干旱、干旱高钙胁迫。胡斐等[41]研究发现,过量表达拟南芥AtCBL9可提高甘蔗耐低钾能力。本研究发现,苦荞FtCBL9仅在高钙胁迫下表达量显著下调,在干旱和干旱高钙下表达量差异不显著,说明FtCBL9仅能响应高钙胁迫。本研究鉴定到的5个苦荞FtCBL基因在干旱、高钙、干旱高钙胁迫下表达模式不尽相同,这可能与CBL基因响应胁迫的表达模式受逆境应答的不同信号途径调控有关[32]。此外,有研究认为基因的表达还受到启动子区域顺式作用元件种类与数量的影响[42]。植物CBL基因含有多种激素与胁迫响应元件[34]。苦荞FtCBL基因的启动子区域间同样存在多种顺式作用元件,但不同基因间顺式作用元件的种类与数量存在差异,例如FtCBL1和FtCBL2启动子区域存在多个激素与胁迫响应元件,而FtCBL3-1和FtCBL3-2均不存在茉莉酸甲酯、水杨酸、赤霉素、生长素、脱落酸响应元件,说明FtCBL基因响应逆境胁迫的表达模式也受到了启动子顺式作用元件的调控。
4 结论
本研究鉴定到5个苦荞FtCBL基因,编码213-227个氨基酸,蛋白序列高度保守,均具有EF-hand结构域。不同FtCBL基因在干旱、高钙、干旱高钙胁迫下表达模式存在差异,其中FtCBL1、FtCBL2响应干旱、高钙胁迫,FtCBL3-1响应干旱、干旱高钙胁迫,FtCBL9响应高钙胁迫。