PLA2G7基因在宫颈癌中的表达及与临床预后 和免疫浸润的关系
王小燕,李虎玲,张 晶,王 凯
(新疆医科大学 a. 公共卫生学院;b. 医学工程技术学院,乌鲁木齐 830017)
宫颈癌(cervical cancer,CC)作为最常见的女性恶性肿瘤之一,是女性癌症死亡的第四大原因,2020年全世界约有60.4万新发病例和34.2万死亡病例[1]。虽然对宫颈癌的早期筛查和预防接种工作有所扩大,但全球宫颈癌新发病例数量仍持续增加,这意味着宫颈癌仍是一个重大的公共卫生问题[2]。目前,仍缺乏有效地指导宫颈癌治疗的预后生物标志物和治疗靶点。因此,寻找新的生物标志物,探讨其病理机制,对改善宫颈癌患者的生存具有重大价值。
磷脂酶A2-VII(phospholipase A2 groupⅦ,PLA2G7)的基因位于6号染色体6p12.3条带,编码的蛋白质为Lp-PLA2,又名PAF-AH[3]。既往研究表明,PLA2G7是一种肿瘤相关巨噬细胞衍生因子[4],在调节肝癌[5]、乳腺癌[6]、前列腺癌(prostate adenocarcinoma,PRAD)[7]的细胞迁移中起关键作用。目前,有关PLA2G7在宫颈癌发生发展中的作用研究鲜有报道。本文旨在通过多种肿瘤数据库探索PLA2G7在宫颈癌中的表达、预后价值及其生物学功能情况,以期作为预测宫颈癌免疫治疗应答的新的生物标志物。
1 材料与方法
1.1 cBioPortal数据库分析
cBioPortal数据库(https://www.cbioportal.org/)可用于多种癌症基因组数据集的交互式探索[8]。该数据库包含TCGA数据库(https://portal.gdc.cancer.gov/)的同源数据,可用于研究体细胞突变、DNA拷贝数突变、DNA甲基化和其他基因类型。本研究使用该数据库分析PLA2G7基因在所有TCGA肿瘤类型中的突变类型和拷贝数改变信息。在cBioPortal数据库首页点击“Quick select”中的“TCGA PanCancer Atlas Studies”,然后点击“Query By Gene”,输入基因名称“PLA2G7”进行分析。
1.2 GEO数据库分析
GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)是数据集的国际公共数据库,包括来自单通道和双通道测定mRNA表达的数据以及基因组DNA和蛋白质的试验数据[9]。本研究使用GEO中的GEO2R分析平台识别4个表达谱数据集(GSE63514、GSE67522、GSE9750和GSE7803)中PLA2G7的差异表达。GSE63514包含28个宫颈肿瘤组织和24个宫颈正常组织,GSE67522包含20个宫颈肿瘤组织和22个宫颈正常组织,GSE9750包含27个宫颈肿瘤组织和24个宫颈正常组织,GSE7803包含21个宫颈肿瘤组织和10个宫颈正常组织。以|log2FC| >1和调整P值(adj.P)<0.05为差异基因的筛选条件。
1.3 GEPIA2数据库分析
GEPIA2(http://gepia2.cancer-pku.cn)是最近发布的分析工具,包含8 587个正常样本和9 736个肿瘤样本的RNA测序表达数据,可用于差异分析、患者生存分析和相关性分析[10]。使用“Profile”工具确定泛癌中PLA2G7表达水平,“Survival Map”工具确定泛癌中PLA2G7表达与总生存(overall survival,OS)的关联,对数秩检验比较高表达PLA2G7组与低表达PLA2G7组的患者Kaplan-Meier生存图。
1.4 PLA2G7表达在临床特征亚组中的预后分析
在TCGA数据库中下载宫颈癌患者的转录组数据和临床特征数据。排除总生存时间为0 d的患者,以PLA2G7表达的中位数为截断值,分为高表达和低表达两个亚组。采用分层Cox比例风险模型分析PLA2G7在不同临床特征亚组中的预后情况。
1.5 基因集富集分析和基因集变异分析
采用基因集富集分析(gene set enrichment analysis,GSEA)和基因集变异分析(gene set variation analysis,GSVA)方法研究PLA2G7在宫颈癌中的生物学功能。从GSEA官方网站(http://www.gsea-msigdb.org/gsea/msigdb/index.jsp)下载基因本体(gene ontology,GO)基因集文件c5.go.v7.4.symbols.gmt和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)基因集文件c2.cp.kegg.v7.4.symbols.gmt。R中的GSEABase和GSVA包分别用于GSEA分析和GSVA分析,并能将与PLA2G7表达相关的5个富集基因集和15条信号通路进行可视化。
1.6 TIMER数据库分析
TIMER数据库(https://cistrome.shinyapps.io/timer/)是系统分析不同癌症类型免疫浸润的综合资源,拥有来自TCGA数据库的大部分同源数据[11]。通过“Gene”模块分析PLA2G7表达与免疫浸润细胞丰度的相关性,包括B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突细胞。此外,通过“Correlation”模块探索了PLA2G7表达与肿瘤浸润免疫细胞基因标志物之间的相关性。肿瘤浸润免疫细胞包括CD8+T细胞、T细胞(一般)、B细胞、单核细胞、肿瘤相关巨噬细胞(tumor-associated macrophage cell,TAM)、M1巨噬细胞、M2巨噬细胞、中性粒细胞、自然杀伤细胞(natural killer cell,NK)、树突状细胞(dendritic cell,DC)、辅助性T1细胞(type 1 T helper cell,Th1)、辅助性T2细胞(type 2 T helper cell,Th2)、滤泡辅助T细胞(T follicular helper cell,Tfh)、辅助性T17细胞(type 17 T helper cell,Th17)、调节性T细胞(regulatory T cell,Tregs)和衰竭T细胞。这些肿瘤浸润免疫细胞的基因标志物在以往的研究中已被引用[12]。
1.7 统计分析
使用R语言(版本3.6.2)分析数据。采用Cox比例风险回归模型分析在临床特征亚组中的PLA2G7表达与预后的关系,并计算风险值及其95%置信区间。基因表达的相关分析通过Spearman相关性和统计显著性进行评估。相关性的强度使用以下绝对值指南确定:0~0.19“非常弱”,0.20~0.39“弱”,0.40~0.59“中等”,0.60~0.79“强”,0.80~1.00“非常强”。P<0.05被认为具有统计学意义。
2 结果与分析
2.1 PLA2G7基因在泛癌中的遗传变异情况
研究使用cBioPortal数据库,对PLA2G7基因的遗传变异进行了泛癌分析。该数据包括32项TCGA泛癌研究中的10 953例患者/10 967例样本,基因改变的频率为2.1%。较为常见的DNA改变是扩增和突变。在弥漫性大B细胞淋巴瘤(lymphoid neoplasm diffuse large B-cell lymphoma,DLBC)、食管癌(esophageal carcinoma,ESCA)、卵巢浆液性囊腺癌(ovarian serous cystadenocarcinoma,OV)中扩增占比较高,在皮肤黑色素瘤(skin cutaneous melanoma,SKCM)、子宫内膜癌(uterine corpus endometrial carcinoma,UCEC)、子宫肉瘤(uterine carcinosarcoma,UCS)中突变频率较高(图1)。

图1 PLA2G7在泛癌中的遗传变异Fig. 1 Genetic aberration of PLA2G7 in TCGA pan-cancer
2.2 PLA2G7基因在泛癌中的差异表达和预后分析
如表1所示,PLA2G7在4个宫颈癌GEO数据集中的差异表达分析结果表明,PLA2G7在宫颈肿瘤组织中的表达水平显著高于宫颈正常组织。如图2a所示,PLA2G7在膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA)、宫颈鳞癌和腺癌(cervical squamous cell carcinoma and endocervical adenocarcinoma,CESC)、结肠癌(colon adenocarcinoma,COAD)、弥漫性大B细胞淋巴瘤、食管癌、头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSC)、肾透明细胞癌(kidney renal clear cell carcinoma,KIRC)、肾乳头状细胞癌(kidney renal papillary cell carcinoma,KIRP)、胰腺癌(pancreatic adenocarcinoma,PAAD)、前列腺癌、直肠腺癌(rectum adenocarcinoma,READ)、皮肤黑色素瘤、胃癌(stomach adenocarcinoma,STAD)、睾丸癌(testicular germ cell tumors,TGCT)、胸腺癌(thymoma,THYM)、子宫内膜癌、子宫肉瘤肿瘤组织中显著高于其正常组织中的表达水平。如图2b所示,PLA2G7表达水平与宫颈癌患者的预后密切相关。图3所示的生存曲线表明,PLA2G7高表达的患者OS较长(Log-rankP=0.030)。

图2 PLA2G7的表达和预后分析Fig. 2 Expression and prognostic analysis of PLA2G7

图3 PLA2G7在宫颈癌中的生存曲线Fig. 3 Survival curve of PLA2G7 in cervical cancer
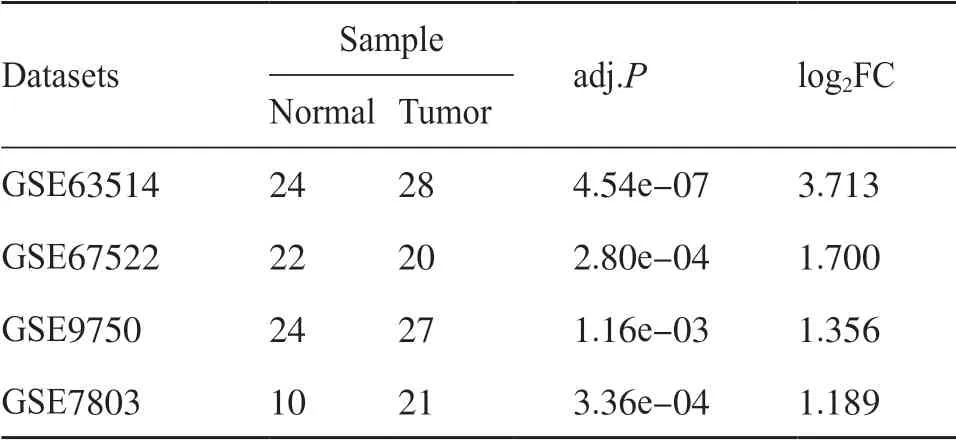
表1 PLA2G7在4个GEO数据集中的差异表达Tab. 1 Differential expression of PLA2G7 in 4 GEO datasets
2.3 PLA2G7表达在临床特征亚组中的预后分析
本研究以PLA2G7表达的中位数为截断值,将291例患者分为高表达组和低表达组并进行单因素Cox回归分析。如表2所示,在291例宫颈癌患者中,PLA2G7高表达是影响患者生存的保护因素(HR=0.50,95%CI:0.31~0.80,P=0.004)。为进一步探索PLA2G7表达是否在宫颈癌患者临床特征亚组中仍具有预后价值,通过对PLA2G7表达在临床特征亚组中的单因素Cox回归分析发现,PLA2G7高表达在年老组(HR=0.49,95%CI:0.26~0.93,
P=0.030)、stageⅠ&stageⅡ(HR=0.47,95%CI:0.26~0.85,P=0.012)以及G3&G4(HR=0.30,95%CI:0.12~0.71,P=0.006)中与患者良好的预后显著相关(表2)。结果表明,在预测宫颈癌患者的生存中PLA2G7高表达具有较高的预后价值。
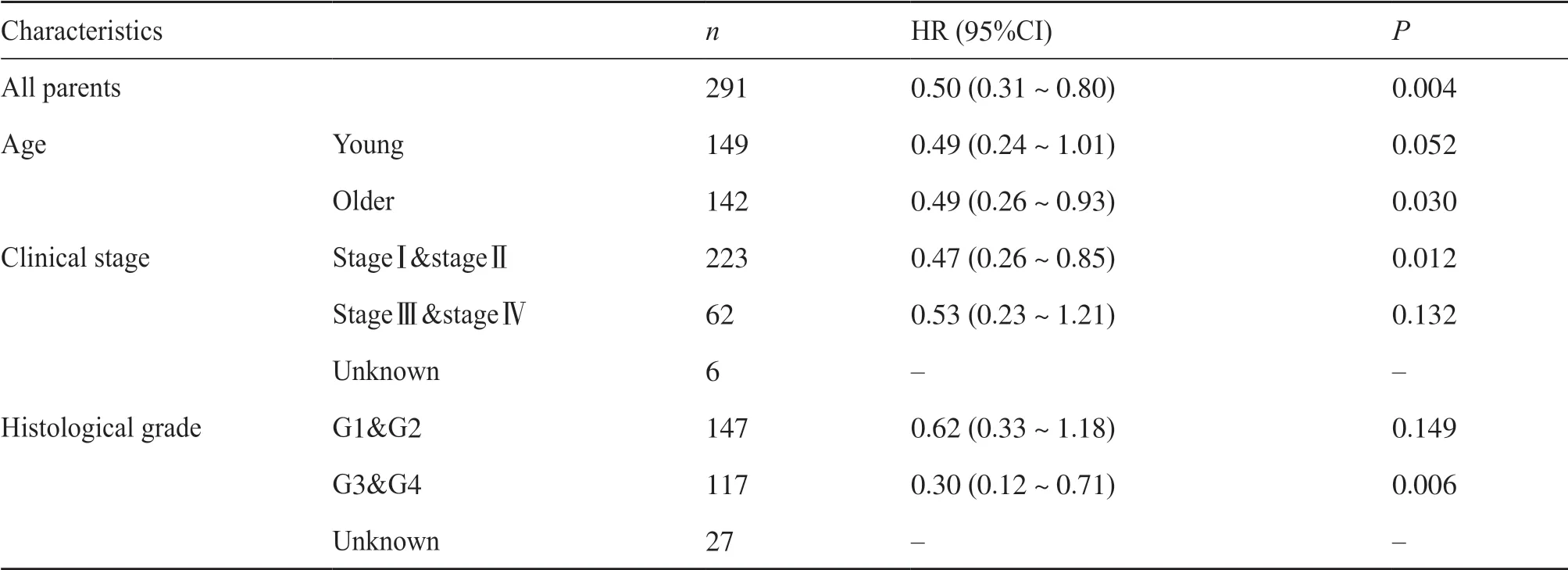
表2 不同临床特征亚组中PLA2G7的表达与预后的关系Tab. 2 The relationship between PLA2G7 expression and prognosis in different clinical characteristics subgroups
2.4 GSEA和GSVA
为探索PLA2G7在宫颈癌中表达的生物学意义,本研究进行了GESA和GSVA分析。如图4a所示,GSEA分析结果表明,PLA2G7正向调节宫颈癌炎症反应、防御反应调节、细胞膜表面、MAPK级联调控以及凋亡信号通路等相关功能。如图4b所示,GSVA分析结果表明,PLA2G7的表达与造血细胞谱系、利什曼原虫感染、趋化因子信号通路以及一些免疫相关通路,包括同种异体排斥反应、T细胞受体信号通路、自然杀伤细胞介导的细胞毒性、产生IgA的肠道免疫网络等呈正相关。相反,PLA2G7的表达与细胞周期相关途径和果糖、丁酸代谢等的特定代谢途径呈负相关。
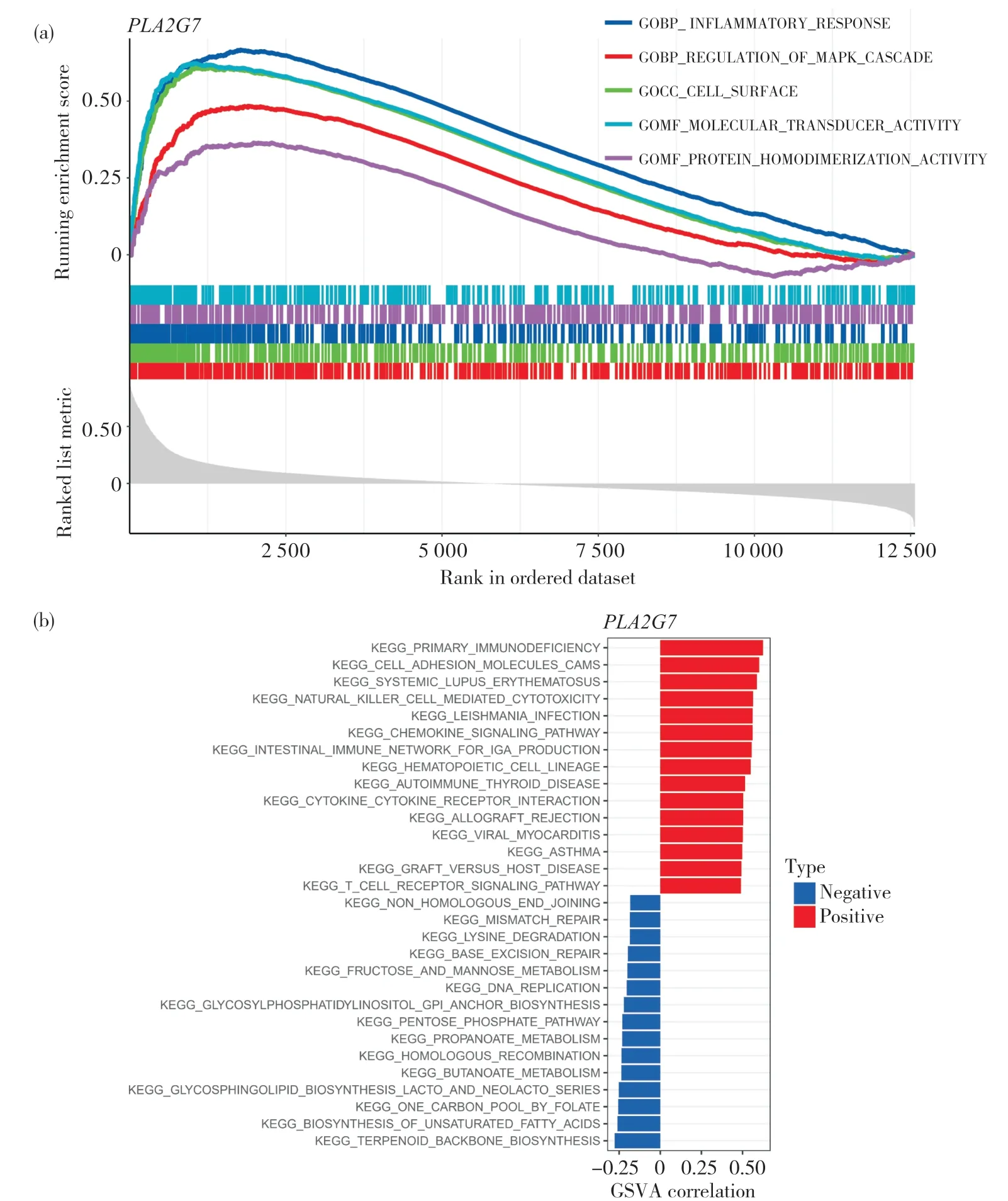
图4 宫颈癌中PLA2G7的GSEA和GSVA分析Fig. 4 GSEA and GSVA analysis of PLA2G7 in cervical cancer
2.5 PLA2G7表达与免疫浸润细胞相关
图5表明,在宫颈癌患者中,PLA2G7表达与肿瘤纯度(r=-0.323,P=3.60e-08)、B细胞(r=0.274,P=3.68e-06)、CD8+T细胞(r=0.447,P=7.51e-15)、CD4+T细胞(r=0.440,P=1.51e-14)、巨噬细胞(r=0.367,P=3.07e-10)、中性粒细胞(r=0.487,P=6.47e-18)和树突状细胞(r=0.697,P=1.55e-41)的浸润水平显著相关。这些发现提示,PLA2G7在宫颈癌免疫浸润中发挥特定作用,尤其是在中性粒细胞和树突状细胞中。

图5 宫颈癌中PLA2G7与免疫浸润细胞水平的相关性Fig. 5 Correlation analysis between PLA2G7 and immune infiltration cells level in cervical cancer
2.6 PLA2G7表达与免疫标记基因的相关性分析
如表3所示,通过纯度相关性调整后,在TIMER数据库中PLA2G7表达与免疫细胞基因标记物CD8A、CD3D、CD3E、CD2、CD68、IL10、VSIG4、CD11b(ITGAM)、CCR7、HLA-DPB1、HLA-DRA、HLA-DPA1、T-bet(TBX21)、STAT4、STAT1、IFN-γ(IFNG)、FOXP3、CCR8、PD-1(PDCD1)、LAG3和GZMB的表达之间存在中等强度的相关性,并与免疫细胞基因标记物CD86、CD115(CSF1R)、CD163、MS4A4A、CD11c(ITGAX)、CTLA4和TIM-3(HAVCR2)的表达存在强相关性。这些基因标记物主要为CD8+T细胞、T细胞(一般)、单核细胞、TAM、M2巨噬细胞、中性粒细胞、树突状细胞以及不同功能性T细胞,如Th1细胞、Tregs细胞和衰竭T细胞的标记蛋白。
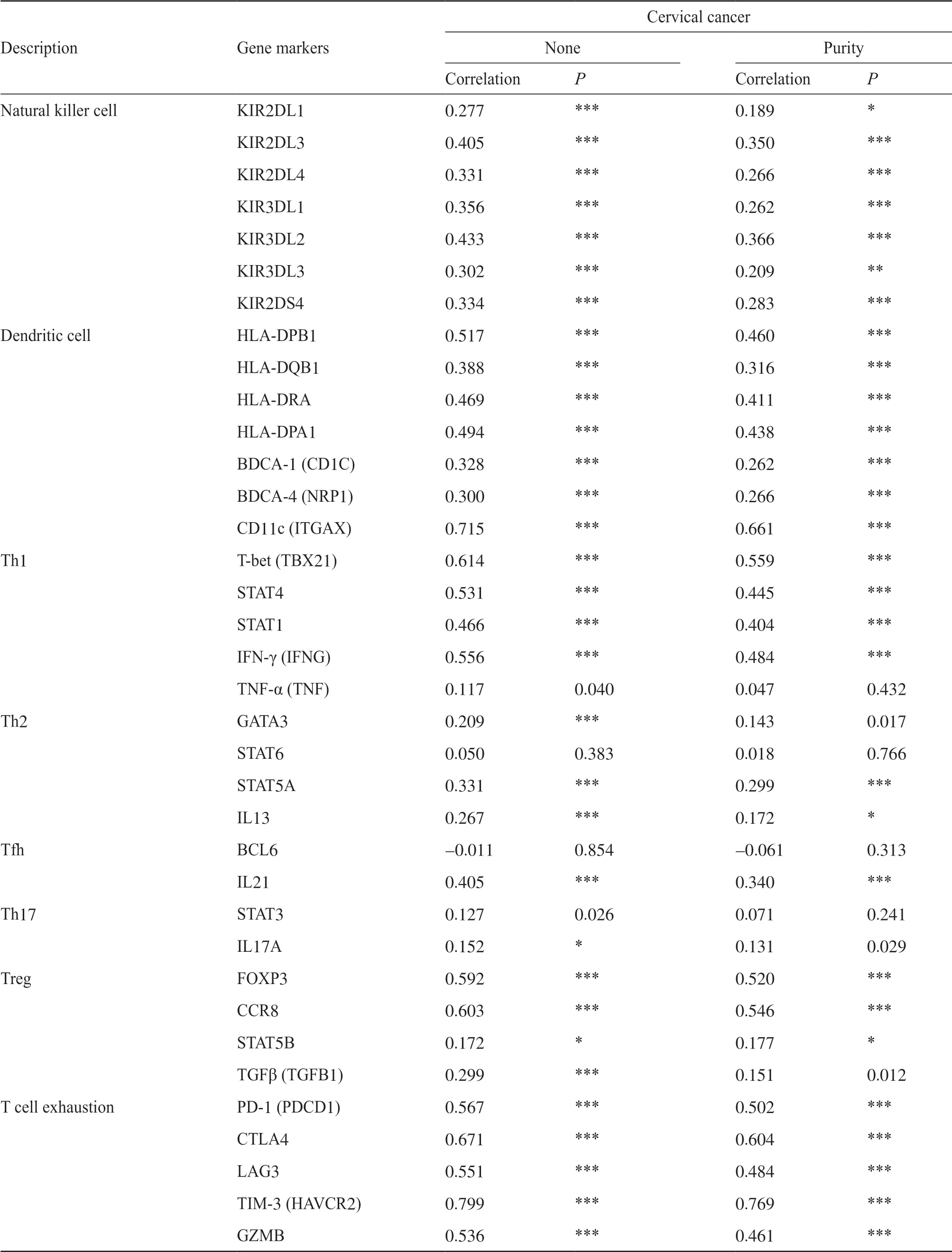
表3 (续) Tab. 3 (continued)
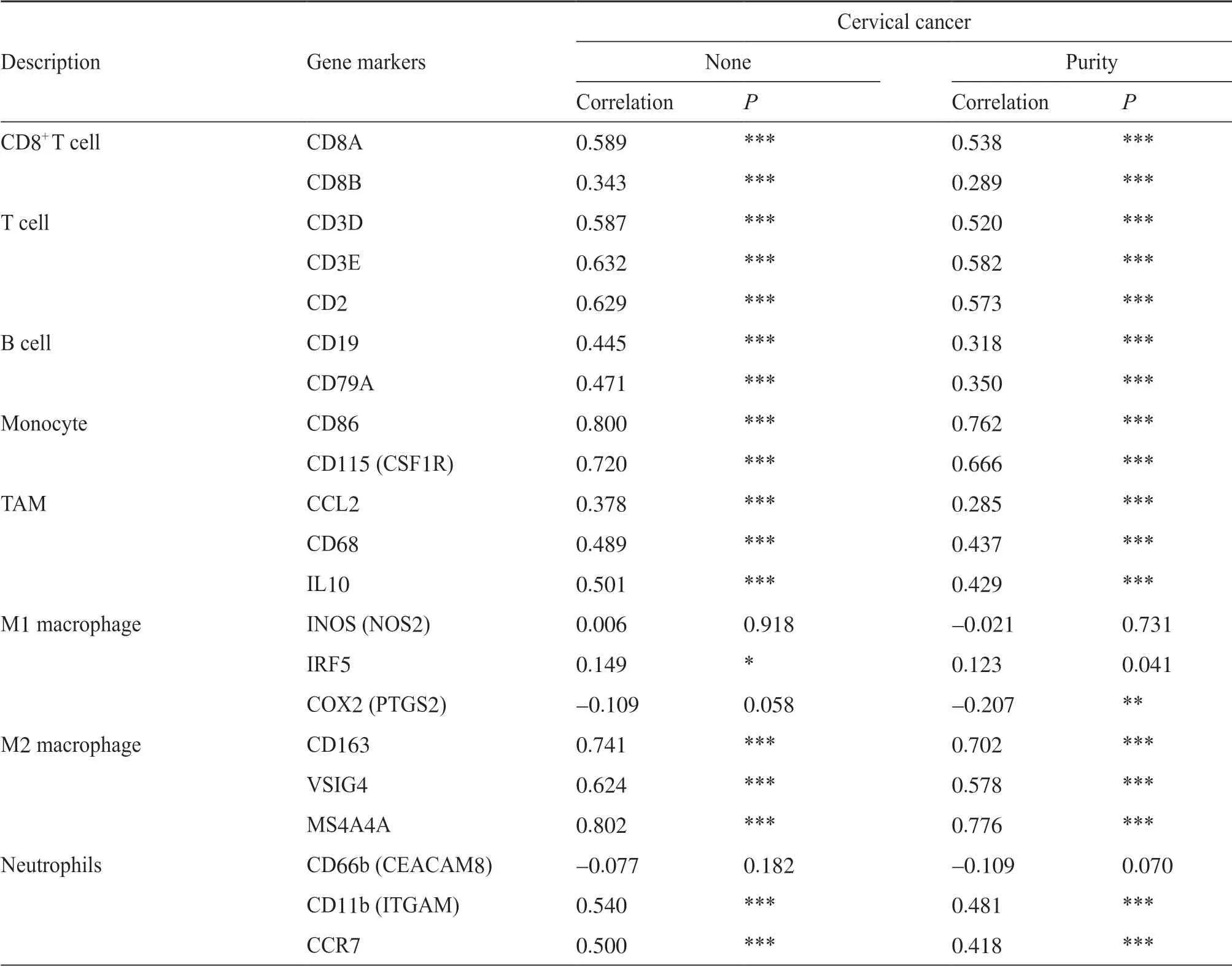
表3 PLA2G7与免疫细胞基因标志物的相关性分析Tab. 3 Correlation analysis between PLA2G7 and relate genes and markers of immune cells
3 讨论
PLA2G7编码蛋白Lp-PLA2(又名PAF-AH),是一种与脂蛋白结合的血浆酶,主要由巨噬细胞和活化的血小板产生[13-14]。既往研究表明,Lp-PLA2可以作为心脑血管疾病的炎症生物标志物[15],对预测心脑血管疾病的发生风险具有重要价值。在肿瘤的发生发展中,PLA2G7作为巨噬细胞衍生因子调节肿瘤细胞的迁移[16]。在鼻咽癌细胞中,PLA2G7可以增强肿瘤细胞的迁移和存活[17];在弥漫性大B细胞淋巴瘤[18]、乳腺癌[6]、前列腺癌[7]细胞中也有类似的发现。目前,在宫颈癌中有关PLA2G7的研究鲜有报道。本研究分析了PLA2G7在宫颈癌患者中的表达、预后价值及其生物学功能,这为进一步研究PLA2G7在宫颈癌中的作用奠定了基础。
研究发现,与正常组织相比,PLA2G7在多种肿瘤组织中显著高表达。生存分析表明:PLA2G7高表达组的宫颈癌患者预后更好;同时,在全人群中的Cox风险比例模型显示,PLA2G7为保护因素;在年老组、stageⅠ&stageⅡ及G3&G4中,PLA2G7的高表达患者预后较好,而在年轻组、stageⅢ&stageⅣ和G1&G2中,PLA2G7的高表达与患者的预后无关。由此表明,在不同患者的临床亚组分析中,PLA2G7高表达能够稳定地预测患者的生存。在BRCA1突变卵巢癌中的研究表明[19],PLA2G7高表达与总生存期的延长显著相关,并首次表明其保护特性可能与负调节Wnt/β-catenin通路相关。这与本研究中PLA2G7高表达在宫颈癌患者中的预后价值一致,表明PLA2G7可作为宫颈癌的预后生物标志物。
本研究发现,PLA2G7表达与宫颈癌患者不同的免疫浸润水平相关。结果表明,PLA2G7表达与CD8+T细胞、CD4+T细胞、中性粒细胞和树突状细胞存在中等强度的相关性。肿瘤纯度是由临床肿瘤样本中的表达数据计算而来,是分析免疫浸润水平的重要影响因素[20]。通过TIMER数据库,进一步探索PLA2G7表达与肿瘤纯度调整后的免疫浸润细胞基因标记物的相关性分析发现,PLA2G7的表达与多种免疫浸润细胞基因标记物之间存在显著相关性。例如,PLA2G7的表达与T细胞的基因标记物CD3D、CD3E、CD2的表达存在中等相关性,与单核细胞基因标记物CD86和CSF1R以及M2巨噬细胞基因标记物CD163和MS4A4A的表达呈强相关性。同时发现,PLA2G7的表达与辅助T细胞的基因标记物T-bet(TBX21)、STAT4、STAT1和IFN-γ(IFNG)的表达存在显著相关性,表明PLA2G7可能调节宫颈癌中辅助T细胞功能的潜在机制。此外,PLA2G7的表达与调节性T细胞和衰竭T细胞的基因标记物FOXP3、CCR8、TIM-3、PD-1、CTLA4、LAG3、TIM-3和GZMB的表达呈正向相关。其中TIM-3是衰竭T细胞上的一种关键表面蛋白[21],与宫颈癌中的PLA2G7表达高度相关。由此表明,PLA2G7具有激活调节性T细胞和诱导T细胞衰竭的潜力,提示PLA2G7在宫颈癌肿瘤免疫中发挥调节作用。
GSEA和GSVA分析了PLA2G7在宫颈癌中的生物学功能和潜在影响的信号通路,发现PLA2G7主要在炎症反应、防御反应调节、细胞膜表面、MAPK级联调控以及凋亡信号通路发挥相关功能。同时,PLA2G7的表达与细胞黏附分子CAMS、造血细胞谱系、趋化因子信号通路以及一些免疫相关通路显著相关,表明PLA2G7在宫颈癌患者中具有潜在的免疫调节作用,从而改善宫颈癌患者的生存状况。
综上所述,本研究基于多种肿瘤数据库以生物信息学方法分析发现,在宫颈癌患者中PLA2G7高表达可能是通过增强免疫细胞的募集信号通路、调节免疫浸润细胞的富集,从而改善宫颈癌患者的生存状况。后期的进一步研究主要是进行前瞻性试验验证,未来PLA2G7或可成为一个预测宫颈癌患者免疫治疗应答的生物标志物。

