喜树幼叶发育与喜树碱类化合物生物合成的相关性
董 淋 淋, 杨 秉 润, 王 燕 燕, 张 悦, 于 放
(大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
喜树碱、10-羟喜树碱是喜树中主要的次级代谢产物,因具有独特的抗肿瘤活性,而被研究人员广泛关注[1-3]。已有研究证实,在不同喜树植株叶片中CPT和10-HCPT的积累量差异较大[4],且同一器官在不同发育时期,CPT的含量差异显著[5-6]。这导致不能通过简单分析不同株系叶片中次级代谢物积累量及代谢途径关键酶基因表达量之间的规律来解析CPT和10-HCPT生物合成分子机理[7]。
CPT合成途径复杂,目前对于异胡豆苷到CPT及10-HCPT之间的代谢途径尚未解析完全[8]。尽管前期研究以及转录组数据分析发现CPT合成途径相关酶基因表达在叶片、根、茎中均有不同分布[6],然而对于同一组织的不同发育阶段的积累特性尚不清楚。
喜树叶片是CPT及10-HCPT积累的主要部位,且为生物量较大的器官。本实验采用高效液相色谱[9]和实时定量PCR分析喜树幼叶不同发育阶段(叶柄、叶基、叶片)的CPT及10-HCPT积累量与关键酶基因相对表达量之间的规律,以期为后续利用“转录-转录”以及“转录-代谢”的角度获取未知候选代谢途径酶基因、解析喜树碱的生物合成途径提供依据。
1 材料与方法
1.1 试剂与仪器
喜树,实验室种植。一株两年生喜树在25 ℃温室中以16 h光照/8 h黑暗的周期进行生长,取一片幼叶(约为成熟叶片展开面积的25%)作为实验材料,鲜重约0.1 g。
JM-250电泳仪,大连捷迈科贸有限公司;TC型基因扩增仪,杭州博日科技有限公司;LightCycler480 实时荧光定量PCR系统,罗氏诊断产品(上海)有限公司。
1.2 方 法
1.2.1 样品处理
将喜树植株幼叶(约为生长发育一周左右)按照叶柄、叶基和叶片分别剪为3个不同的部分(大小相同叶片3个重复组),分装到不同的2 mL离心管中,分别加入2颗直径2 mm的氧化锆珠,组织破碎仪破碎3 min(50 Hz),加入甲醇浸泡,13 000 r/min离心10 min,收集上清进行真空干燥(重复3次)。将提取物重新溶解于300 μL甲醇中,用0.22 μm的有机滤膜过滤后,取10 μL样品进行液相色谱分析。
1.2.2 高效液相色谱条件
液相色谱配备C18柱(250 mm×4.6 mm,5 μm)。流动相为乙腈和水,乙腈按不同体积分数梯度洗脱:0~12 min,20%~26%;12~20 min,26%~40%;20~25 min;40%~20%;25~30 min,20%;体积流量1 mL/min。通过二极管阵列检测器检测洗脱峰,CPT的检测波长为254 nm,10-HCPT的检测波长为384 nm。
1.2.3 提取喜树幼叶不同部位RNA
将收集的喜树幼叶的3个不同的部分,放置于2 mL离心管(RNase-free)内,加入2粒2 mm氧化锆和1 mL重蒸酚,组织破碎仪破碎5 min,结束后13 000 r/min、4 ℃离心30 min;将上清液转移至2 mL新离心管内,加入500 μL氯仿,混匀振荡5 min,13 000 r/min、4 ℃离心20 min;将上清液转移至新离心管内,加入等体积水饱和酚,混匀振荡5 min,13 000 r/min、4 ℃离心20 min;将上清液转移至新离心管,并加入500 μL氯仿,混匀振荡5 min,13 000 r/min、4 ℃离心20 min(重复一次);将上清液转移至新离心管内,加入0.7倍体积的异丙醇,轻轻混匀,13 000 r/min、4 ℃ 离心30 min;去除上清液,加入1 mL 75%乙醇,沉淀悬起,13 000 r/min、4 ℃离心15 min;去除上清液,真空冷冻干燥器30 s后加入适量RNase-free水溶解沉淀。
1.2.4 实时荧光定量PCR分析
将提取的RNA,分别反转录为cDNA,以CaACT3作为内参基因,将选取的6个关键酶基因(CaG8O、CaCYC1、Ca7-DLS、Ca7-DLGT、CaTDC1、CaSTR)和内参基因根据基因序列分别设计特异性引物,如表1所示。程序设定:先预变性95 ℃ 5 min,变性95 ℃ 20 s,退火50 ℃ 15 s、延伸72 ℃ 15 s(40个循环);延伸72 ℃ 10 min。所得到的Ct值利用2ΔΔCt方法计算,每个基因测3组平行,计算其平均数以及标准误差。

表1 引物序列
2 结果与讨论
2.1 喜树幼叶中不同发育部位RNA的提取
将选取的喜树幼叶分为3个不同的发育部位,用重蒸酚法分别提取RNA,电泳检测RNA质量,结果如图1所示。RNA无明显降解,且无DNA及蛋白污染。
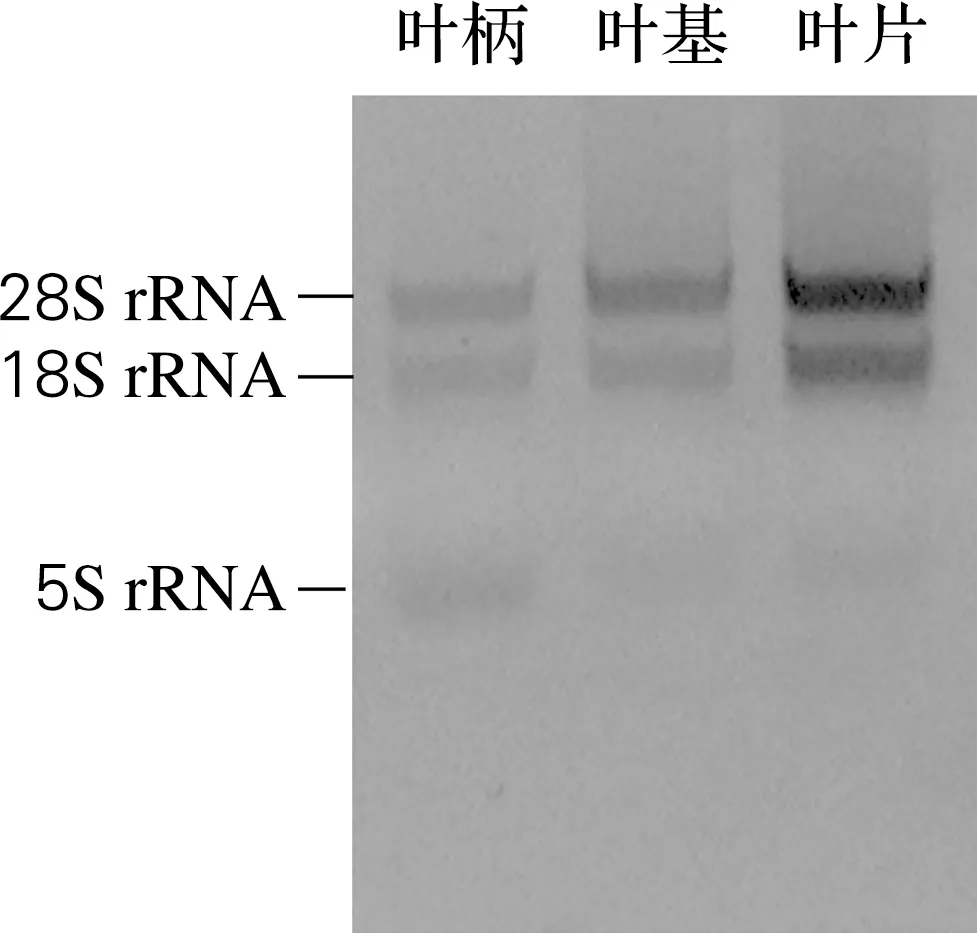
图1 喜树幼叶不同发育部位提取的RNA
2.2 喜树幼叶中不同发育部位CPT的积累量
如图2所示,在同一喜树幼叶片中CPT积累量约为叶柄中的2.5倍。表明喜树叶片中CPT含量随着发育时间增加逐渐增加。
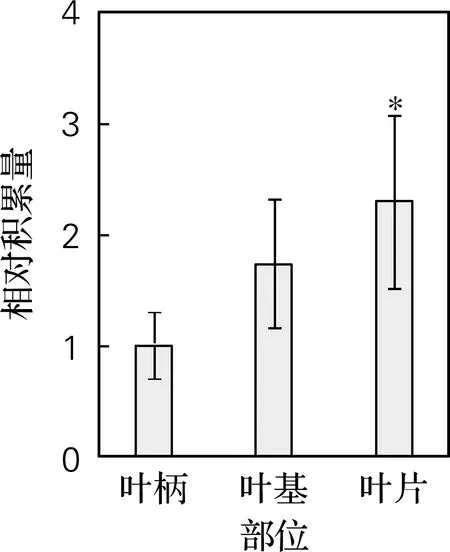
图2 喜树幼叶不同部位中CPT的积累量
2.3 喜树幼叶中不同发育部位10-HCPT的积累量
如图3所示。喜树幼叶叶片中10-HCPT的积累量最低,叶柄中10-HCPT的积累量最高,且叶柄中10-HCPT积累量约为叶片中的4.5倍。结果表明,在同一喜树幼叶中,从叶柄到叶片10-HCPT 含量逐渐下降,与CPT趋势相反。这可能是因为在喜树幼叶的叶柄中,一部分CPT转化为10-HCPT[10],导致叶柄中10-HCPT的相对积累量较多。
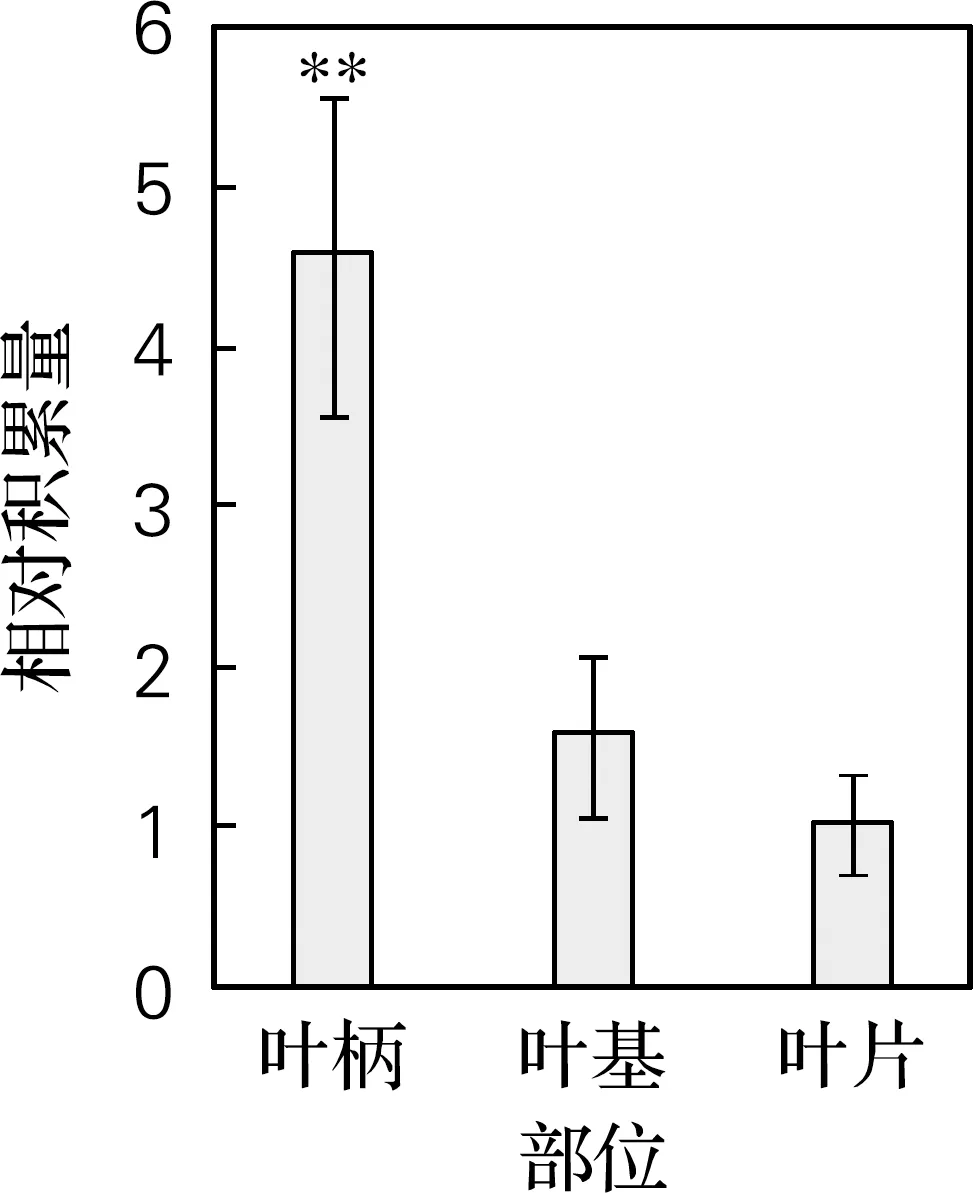
**表示与叶柄相比在P<0.01水平上极显著
2.4 喜树幼叶不同发育部位CPT代谢途径关键酶基因的表达
如图4所示,6个关键酶基因均在叶柄中表达量最高;在叶基中表达量次之。从叶柄到叶片CaG8O、Ca7-DLS、Ca7-DLGT、CaTDC1的表达量呈逐渐降低的趋势,但叶基与叶片中CaCYC1、CaSTR的表达量无明显差异。结果表明,莽草酸途径的CaTDC1与其他基因相比,受发育阶段调控影响较小,甲羟戊酸途径的CaG8O、CaCYC1、Ca7-DLS、Ca7-DLGT受发育阶段调控影响较大,尤其是Ca7-DLS、Ca7-DLGT呈现出随发育部位不同的明显变化。同时,实验发现关键酶基因不同发育部位调控趋势一致,且与10-HCPT积累一致,与CPT相反,表明叶不同发育部位中代谢途径关键酶基因具有相同的表达趋势,且与CPT的积累量负相关,但与10-HCPT的积累量呈正相关。
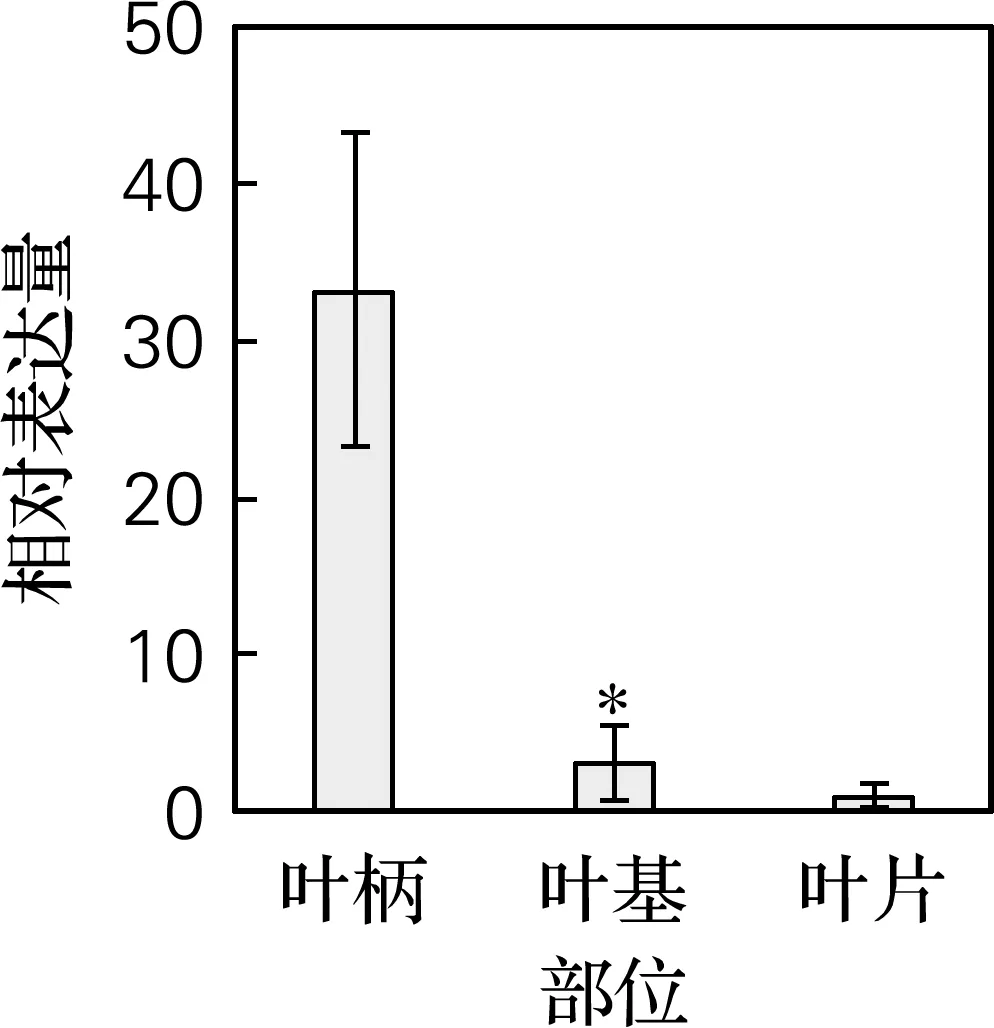
(a) CaG8O基因
3 结 论
利用高效液相以及实时荧光定量PCR分析了喜树幼叶中不同发育部位CPT、10-HCPT的积累量以及合成途径关键酶基因的表达量。结果表明,在喜树幼叶不同发育部位CPT生物合成途径关键酶基因CaG8O、CaCYC1、Ca7-DLS、Ca7-DLGT、CaTDC1以及CaSTR的表达均具有相同的表达趋势,且与各不同发育部位CPT的积累量呈负相关,与10-HCPT的积累量呈正相关。且代谢途径酶基因以及CPT和10-CPT在这些部位的表达及积累量具有很好的重现性。

