血清胰岛素样生长因子1在供精-体外受精胚胎移植黄体期长方案临床结局中的预测价值
陈潇 崔媛媛 谭颖 林盛 何毅超 张清健 宋革
1广东省生殖医院生殖医学中心(广州 510000);2广东省生殖科学研究所生殖医学中心(广州 510000);3国家卫生健康委男性生殖与遗传重点实验室(广州 510000)
血清胰岛素样生长因子1(IGF-1)是人体在生长激素(GH)影响下由肝脏主要产生的一种多肽,可以促进机体生长和细胞分化增殖[1]。在卵泡生长、胚胎发育、细胞代谢和凋亡中有重要作用[2]。早在1987年就有学者证明GH 可以增加卵巢IGF-1的分泌,从而提高促性腺激素作用。近年学者们发现GH 和IGF-1 在生殖系统发挥重要作用[3]。GH 作为改善体外受精胚胎移植(IVF)结局的辅助用药被广泛用于临床[1,4],然而其对IVF 结局的影响仍存在争议[5-8]。作为GH 发挥作用的重要介导因子,IGF-1 在血清中更稳定,可以用来反应血清GH 真实情况[1,9],而IGF-1 在不孕症中研究较少,且存在争议[10-13]。目前国内外学者针对IGF-1 的研究,主要集中在卵泡液以及在动物模型和体外培养技术中。一项来自小鼠体外模型的研究中指出,卵泡生长速度或闭锁的时间与IGF-1 的mRNA表达相关[14],敲除IGF-1 基因后,小鼠出现不孕症状[15]。临床研究者更多集中在卵泡液IGF-1 在IVF 中的价值[16-18],然而血清层面对临床应用更具有指导意义。因此,本研究就本中心实际情况,从血清角度出发,试图探索超促排卵(COH)过程中IGF-1 水平对卵巢反应和临床结局的预测价值,为IGF-1 的临床应用提供佐证。
1 资料与方法
1.1 一般资料选取2021年于我中心行供精-IVF妇女,纳入标准:年龄≤35岁;18 kg/m2≤BMI ≤25 kg/m2;AMH ≥1.1 ng/mL;BAFC ≥7 个;采用黄体中期长方案。本研究项目通过伦理委员会审核,取得受试者知情同意。
1.2 治疗方案
1.2.1 黄体中期长方案在黄体中期使用GnRH-α降调14~18 d 后达到以下标准则启动促排卵治疗:子宫内膜≤4~5 mm,血清E2<50 pg/mL(183.6 pmol/L),FSH<5 IU/L、LH<5 IU/L,无功能性囊肿。结合卵泡发育及激素情况调整促卵泡激素(Gn)用量。当1 个主导卵泡≥18 mm 或3 个主导卵泡≥17 mm 时予HCG 注射促卵泡成熟。取卵后使用供精进行常规IVF 受精。收集启动日及HCG日血清。
1.2.2 黄体支持方案取卵后予达芙通10 mg tid联合黄体酮凝胶阴道用药,冷冻周期黄体支持方法同新鲜周期。
1.3 研究指标及判断标准
1.3.1 研究指标临床结局包括促排卵结局(以获卵数为研究指标)和临床移植结局(以临床妊娠为研究指标)。临床移植结局指第1 个移植周期是否获得临床妊娠[若新鲜移植周期(ET)取消移植,则为第1 个冷冻移植周期(FET)的结局]。
1.3.2 研究指标判断标准胚胎质量评估标准:第3 天优质胚胎符合下述标准:2PN 来源,第2 天的细胞数达到4~5 细胞,第3 天的细胞数达到7~9 细胞,胚胎分级及碎片率均为1~2 级。优质囊胚标准:2PN 来源,第5 天或第6 天评分≥3 BB 的囊胚。临床妊娠确定:移植后第12~14 天查血HCG 确定是否妊娠。若妊娠则于孕6~7 周行经阴道超声检查,提示宫内见孕囊且见胎心者为临床妊娠。
1.4 分组方法
1.4.1 卵巢反应分组获卵数≥15 枚,为高反应组;4 ≤获卵数≤14 枚,为正常反应组;获卵数≤3 枚,为低反应组。
1.4.2 临床移植结局分组临床妊娠组:B 超见宫内孕囊及胎心;未孕组:HCG 阴性或生化妊娠。
1.5 IGF-1检测采用化学发光法检测血清IGF-1浓度(试剂盒生产厂商:Siemens Healthcare Diagnostics Products Limited,检测仪器:西门子MMULITE 2000XPi 全自动化学发光免疫分析仪,单位:ng/mL,灵敏度:20 ng/mL)。
1.6 统计学方法应用SPSS 22.0软件进行数据处理。计数资料以率(%)表示,比较用χ2检验;计量资料以均数±标准差表示。两样本间一般参数采用独立样本t检验;多变量关系分析采用多因素回归分析,通过构建logistic 回归分析下的ROC 曲线确定变量(IGF-1)对妊娠的预测价值。以P<0.05 为差异有统计学意义。
2 结果
2021年4-10月共纳入符合标准病例71 例,低反应组例数较少(2 例),不纳入本研究,实际纳入卵巢反应研究样本为69 例。其中,9 例截至研究截止未进行胚胎移植,实际纳入临床移植结局研究样本为60 例。
2.1 卵巢反应结果分析正常反应组和高反应组两组启动日IGF-1差异无统计学意义,但HCG日IGF-1高反应组显著低于正常反应组(P=0.025);高反应组BAFC、AMH、HCG日E2 水平显著高于正常反应组,而启动剂量显著低于正常反应组(P<0.05);两组启动日IGF-1显著高于HCG日(P<0.001)。见表1。
表1 高反应组和正常反应组比较Tab.1 The comparation of high reponse group and normol respons group±s

表1 高反应组和正常反应组比较Tab.1 The comparation of high reponse group and normol respons group±s
参数P值年龄(岁)BMI(kg/m2)BFSH(IU/L)BAFC(个)AMH(ng/mL)启动日IGF-1(ng/mL)HCG日IGF-1(ng/mL)启动剂量(IU)Gn总量(IU)HCG日E2(pmol/L)高反应组(n=27)30.7±3.73 21.0±1.49 6.02±1.00 17.9±4.28 4.84±2.15 231.7±57.55 179.0±42.82 182.4±60.37 1 827.2±651.63 17 519.7±6 548.02正常反应组(n=42)30.5±3.8 21.5±2.04 6.29±1.71 14.4±4.35 3.16±1.58 220.9±54.85 204.6±42.65 216.6±62.99 2 031.2±590.96 8 081.9±3 049.17 0.771 0.230 0.414 0.001 0.001 0.436 0.025 0.028 0.183<0.001
2.2 临床移植结局分析本研究共纳入移植周期60 例,其中新鲜周期17 例,冷冻移植周期43 例。两组冷冻移植周期占比比较差异无统计学意义(73.9%vs.70.2%,P=0.761)。新鲜周期和冷冻周期移植临床妊娠率差异无统计学意义(64.7%vs.60.5%,P=0.761)。新鲜周期移植的胚胎数及优胚数均显著高于冷冻移植周期(移植胚胎数1.41vs.1.02 个,P=0.006;移植优胚数0.88vs.0.63 个,P=0.03)。对本研究本次取卵周期一个移植周期的临床结局发现,临床妊娠组的IGF-1水平显著高于未孕组(P=0.033),而两组年龄、BMI、AMH、内膜厚度、移植胚胎个数、移植优胚个数、移植囊胚个数差异均无统计学意义(P>0.05,表2)。将内膜厚度、启动日IGF-1、移植胚胎数以及移植胚胎方式(新鲜移植或冷冻移植)纳入多因素回归分析模型发现,启动日IGF-1 是影响一个移植周期临床结局的重要因素(OR=0.987,95%CI:0.97~0.998 ,P=0.021),见表3。将启动日IGF-1 预测一个移植周期结局做ROC 分析,曲线下面积分别为0.669(P=0.029),见图1。

图1 启动日IGF-1 预测一个移植周期临床结局的ROC曲线Fig.1 Receiver operator curve(ROC)for IGF-1 to predict outcome per one transfer cycle
表2 临床妊娠组和未孕组各参数比较Tab.2 The comparation of clinical group and nonpregnant group ±s
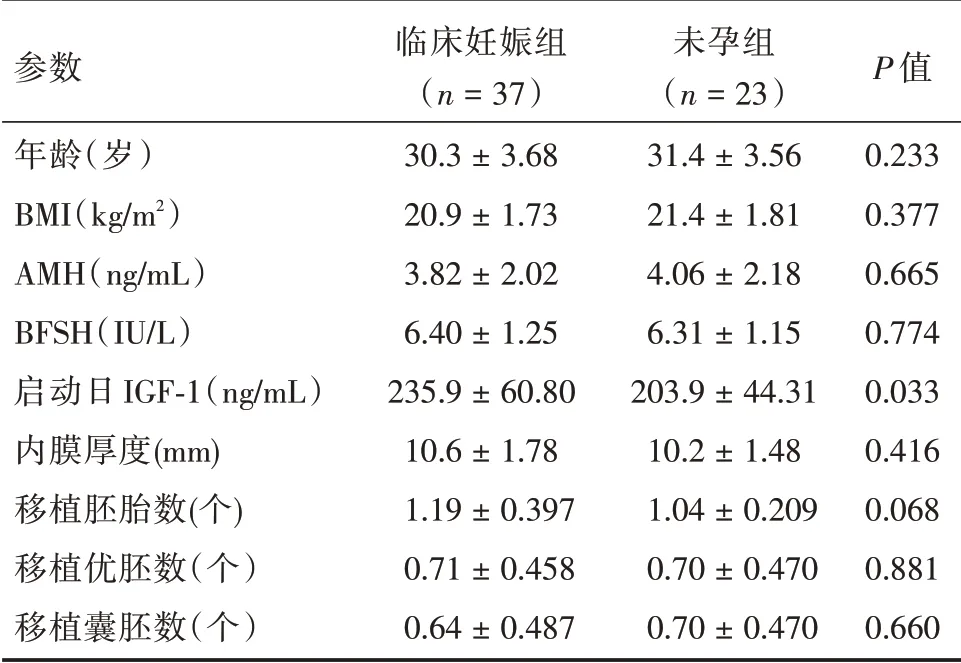
表2 临床妊娠组和未孕组各参数比较Tab.2 The comparation of clinical group and nonpregnant group ±s
参数年龄(岁)BMI(kg/m2)AMH(ng/mL)BFSH(IU/L)启动日IGF-1(ng/mL)内膜厚度(mm)移植胚胎数(个)移植优胚数(个)移植囊胚数(个)临床妊娠组(n=37)30.3±3.68 20.9±1.73 3.82±2.02 6.40±1.25 235.9±60.80 10.6±1.78 1.19±0.397 0.71±0.458 0.64±0.487未孕组(n=23)31.4±3.56 21.4±1.81 4.06±2.18 6.31±1.15 203.9±44.31 10.2±1.48 1.04±0.209 0.70±0.470 0.70±0.470 P 值0.233 0.377 0.665 0.774 0.033 0.416 0.068 0.881 0.660
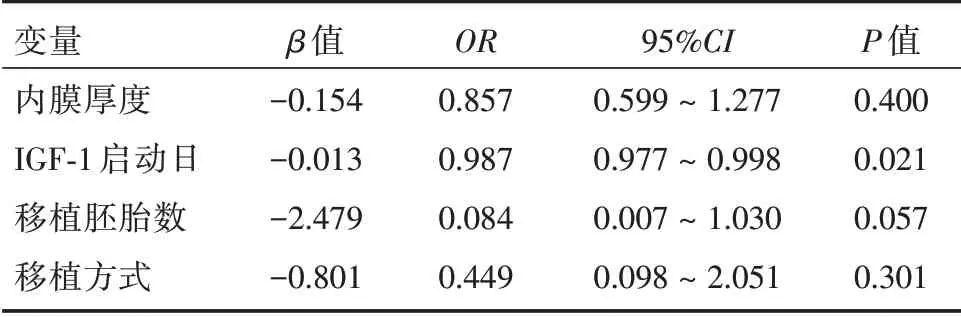
表3 临床移植结局多因素回归分析结果Tab.3 Rusult of multi-factor regression analysis for clinical outcome
3 讨论
IGF-1 是也被称为生长激素介质,是GH 产生作用过程中必须的活性蛋白质。GH 除刺激肝脏外,还能刺激外周靶器官分泌IGF-1[18]。此外,卵巢还能在类固醇激素、促性腺激素刺激下局部分泌[15]。本研究从临床实际应用出发,纳入常规评估指标(年龄、AMH、BAFC)预测为正常反应的人群,聚焦于IGF-1 的预测价值,为GH 的使用提供新的思路及参考。
本研究中高反应组启动剂量显著低于正常反应组,但两组最终Gn 总量无明显差异,这与超促排卵方案中个体化剂量控制有关。高反应组BAFC、AMH 均高于正常反应组,可见高反应组卵巢储备较正常反应组好。众所周知,卵巢储备是预测卵巢反应重要参数,卵巢储备好,获卵数高。两组启动日IGF-1 无明显差异,多因素回归分析也发现,启动日IGF-1 与获卵数无明显相关性,因此,启动日IGF-1 不能作为预测卵巢反应的指标。NASIOUDIS 等[19]针对IGF-1 与获卵数关系的研究指出,采用常规促排卵方案时,在获卵数≤2 的患者组的IGF-1 水平显著低于获卵数正常组,这可能反映当卵巢储备不足时会引起内分泌反应增强。这一差异可能与研究群体差异及垂体降调节方案有关。KEAY 等[20]也认为经过垂体降调节后,血IGF-1 水平不能预测卵巢反应,且在低反应和正常反应组中没有差异。此外,本研究中在HCG日IGF-1显著低于启动日。生理状态下下丘脑-垂体-卵巢轴(H-P-O 轴)在卵泡发育过程中存在负反馈,同样,生长轴(垂体-GH-IGF-1 轴)也存在负反馈。早期的动物模型中就发现当给动物脑室注射IGF-1后能抑制垂体生长激素mRNA 表达,而人静滴IGF-1 后会引起GH 分泌减少。笔者推测生长轴和H-P-O 轴存在交叉反馈作用,当人体多卵泡发育,体内雌激素增高时,对垂体的负反馈调节使得生长轴也受到抑制作用,从而使HCG日血清IGF-1较早卵泡期更低。这一推测尚需更多的基础研究确证。HARTMAN 等[21]对PCOS 人群的研究与本研究结果不尽相同,他们发现在COH 中,IGF-1 呈总体上升趋势,而在IGF-1 下降的组别未成熟卵比例较高。本研究中,两组平均成熟卵率均达85%以上,这可能是造成结果差异的原因之一。由于研究群体及方法差异,IGF-1 对卵巢反应的预测价值尚难以统一。
进一步对本研究取卵周期1 个移植周期进行分析发现,获得临床妊娠组在启动日的IGF-1 水平显著高于未孕组,而年龄、BMI、内膜厚度、移植胚胎数、移植囊胚数、移植优胚数均无明显差异。影响临床结局因素很多,包括子宫内膜因素、移植胚胎数量及质量、移植胚胎时间等等,进一步对影响临床结局的因素进行多因素回归分析,将内膜厚度、移植胚胎数、移植方式和启动日IGF-1 纳入模型分析发现,移植胚胎数及启动日IGF-1 与临床结局显著相关。事实上,本研究数据中新鲜及冷冻周期妊娠率及临床妊娠组和未孕组在新鲜周期移植占比均差异无统计学意义。行ROC曲线分析启动日IGF-1 预测临床结局,说明启动日IGF-1 对临床移植结局有预测价值。根据启动日IGF-1 对临床移植结局的研究,我们认为在常规IVF 方案中,血清IGF-1 更多与卵子质量相关。临床妊娠组启动日IGF-1 较未孕组高,可能与IGF-1 介导的卵母细胞质量及胚胎质量有关。国内外学者的研究也支持这一结果,一项关于卵泡液中IGF-1 的研究指出,妊娠组卵泡液中IGF-1 水平、受精率、囊胚形成率均高于未孕组;且卵泡液IGF-1 与胚胎质量及临床妊娠率均相关(r分别为0.389和0.597)[17]。在小鼠的卵母细胞体外培养中发现,当在培养基中添加IGF-1 时,卵母细胞成熟率、受精率、两细胞及囊胚率均增高[22]。对人卵母细胞的培养也得出类似结论,IGF-1 可提高卵母细胞成熟率和质量,并提高早期胚胎及囊胚形成率[23]。RAMER 等[10]的一项回顾性分析也得出类似结论,获得活产的人群基础血IGF-1 浓度高于其他人群,并且IGF-1 联合IGFBP3 可以作为预测是否得到活产的指标。在现有的国内外研究中,在周期开始前预测临床结局的指标有限,IGF-1 不仅能预测临床结局,还能通过外源性添加GH 提高体内浓度,在未来用于指导改善临床结局有重要研究价值。
IGF-1 作为人体重要调节因子,在人类生殖及胚胎发育中不可或缺。本研究首次纳入供精群体,最大程度排除男方因素的影响,对血清标本的研究更具有临床实用性。由于研究群体的局限性,以及样本量少,无法对相关因素进行亚组分析。这是本研究存在的主要缺陷与不足,还需要扩大样本量和研究群体进行亚组分析来进一步确证研究结果。
本研究中,对于供精IVF 妇女采用黄体期长方案时,启动日IGF-1 水平不能作为正常人群卵巢反应的预测指标。但启动日IGF-1 水平对一个移植周期的临床结局有一定预测价值。下一步需要扩大研究群体及样本数量,增加添加GH 的研究群体进行RCT 研究。

