水热-硝酸氧化合成发蓝光和绿光木质素基碳点的研究
王 颖, 安 邦,徐明聪,岳金权,刘守新,李 伟
(东北林业大学 材料科学与工程学院;生物质材料科学与技术教育部重点实验室,黑龙江 哈尔滨 150040)
碳量子点(CQDs)作为一种新型的碳基纳米材料,由于其具有光致发光、稳定性、低毒性、生物相容性和低成本等优点,在过去的10年里,在分析物检测、发光器件和医学细胞成像等领域得到了广泛的应用。有机小分子通常被认为是合成高质量CQDs的可靠前体,因此大多数领域所用的CQDs主要由有机小分子合成[1]。然而,大多数有机小分子成本高且具有毒性,不利于人类健康和环境保护。因此,使用绿色的方法从相对便宜且储量丰富的前体中合成CQDs已经成为当前研究的热点。木质素作为世界上含量第二丰富的天然高分子有机物质[2],多数以副产品的形式存在于制浆工业中[3],没有得到充分利用,从而造成资源的浪费。从可持续发展角度看,木质素具有高碳含量、丰富的官能团支链和芳香骨架结构,在CQDs合成过程中,可以为共轭石墨核的形成和表面官能化提供有利条件,是制备CQDs的理想原料[4-6]。因此,本研究以木质素为碳源,间苯二胺为氮源,通过一步水热法合成了优质的蓝色发光CQDs(B-CQDs),通过在水热过程中引入硝酸,合成了绿色发光CQDs(G-CQDs),并对两种CQDs的光学性质、结构特征和细胞成像进行了分析,以期制备具有优异光致发光、稳定的荧光和低毒性的CQDs,从而应用于体外生物成像领域。
1 实 验
1.1 原料、试剂与仪器
木质素和间苯二胺,中国上海阿拉丁有限公司。HeLa细胞,海南丰晖生物科技有限公司;胎牛血清(FBS)、DMEM高糖培养基、四甲基偶氮唑盐(MTT)和磷酸盐缓冲溶液,中国北京日光生物科技有限公司。除特殊说明外,上述所有试剂均为市售分析纯,可直接使用。
TU-1950紫外光谱仪,中国北京普析有限公司;Cary Eclipse荧光光谱仪,美国安捷伦有限公司;JEM-2100透射电子显微镜(TEM),日本东京JEOL有限公司;TV 1900傅里叶变换红外光谱(FT-IR)仪,美国Perkin Elmer公司;Escalab 250 Xi型X射线光电子能谱(XPS)仪,中国上海赛默飞世尔科技有限公司;LSM 900激光共聚焦荧光显微镜,北京普瑞赛有限公司。
1.2 CQDs的合成
制备CQDs的方法参考文献报道[3],具体操作如下:称取0.1 g木质素、0.2 g间苯二胺和0.2 g硝酸于50 mL聚四氟乙烯反应釜中,加入15 mL蒸馏水,搅拌均匀,220 ℃加热10 h。反应溶液以12 000 r/min离心15 min以除去固体沉淀,在蒸馏水中透析48 h,60 ℃烘干得到绿色发光CQDs(G-CQDs)粉末。对于蓝色发光CQDs(B-CQDs),称取0.1 g木质素和0.2 g间苯二胺,不添加硝酸,其他制备方法同上,制得B-CQDs粉末。
1.3 分析与表征
采用TU-1950紫外光谱仪获得CQDs的紫外吸收光谱;采用荧光光谱仪获得CQDs的荧光光谱;采用JEM-2100透射电子显微镜(TEM)分析CQDs的微观形貌;采用傅里叶变换红外光谱(FT-IR)仪分析CQDs的表面官能团;采用Escalab 250 Xi型X射线光电子能谱仪(XPS)分析CQDs的元素组成。
1.4 细胞毒性测试及细胞成像
用含10%胎牛血清(FBS)的DMEM培养基将HeLa细胞在5% CO2和37 ℃下培养至对数生长期,以5×104个/mL的细胞密度接种于96孔培养板中。弃培养基,向培养板各孔中加入含不同质量浓度(10、25和50 mg/L)碳点药物的DMEM培养基200 μL,放入培养箱培养24 h。向每孔加入20 μL 5 g/L的MTT溶液,继续孵育4 h。去除MTT培养液,加入150 μL二甲基亚砜,将所得混合物室温振荡15 min后,使用全自动酶联免疫吸附分析(ELISA)仪在490 nm处测量MTT的吸光度。重复3次,取平均值。
将HeLa细胞接种到含有10% FBS的DMEM培养基中,在5% CO2和37 ℃下培养24 h。然后,去除DMEM培养基,将HeLa细胞在含有50 mg/L G-CQDs的DMEM培养基中再培养4 h。弃掉培养基,用磷酸盐缓冲液清洗HeLa细胞4次,以去除细胞表面的G-CQDs。之后,分散在4%的多聚甲醛中,用激光共聚焦荧光显微镜观察HeLa细胞。
2 结果与讨论
2.1 CQDs的光学性质分析


图1 溶液在阳光(a,c)和365 nm紫外灯(b,d)下的照片

图2 B-CQDs(a)和G-CQDs(b)的UV-vis吸收光谱、激发波长(Ex)和发射波长(Em)
不同激发波长下B-CQDs和G-CQDs的荧光发射光谱见图3。

图3 不同激发波长下B-CQDs(a)和G-CQDs(b)的荧光发射光谱
由图3(a)可以很明显地观察到,B-CQDs的荧光发射波长随着激发波长的增加而红移,表现出与激发相关的发射行为,这可能是由其丰富的表面状态引起的[9];而G-CQDs的荧光发射波长随着激发波长的增加并没有发生位移,表现出与激发无关的发射行为。以上结果表明:G-CQDs发光的起源与 B-CQDs 发光的起源明显不同[1]。这可能是由于硝酸的引入改变了CQDs的石墨化程度,钝化了CQDs的表面状态,从而使其与激发相关的蓝色荧光红移到与激发无关的绿色荧光。由此可见,硝酸在G-CQDs形成过程中起着重要的作用。
2.2 CQDs的结构特征分析
2.2.1TEM分析 为了进一步研究硝酸在G-CQDs 制备过程中起的作用,对两种CQDs的结构特征进行研究。图4为B-CQDs和G-CQDs的TEM照片。由图可知:两种CQDs在水中是均匀分散的。表1为CQDs的粒径尺寸分布。由数据可知,B-CQDs和G-CQDs尺寸分布分别为1~3和1.5~4 nm,平均粒径分别为1.3和2.5 nm。结合TEM结果分析表明:随着CQDs荧光发射红移,粒径尺寸增大,这可能是在G-CQDs合成过程中硝酸加深了石墨核的石墨化程度。

图4 B-CQDs(a)和G-CQDs(b)的TEM照片

表1 CQDs的粒径尺寸分布


图5 B-CQDs和G-CQDs的FT-IR(a)和XPS(b)光谱

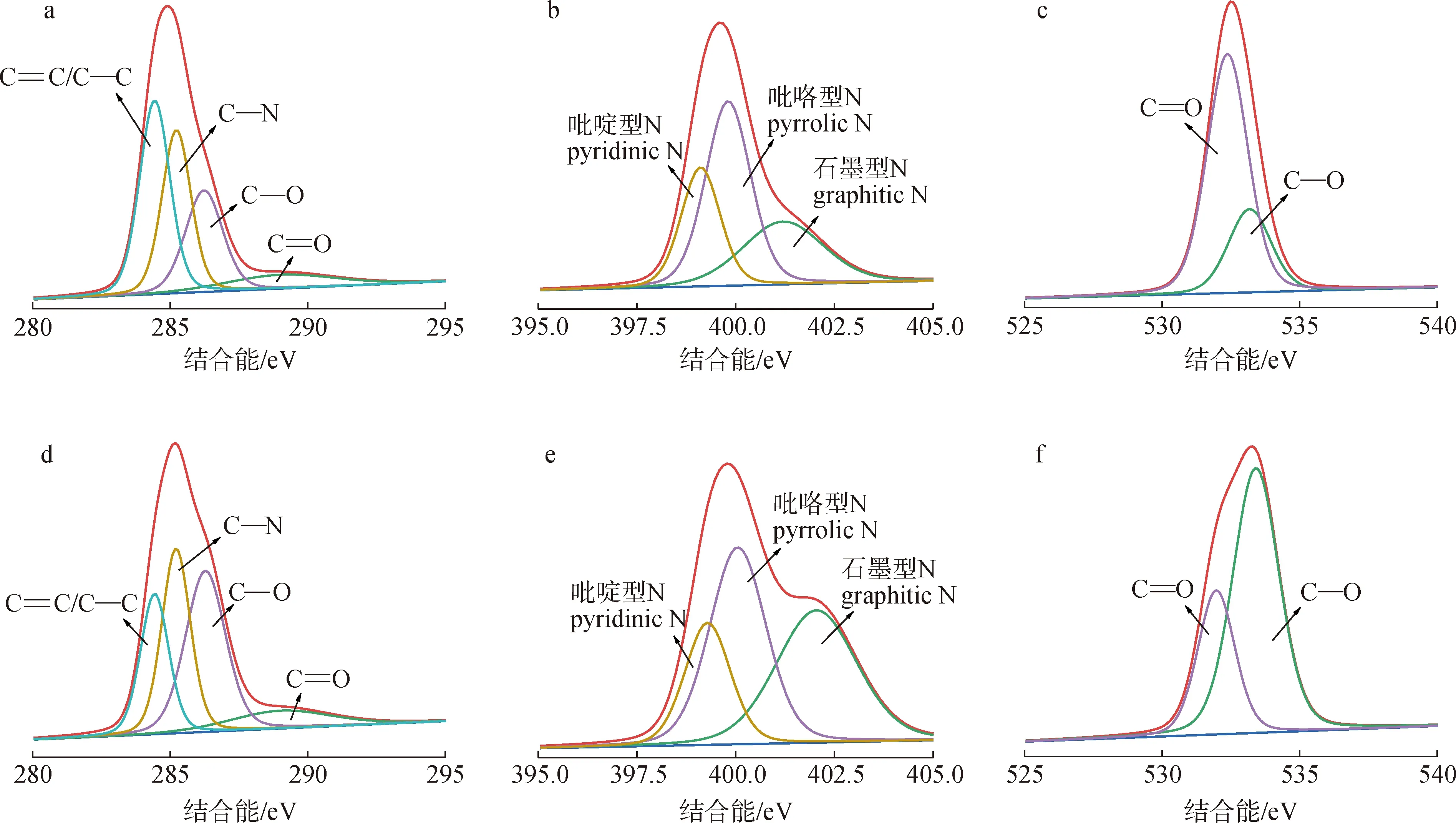
B-CQDs:a.C1s; b.N1s; c.O1s
根据文献报道[11-12],荧光的红移总是归因于表面氧化程度的加深和石墨化程度的增加。通过XPS计算得到CQDs的元素含量和原子比,结果见表2。

表2 XPS光谱中CQDs的元素含量和原子比


表3 CQDs的C1s、N1s和O1s光谱的XPS数据分析
2.3 G-CQDs的可能发射机制
CQDs荧光发射机制主要有2种:一种是基于共轭π-域的带隙荧光发射,另一种是与CQDs表面缺陷有关的表面缺陷发射[13-15]。带隙荧光发射受量子尺寸效应的影响,而表面缺陷发射与表面氧化程度相关。TEM结果表明随着荧光红移CQDs的尺寸增大,这可能是由于石墨核石墨化程度加深引起的。FT-IR和XPS分析结果表明CQDs的荧光红移与表面氧化程度无关,是石墨N含量增加引起的。上述分析结果都表明本研究中G-CQDs发射机制可能属于带隙荧光发射。为了更进一步确定G-CQDs的荧光发射机制,对其pH荧光发射行为进行研究,结果见图7。由图可知,G-CQDs的绿光发射强度在酸性环境中先增加后降低,在碱性环境中不断衰减,这可能是因为质子化-去质子化引起了表面电荷的变化。然而,荧光峰的位置并没有发生移动,这与其他石墨核引起荧光波长变化的CQDs的性能相似[14,16]。因此,不同pH环境中荧光发射光谱进一步说明G-CQDs发射机制可能属于带隙荧光发射。

图7 G-CQDs的pH荧光发射光谱
2.4 细胞毒性测试及细胞成像
G-CQDs具有独特的荧光特性,有望用作HeLa细胞的多色细胞成像探针。在将G-CQDs用作生物成像的探针之前,将G-CQDs水溶液放在500 W的紫外灯(365 nm)下照射1 h测试其发光稳定性,1 h后G-CQDs的荧光强度几乎没有变化(荧光强度比值维持在89.5%以上),表明G-CQDs具有良好的发光稳定性。然后,用HeLa细胞进行标准的MTT检测,结果显示:当G-CQDs质量浓度为10、25和50 mg/L 时,细胞存活率分别为95%、91%和82%,可以看出,当G-CQDs质量浓度为50 mg/L时细胞存活率为80%以上,证实本研究制备的G-CQDs具有较低的细胞毒性和良好的生物相容性,可以用作细胞成像探针。不同激发波长下的G-CQDs的共聚焦荧光图像见图8。
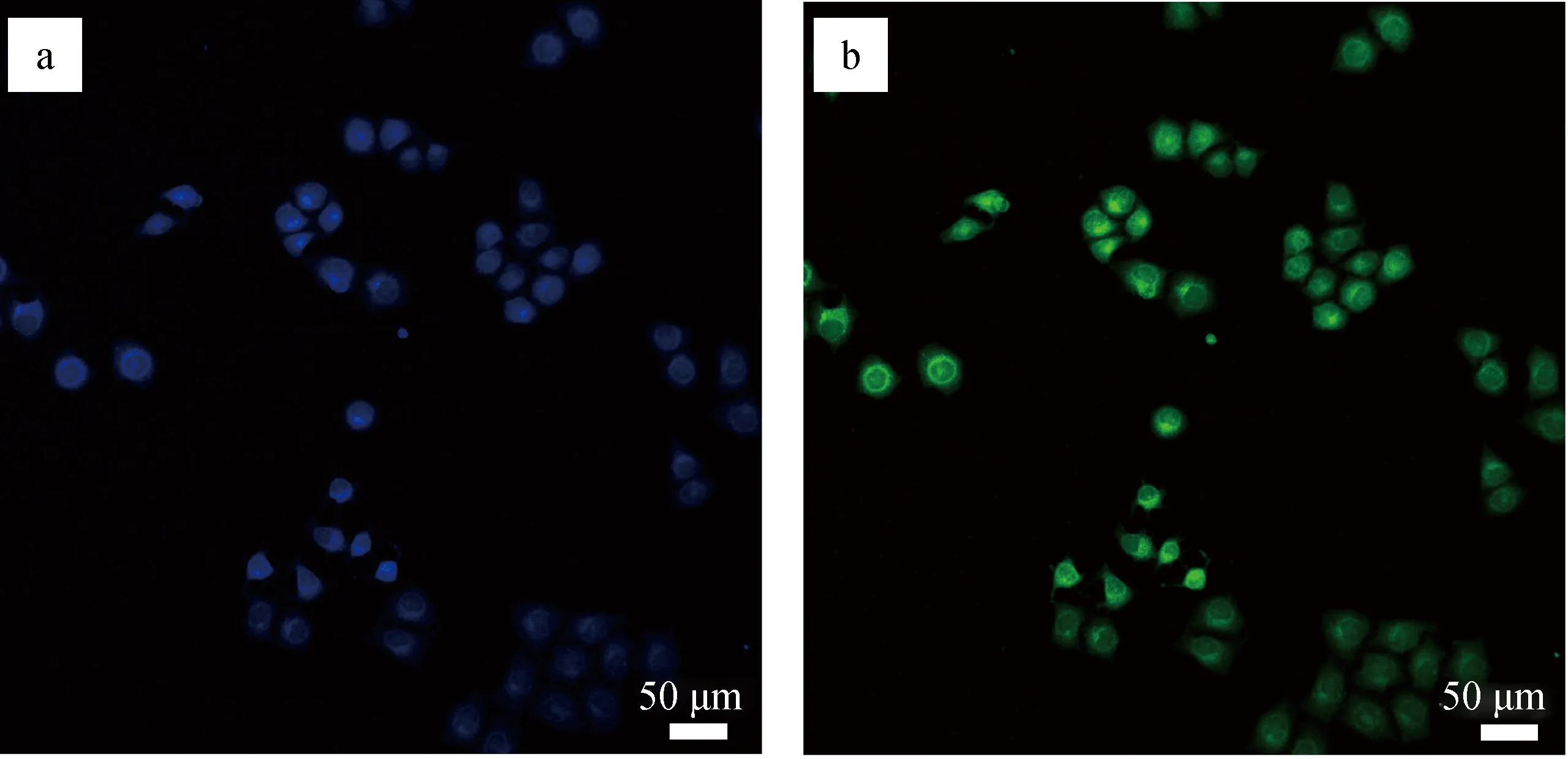
a.365~430 nm; b.446~500 nm
由图8可知,HeLa细胞在50 mg/L的G-CQDs溶液中孵育4 h后,在365~430 和446~500 nm激发波长下分别发出强烈的蓝、绿荧光,并且细胞可以保持良好的形态,表明G-CQDs可以很容易通过内吞作用进入细胞中。因此,G-CQDs具有较低的细胞毒性、良好的生物相容性以及细胞成像性能,可以作为生物成像的探针。
3 结 论
3.1以木质素为原料,间苯二胺为氮源,通过简单的一步水热法合成了优异的荧光N掺杂蓝色发光碳量子点(B-CQDs);引入硝酸,通过氧化作用制备了优质的绿色发光碳量子点(G-CQDs)。通过紫外吸收光谱、荧光光谱、TEM、FT-IR和XPS对两种CQDs的光学性质和结构特征进行了表征分析。结果表明:硝酸的加入使CQDs的石墨N含量增加,石墨化程度加深,表面状态被钝化,荧光发射波长红移。
3.2对两种CQDs的结构性质分析表明:B-CQDs和G-CQDs表面都具有丰富的亲水基团,如—OH(3 470 cm-1),—NH(3 200 cm-1),C—O(1 216~1 300 cm-1)和—COOH(1 735 cm-1),在水中是均匀分散的,平均粒径分别为1.3和2.5 nm。
3.3对两种CQDs的光学性质分析结果表明:B-CQDs表现出蓝色发光,激发波长和发射波长分别为392和488 nm;G-CQDs表现出绿色发光,激发波长和发射波长分别为446和514 nm。B-CQDs和G-CQDs 分别表现出激发相关的发射行为和激发无关的发射行为,研究还发现G-CQDs的可能发射机制属于基于共轭π-域的带隙荧光发射。
3.4G-CQDs由于具有稳定的荧光、良好的水溶性和低毒性,同时具有良好的细胞成像,因此具备应用于体外生物成像探针的潜力。

