Cu-SAPO-44选择性催化丙烯还原NO性能研究
张 恒 ,周 皞 ,温妮妮 ,王旭瑞 ,徐 璐 ,苏亚欣,*
(1.东华大学 环境科学与工程学院, 上海 201620;2.常州工程职业技术学院, 江苏 常州 213164)
随着工业和交通运输业的发展,氮氧化物(NOx)的排放引发了一系列环境问题,严重影响着大气环境质量和人类身体健康。由于移动源和固定源所产生含氮氧化物的排放气成分存在差异,对应的脱硝策略大相径庭。在柴油车尾气脱硝中,相对于目前应用广泛的氨选择性催化还原NOx(NH3-SCR),烃类选择性催化还原NOx(HC-SCR)可以同时消除尾气中的氮氧化物和烃类(HC),具有潜在的应用前景,因此,受到了研究者的广泛关注[1-3]。
由 于 以V2O5-MoO3/TiO2和 V2O5-WO3/TiO2为代表的传统钒基催化剂(V2O5)存在有毒、反应温度范围窄等问题,开发环境友好型脱硝催化剂一直是研究的热点。近年来,负载金属(Cu、Fe、Mn等)分子筛类催化剂受到人们的关注,其中,负载Cu作为活性金属的分子筛催化剂广泛应用于SCR脱硝研究,例如,Cu-ZSM-5[4]、Cu/Beta[5]、Cu/LTA[6]、Cu-SSZ-13[7,8]、Cu-SAPO-34[9,10]。相比于Beta、ZSM-5等中、大孔分子筛,以SSZ-13和SAPO-34为代表的CHA结构小孔分子筛被发现具有更为优良的高温水热稳定性[11-13],因此,受到了世界各国研究者的高度重视。Kwak等[7]发现与Cu-Beta和Cu-ZSM-5分子筛相比,Cu-SSZ-13分子筛在NH3-SCR中具有更高的活性和N2选择性。由于合成SSZ-13的结构导向剂(N,N,N-三甲基-1-金刚烷碘化铵)价格昂贵且有毒性,Ren等[14]以Cu-TEPA(TEPA 为四乙烯五铵)作为廉价结构导向剂直接将Cu物种引入SSZ-13分子筛,一步水热合成了NH3-SCR性能优异的Cu-SSZ-13分子筛。在此之后,Martinez-franco等[15]采用Cu-TEPA成功合成Cu-SAPO-34分子筛催化剂用于脱硝反应。
作为SAPOs的微孔分子筛成员,SAPO-44分子筛同样具有CHA结构,具有良好的高温水热稳定性能。Hocevar等[16-18]发现,SAPO-44在固体酸催化中表现出优异的活性。Xin等[19]率先报道了采用一步水热合成Cu-SAPO-44催化剂用于NH3-SCR,在较宽的温度窗口(180-550 ℃)具有90%以上的脱硝效率和100%的N2选择性。相比于SSZ-13分子筛孔道(0.38 nm左右),SAPO-44分子筛有更大的孔道(0.43 nm左右),与C3H6分子尺寸较为接近[20,21],因此,将其用于C3H6-SCR研究有一定的可行性。然而,将SAPO-44分子筛用于HC-SCR研究,目前,这方面的研究报道极少。
基于以上考虑,本研究以环己胺(CHA)和铜胺络合物(Cu-TEPA)为结构导向剂和铜源,Cu-TEPA既作为模板剂又提供活性铜物种,一步水热合成Cu-SAPO-44分子筛催化剂,用于柴油发动机贫燃条件下选择性催化C3H6还原NO。同时,研究Cu-TEPA的引入量对Cu-SAPO-44分子筛催化剂的物理化学性质和C3H6-SCR脱硝性能的影响。
1 实验部分
1.1 实验试剂
实验过程中使用的试剂在表1中列出。

表1 实验过程中使用的试剂Table 1 Reagents are used during the experiment
1.2 催化剂的制备
采用一步水热合成法制备铜含量不同的Cu-SAPO-44分子筛样品,CuSO4溶液与四乙烯五胺(TEPA)1∶1络合形成铜胺络合物引入铜物种,通过控制初始溶胶中Cu投入的物质的量比来控制分子筛中Cu的含量。具体步骤如下,称取不同质量的五水硫酸铜,溶于对应体积的蒸馏水,配制20%的硫酸铜溶液,分别加入对应摩尔量的TEPA,然后依次加入磷酸、拟薄水铝石、硅溶胶、环己胺,期间不断搅拌持续12 h,最终混合溶胶的投料中Cu-TEPA∶P2O5∶Al2O3∶SiO2∶CHA∶H2O理论物质的量比为x∶1.25∶1∶0.75∶2.5∶50 (x=0.05、0.15、0.25、0.35、0.45)。然后将获得的溶胶转入水热合成反应釜中,在恒温200 ℃晶化96 h,再经过数次洗涤后干燥获得初产物,在550 ℃下焙烧获得所需催化剂样品。采用同样的方法,以环己胺为结构导向剂合成纯SAPO-44。为方便叙述,将不同铜摩尔量的催化剂样品表式为Cux-SAPO-44(x=0.05、0.15、0.25、0.35、0.45)。表2中展示了Cu-SAPO-44系列催化剂各种元素的成分,由表2可以看出,随着Cu-TEPA引入量的增加,合成的Cu-SAPO-44样品中Cu元素含量在一定范围内按比例增加,Cu0.45-SAPO-44拥有最高的铜含量。同时发现,Al元素和P元素有轻微的下降,而Si元素的含量在随着Cu/Al的增加而增加。

表2 Cu-SAPO-44系列催化剂各种元素的成分Table 2 Content of each component of series Cu-SAPO-44 catalysts
1.3 催化剂的活性测试
Cu-SAPO-44的C3H6-SCR活性测试在连接红外光谱仪(Thermo IS10,配备200 mL气体池)的微型脱硝评价反应装置上进行,如图1所示。将压片过筛(40-60目)后的催化剂固定在石英管中间,在300 ℃氮气氛围下预处理1 h,然后通入混合后的100 mL/min气体在100-550 ℃下进行活性测试,测试的空速(GHSV)为15000 mL/(g·h)。经过催化剂样品的混合气体成分为NO 0.05%、C3H60.05%、O210%、H2O 5%、N2平衡,气体成分含量通过质量流量计和电磁阀配合精密控制。反应后的气体成分通过FT-IR红外光谱仪测定。催化剂的C3H6-SCR脱硝性能表达通过如下公式进行计算:


图1 Cu-SAPO-44催化剂C3H6-SCR活性测试反应示意图Figure 1 Reaction diagram of catalyst C3H6-SCR test
1.4 催化剂的表征
采用Agilent ICP-OES 720ES电感耦合等离子体质谱仪测定催化剂样品中Cu、Al、Si、P的元素含量(表1),等离子气流量15.0 L/min、辅助气流量1.50 L/min、雾化器压力240 kPa、RF功率为1.20 kW。
采用美国康塔公司的Autosorb-iQ2-MP型全自动比表面积和孔径分析仪测定催化剂样品的织物特性并得到N2吸附-脱附曲线和孔径分布,同时可以得到催化剂的比表面积、孔容和平均孔径。
采用场发射透射电子显微镜FEI Talos F200X对催化剂样品进行形貌分析、结构分析、成分分析,最大放大倍数110万倍、加速电压200 kV、相机长度520 nm、点分辨率0.25 nm、X射线能谱仪元素分析范围B5-U92、使用非铜网制样。
采用AutoChem Ⅱ 2920型化学吸附仪,通过氨气程序升温脱附实验(NH3-TPD)测定催化剂的酸性。样品在550 ℃下He:(30 mL/min)吹扫1 h后冷却至120 ℃,然后在10%NH3/He下吸附30 min。以升温速率10 ℃/min从室温升至750 ℃,脱附的NH3含量由TCD热导池检测器测定。
采用紫外可见近红外光谱仪(UV3600)获得催化剂的紫外可见光光谱(UV-vis),测式模式为吸光度,波长250-1000 nm。
采用AutoChem Ⅱ 2920型化学吸附仪,通过H2程序升温还原进行催化剂的还原性能测定。样品在550 ℃下He (30 mL/min)预处理30 min后降温至30 ℃,用He吹扫至基线平稳,在10%H2/Ar气体氛围下,以10 ℃/min的升温速率至700 ℃进行还原过程,通过TCD热导池检测器记录信号值。
2 结果与讨论
2.1 XRD表征
对不同Cu/Al的催化剂进行XRD测试分析,结果展示在图2中。从图2中可以发现,所有制备的催化剂都出现了符合SAPO-44(PDF#47-0630)的典型特征衍射峰[22],表明合成的催化剂为具有CHA拓扑结构的Cu-SAPO-44分子筛。随着Cu/Al增加,Cu-SAPO-44谱图中的101晶面衍射峰(2θ=9.5°)向低角度出现偏移,这可能是由于Cu离子进入到SAPO-44的孔道结构而导致的晶格膨胀[23]。Andonova等[24]同样发现Fe离子进入到SAPO-34沸石中而导致分子筛单元胞尺寸的扩大和结晶度的降低。同时,在XRD谱图中(Cu0.05-SAPO-44除外)在2θ=35.6°和38.8°处发现了归属于CuO的特征衍射峰,表明催化剂样品表面出现了氧化铜物种。随着Cu/Al的增加,CuO的衍射峰强度逐渐增强,说明CuO结晶度有所增强,排列趋于规则。而Cu含量最低的Cu0.05-SAPO-44催化剂没有出现明显的CuO衍射峰,可能是生成的CuO低于XRD的检测限值或高度分散在分子筛表面。XRD表征结果说明,一步水热合成的Cu-SAPO-44分子筛上铜物种可能以孤立的铜离子的形式存在于SAPO-44的孔道中,同时在分子筛表面有少量氧化铜颗粒生成。值得注意的是,随着Cu-TEPA的增加,属于SAPO-44的特征峰强度先增强后减弱,说明引入铜胺络合物后,TEPA对SAPO-44沸石分子筛的结晶生长有一定促进作用。然而,当铜胺络合物引入量过大时,会造成铜含量过大,在分子筛表面形成CuO晶粒堆积,可能会对沸石的结晶起到阻碍作用。
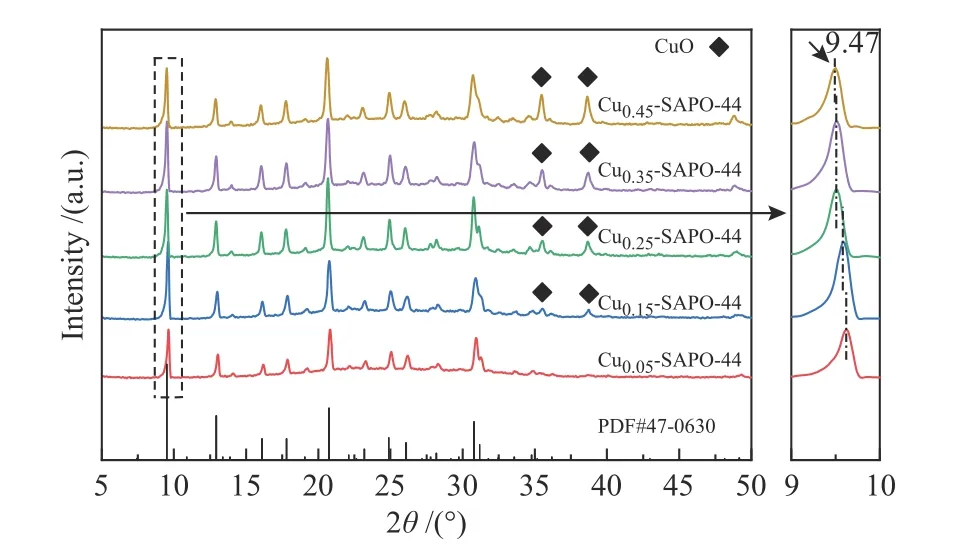
图2 不同Cu含量的Cu-SAPO-44催化剂的XRD谱图Figure 2 XRD patterns of Cu-SAPO-44 catalyst samples with different Cu content and PDF cards of SAPO-44
2.2 N2吸附-脱附表征
Cu-SAPO-44分子筛催化剂的N2吸附-脱附曲线及孔径分布如图3所示。从图3(a)中可以看出,各样品曲线都出现了稳定的吸附脱附平台,符合第一类等温吸附曲线(IUPAC分类),说明制备的分子筛催化剂具备良好的微孔结构。另外,在Cu0.05-SAOP-44催化剂中出现了回滞环,可能是由沸石晶体堆积形成的不规则狭缝所导致[25]。从图3(b)中可以看出,Cu-SAPO-44分子筛催化剂孔径尺寸主要分布在1.5 nm附近。随着Cu/Al的增加(表2),催化剂的比表面积SBET呈现出先增大后减小的趋势(表3)。当Cu/Al从0.05增加到0.25,比表面积从394 m2/g增加至488 m2/g,这可能是随着TEPA的增加,沸石的结晶程度变得更高,与XRD中对应的衍射峰强度变化相符合。然而,随着Cu/Al的继续增加,分子筛合成时引入了更多的铜物种,在分子筛表面聚集生成CuO,从而导致沸石孔道部分堵塞,进而造成比表面积降低。

表3 Cu-SAPO-44系列催化剂的孔隙结构Table 3 Texture properties of series Cu-SAPO-34 catalysts
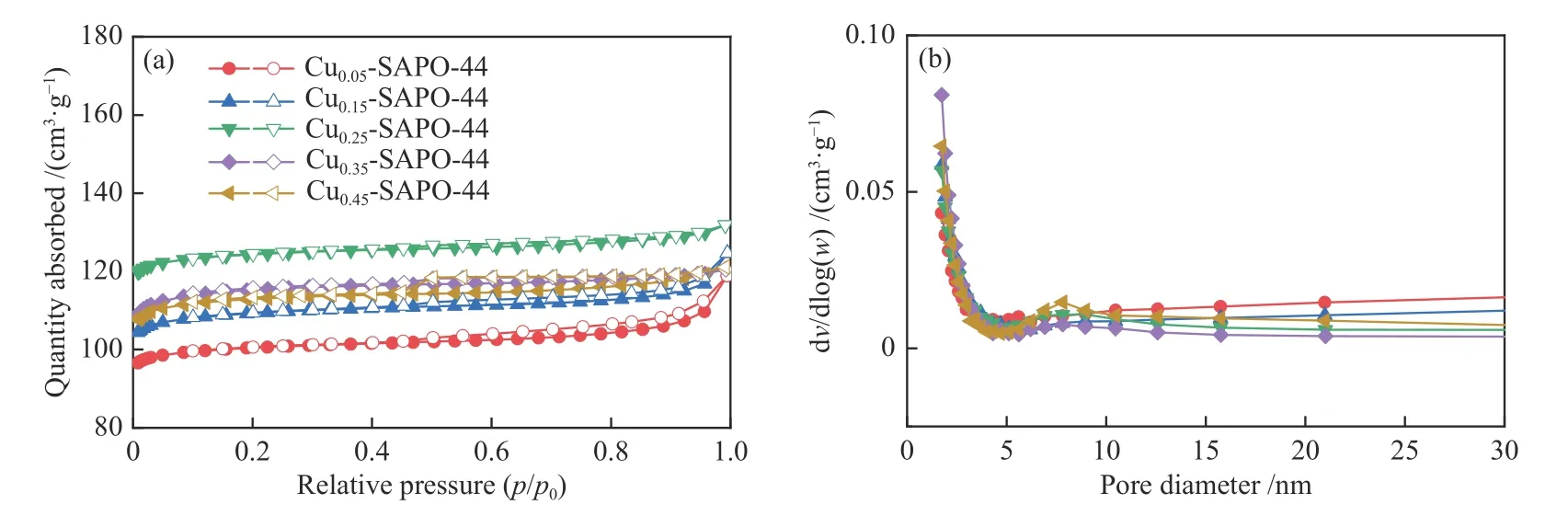
图3 不同Cu含量的Cu-SAPO-44催化剂N2吸附-脱附等温曲线(a)和孔径分布(b)Figure 3 N2 adsorption-desorption isotherm (a) and pore size distribution curves (b) of Cu-SAPO-44 catalyst samples with different Cu contents
2.3 结构形貌及元素分布
图4中展示了Cu0.25-SAPO-44催化剂的结构形貌图像(图4(a))和元素能谱分布(图4(b))。在图4(a)的透射电镜照片(TEM)和高分辨率透射电镜(HR-TEM)发现,合成的Cu0.25-SAPO-44样品呈现出良好的晶体结构,没有发现明显的团聚物。在元素能谱分布中,发现Cu元素均匀分布,而P元素与Al元素分布则更加密集,这与元素分析ICP结果(表1)相符合。结合XRD和N2吸附-脱附的测试结果,Cu0.25-SAPO-44分子筛中Cu元素主要是以某种配位结构(如孤立的Cu2+)分散于沸石孔道中。同时,还存在部分的氧化铜晶粒高度分散在分子筛表面。

图4 Cu0.25-SAPO-44催化剂的TEM照片((a): (1)-(4))和HR-TEM照片((a): (5), (6)); Cu0.25-SAPO-44催化剂的元素能谱分布(b)Figure 4 TEM images ((a): (1)-(4)) and High-resolution TEM images ((a): (5), (6)) of Cu0.25-SAPO-44 catalyst sample; EDS mapping results (b) of Cu, Al, Si and P elements of Cu0.25-SAPO-44 catalyst sample
2.4 NH3-TPD表征
Cu-SAPO-44催化剂的NH3-TPD谱图如图5所示,通过谱图上NH3脱附峰的面积和位置可以定量的解释催化剂的酸性及强度。可以发现,相比于SAPO-44样品,在5个Cu-SAPO-44样品上都出现3个主要的NH3脱附峰,分别位于200、360和420 ℃附近。一般而言,200 ℃附近出现的低温峰主要包含物理吸附NH3和弱Lewis酸位点上的弱吸附NH3,360 ℃附近的宽峰属于孤立铜离子产生的强Lewis酸位上吸附的NH3,420 ℃附近的峰属于来源于强Bronsted酸位上吸附的NH3[10,26-28]。与SAPO-44相比,引入铜物种后分子筛表面的Lewis酸和Bronsted酸都明显增强。当Cu含量较小时(Cu/Al<0.25)时,随着Cu/Al增加,其位于中高温处的脱附峰逐渐增强,强Lewis酸和Brønsted酸的密度有所增加,说明Cu离子的加入使催化剂产生更多的酸性位点。然而,当Cu含量过大(Cu/Al>0.25)时,弱Lewis酸和强Lewis酸的密度都明显减弱,而属于强Brønsted酸的脱附温度向高温偏移,说明酸强度增加但酸量明显减少。 Lewis酸主要来源于金属阳离子[25],Lewis酸量的减少可能与铜物种中孤立Cu2+的比例下降有关。同时,420 ℃附近所对应Brønsted酸的相对密度有所减小,B酸来源于分子筛骨架中的桥接羟基(Si-OH-Al)[25,27],说明过大的Cu/Al对沸石骨架结构有一定的影响。Cu0.25-SAPO-44的酸密度最高,具有丰富的酸性位,在HC-SCR反应中有助于NO和C3H6活化,从而提高脱硝活性[29,30]。

图5 不同Cu含量的Cu-SAPO-44催化剂的NH3-TPD谱图Figure 5 NH3-TPD spectra of Cu-SAPO-44 catalyst samples with different Cu contents
2.5 UV-vis紫外可见光谱表征
不同Cu含量的Cu-SAPO-44催化剂的紫外-可见吸收光谱谱图如图6所示。根据文献报道,在UV-vis谱图中位于225 nm附近的峰归属于孤立的Cu2+与沸石骨架上晶格O2-之间电荷的转移[31,32],出现在350 nm附近和460 nm附近的谱带则分别归属于O-Cu-O配合物和Cu-O-Cu配合物,在600-800 nm出现的宽谱带归属于Cu2+在CuO颗粒中被氧包围的扭曲八面体配位中电子d-d跃迁[27,33-35]。从图6中可以看出,250 nm处出现了主要的特征光谱信号,且随着Cu/Al的增加,此信号的相对强度增加,说明Cu-SAPO-44分子筛中Cu物种主要以骨架外孤立的Cu2+的形式存在。所有样品在350 nm附近和460 nm附近的谱带强度都很低,说明其对应的低聚态Cu含氧物种并不是Cu-SAPO-44上Cu物种的主要形式。当Cu/Al超过0.25时,随着Cu/Al的继续增加,250 nm处谱带的强度几乎保持不变,而600-800 nm处谱带的强度却明显增强,说明与Cu0.25-SAPO-44样品相比,Cu0.35-SAPO-44和Cu0.45-SAPO-44中生成CuO的数量有所增加,孤立Cu2+的相对含量有所降低,这与XRD表征相符。UV-vis结果表明,以Cu-TEPA为铜源,在一步水热合成的Cu-SAPO-44分子筛上会生成部分的CuO,且随着Cu-TEPA引入量的增加,Cu物种中CuO的相对含量会有所增加。
2.6 H2-TPR测试
通过H2-TPR可以测定分子筛上不同铜物种的还原温度,从而可以确定它们的种类和化学状态。选取Cu0.05-SAPO-44、Cu0.25-SAPO-44、Cu0.45-SAPO-44催化剂和CuO与SAPO-44机械混合后的样品进行H2-TPR测试,结果如图7所示。由图7可以发现,CuO与SAPO-44的混合样品在280 ℃附近出现了归属于CuO的还原峰,而Cu-SAPO-44催化剂主要在200-250 ℃出现了明显的还原峰,在300 ℃附近出现了较强的还原峰。根据文献[27,36-39],在低温范围(200-400 ℃)内,铜物种主要对应两个H2还原峰,一个对应的是孤立的Cu2+→Cu+,另一个对应的是CuO→Cu0,且Cu2+→Cu+温度一般低于CuO→Cu0;而在高温范围内发生主要对应Cu+→Cu0。因此,本研究中在200-250 ℃附近的较宽还原峰归属于Cu2+→Cu+,随着Cu/Al的增加其还原峰强度逐渐增加,且向低温偏移。在300 ℃附近出现的还原峰则归属于CuO的还原峰,相比较CuO与SAPO-44机械混合样品的还原峰向高温方向偏移。随着Cu/Al的增加,CuO的还原峰强度明显增加,表明水热合成的分子筛表面生成了更多的氧化铜物种,这与XRD中的结果一致。随着温度升高,Cu0.25-SAPO-44在520 ℃附近出现了较宽的还原峰,可以归属于Cu+被还原为Cu0,而Cu0.05-SAPO-44和Cu0.45-SAPO-44也分别在500及450 ℃附近出现了Cu+的还原峰。

图7 不同Cu含量的Cu-SAPO-44催化剂的H2-TPR谱图Figure 7 H2-TPR profiles of Cu-SAPO-44 catalyst samples with different Cu contents
2.7 C3H6-SCR活性分析
Cu-SAPO-44催化剂及SAPO-44的C3H6-SCR活性(NOx、C3H6转化率和N2选择性)测试结果如图8所示。从NOx转化率图中可以看出,随着温度的升高,Cu-SAPO-44催化剂脱硝活性呈现出先升高后降低的趋势,在250-400 ℃条件下C3H6-SCR活性相对较高。相比于Cu-SAPO-44催化剂,在400 ℃以下纯SAPO-44分子筛的脱硝效率都相对较低。Cu-SAPO-44催化剂脱硝效率显著高于SAPO-44,说明Cu-TEPA的引入显著增强了分子筛的脱硝催化活性。当反应温度低于300 ℃时,随着Cu/Al的增加,Cu-SAPO-44催化剂的脱硝效率也有所增加。温度继续升高至300 ℃,所有样品(Cu0.05-SAPO-44除外)的NOx转化率都能达到近90%。在300-350 ℃时,Cu0.25-SAPO-44催化剂保持90%以上的NOx转化率,在所有样品中表现出最佳的脱硝性能。当反应温度在300-400 ℃时,催化剂的脱硝效率为Cu0.25-SAPO-44>Cu0.35-SAPO-44>Cu0.45-SAPO-44>Cu0.15-SAPO-44>Cu0.05-SAPO-44>SAPO-44,说明Cu-SAPO-44上铜物种的负载量和分布形式对其脱硝活性有很大的影响。此外,以5%CuO和石英砂混合物为催化剂进行了相同条件下的脱硝活性测试。结果表明,CuO基本没有脱硝活性,说明CuO不是C3H6-SCR反应的活性位点。随着Cu-SAPO-44合成样品中Cu含量增多,导致分子筛表面聚集生成CuO的相对含量增加,Cu-SAPO-44样品的脱硝效率反而下降,说明只有适量的铜物种引入到SAPO-44分子筛中,才具有最佳的脱硝性能。

图8 不同Cu含量Cu-SAPO-44催化剂的NOx、C3H6转化率和N2选择性Figure 8 NOx, C3H6 conversion and N2 selectivity of Cu-SAPO-44 catalyst samples with different Cu contents (Test conditions: NO 0.05%, C3H6 0.05%, O2 10%, H2O 5%)
从C3H6转化率图中可以看出,Cu-SAPO-44催化剂的C3H6转化率在实验温度范围内都高于纯SAPO-44催化剂,说明Cu物种的引入有助于促进C3H6的转化。当反应温度低于300 ℃时,Cu-SAPO-44催化剂上C3H6转化率随着Cu/Al的增加而有所增加。当反应温度达到300 ℃,所有样品的C3H6转化率达到了100%,此时样品的NOx转化率几乎也达到100%,说明转化的C3H6主要用于选择性还原NO反应。而当反应温度高于550 ℃时,C3H6的转化率保持稳定,但催化剂的脱硝效率明显下降。在富氧条件下,随着反应温度的升高, C3H6-SCR反应中会出现丙烯非选择性的燃烧反应,这与Cu-SAPO-44分子筛表面形成的CuO物种有关[21]。
从N2选择性图中可以看出,Cu-SAPO-44催化剂在250-400 ℃都保持了近90%N2选择性。低温范围和高温范围内,反应后气体中存在较多的NO2,从而导致了N2选择性的下降。结合脱硝测试和前文的表征结果可知,Cu0.25-SAPO-44具有最大的比表面积、丰富的酸性以及较多的孤立Cu2+,为C3H6-SCR反应提供了大量的活性位点,因此,具有最佳的C3H6-SCR脱硝活性。
对Cu0.25-SAPO-44催化剂样品进行了长达50 h的持久性反应测试(图9),Cu-SAPO-44仍然能够保持60%以上的NOx转化率和90%以上的N2选择性,表现出良好的反应稳定性。

图9 Cu0.25-SAPO-44催化剂样品的脱硝持久性测试Figure 9 Long term DeNOx test over Cu0.25-SAPO-44 catalyst
2.8 In situ DRIFTS原位红外光谱
为了进一步探究Cu-SAPO-44催化剂的C3H6-SCR反应机理,明确其反应中间产物,对SAPO-44和Cu0.25-SAPO-44分别进行了原位红外光谱实验。图10展示了在250 ℃下,SAPO-44和Cu0.25-SAPO-44上NO+O2吸附45 min后吸附NO+O2+C3H6的原位红外谱图,图11展示了Cu0.25-SAPO-44在NO+O2+C3H6的氛围中程序升温过程中的原位红外光谱谱图。

图10 SAPO-44(a)、Cu0.25-SAPO-44(b) 催化剂样品上吸附NO + O2 + C3H6的原位红外谱图Figure 10 In situ DRIFTS spectra of NO + O2 + C3H6 adsorbed on SAPO-44(a), Cu0.25-SAPO-44(b) catalyst samples for 45 min and then adding C3H6
在吸附NO+O245 min后,Cu-SAPO-44催化剂上在1629和1594 cm-1处出现明显的红外特征峰,分别归属于桥式硝酸盐和双齿硝酸盐[21,40],出现在1905和1845 cm-1处的峰归属于Cu2+-NO,而在SAPO-44分子筛上对应位置出现了较弱的特征峰,说明NO经过氧化后形成的NO2在样品分子筛上进一步被活化为各种硝酸盐类物种。Zhou等[23]的研究表明,在Cu-SAPO-34催化剂中,孤立的Cu2+离子是C3H6-SCR反应过程中主要的活性物种,通过Cu2+→Cu+→Cu2+的循环来提高反应的脱硝效率。前文的系列表征表明,Cu-SAPO-44中Cu物种主要以孤立Cu2+的形式存在,为反应提供了更多的活性位点,促进了NO的吸附和活化[41]。随着C3H6的逐渐加入,Cu-SAPO-44的谱图上发生了明显的改变,出现甲酸根(1481 cm-1)[23]、醋酸根(1532和1475 cm-1)[42-44]、单齿硝酸盐(1282和1265 cm-1)、吸附C3H6(1215 cm-1)[23]等丙烯活化物种,而在SAPO-44的谱图中仅出现了微弱的碳酸根,以及少量吸附的C3H6物种,说明Cu物种的存在同时促进了C3H6的吸附与活化。
从程序升温过程反应中的原位红外谱图(图11)中发现,随着温度升高,NO(1621 cm-1)特征峰逐渐消失,当温度超过350 ℃时逐渐再次出现,升温过程中出现了甲酸盐(1479 cm-1)、醋酸盐(1565 cm-1)等物种,这可能是B酸位上吸附的C3H6被附近的Cu2+离子活化[41],生成-CxHyOz物种以及-CxHy,进而与部分NO2反应生成异氰酸酯-NCO(2260和2151 cm-1),同时Cu+再被氧化成Cu2+[23,41,45-47]。-NCO被认为是C3H6-SCR反应中的关键中间产物,进一步与NO/NO2反应生成CO2、H2O和N2[23,48]。当温度超过350 ℃时,谱图上CO2(2362 cm-1)[49]所对应的峰值明显增加,这可能与反应过程中C3H6的燃烧反应有关,从而导致了高温时脱硝效率明显下降。根据原位红外光谱分析,Cu-SAPO-44催化剂上C3H6-SCR主要的中间反应如下所示:


图11 Cu0.25-SAPO-44催化剂上NO + C3H6 + O2反应的原位红外光谱谱图Figure 11 In situ DRIFTS spectra of NO + C3H6 + O2 over Cu0.25-SAPO-44 catalyst sample
3 结 论
以环己胺(CHA)为结构导向剂,Cu-TEPA为共模板剂,通过一步水热合成法制备出具有不同Cu/Al的Cu-SAPO-44分子筛,用于在贫燃条件下催化丙烯选择性还原NO。通过一系列的表征研究Cu-TEPA的引入量对Cu-SAPO-44的物理化学性质和C3H6-SCR脱硝性能的影响。结果表明,相比于纯SAPO-44,Cu-TEPA引入有效提高了催化剂的脱硝活性。当Cu/Al=0.25时,Cu0.25-SAPO-44催化剂具有最大的比表面积、丰富的酸性位和较多的孤立Cu2+活性位,因此,具有最佳的脱硝性能。在含10%O2和5%H2O的烟气条件下,在300-350 ℃时,可实现90%以上的NOx转化率和N2选择性。当Cu-TEPA引入量较小时,分子筛结晶度较低,反应活性位点较少,导致脱硝效率不高。当Cu-TEPA引入量过多,铜物种会聚集生成相对较多无活性的CuO,从而降低了脱硝活性。原位红外光谱结果表明,孤立的Cu2+可以促进NO和C3H6的吸附与活化,有利于生成反应关键中间产物-NCO。
50 h的持久性实验表明,Cu-SAPO-44催化剂可以持续维持超过60%的脱硝效率和超过90%的N2选择性,表现出良好的稳定性能。

