大鼠脊髓内吗啡肽2的表达与腰椎间盘突出症坐骨神经痛的相关性分析*
牛 乐,王延军,岳江涛,梅江涛,贾晓康,戴先文
(1.西安市大兴医院骨科 710016;2.西安市长安医院骨科 710016)
腰椎间盘突出症坐骨神经痛(lumbar disc herniation sciatica,LDHS)是腰椎间盘突出症最常见的并发症,LDHS表现为单侧或双侧下肢放射痛,逐渐加重的放射痛长期折磨患者,部分患者甚至合并有焦虑和抑郁等精神、心理障碍。传统的外科治疗手段存在创伤大、费用高及风险高等缺点[1-2]。LDHS患者的生活质量受到了极大影响,因此进一步揭示其发病机制,研制新型镇痛药物及探寻更有效的治疗方法刻不容缓[3]。内吗啡肽(endomorphin,EM)包括内吗啡肽2 (endomorphin-2,EM2)和内吗啡肽1 (endomorphin-1,EM1)是吗啡的内源性相似物,其主要作用于μ型阿片受体(mu-opioid receptor,MOR)产生镇痛作用,与相同量的吗啡比能产生更强的止痛效果,而极少产生不良反应[4-5]。以往有学者建立坐骨神经分支选择性损伤(spared nerve injury,SNI)神经病理性痛小鼠模型,经中枢侧脑室或外周脚趾给药后发现EM2和EM1能产生比吗啡更强的镇痛作用[6]。脊髓背角是痛觉信号传递的初级中枢和第一道闸门,脊髓背角富含EM2,其来源于背根节神经元的初级传入纤维。脊髓背角EM2在神经病理性痛状态下痛觉信号传递的调控中扮演着极为重要的角色[7-8]。LDHS本身就是神经病理性痛,但既往并无文献报道脊髓EM2与LDHS的相关性。本研究以LDHS大鼠为实验动物模型,综合利用痛觉行为学、药理行为学、生物化学及形态学等实验方法探寻脊髓背角EM2表达量的变化及其与LDHS痛觉阈值的关联性,从一个崭新的角度解释LDHS的发病机制。
1 材料与方法
1.1实验动物
本研究所有实验操作均严格遵循善待动物的国际伦理准则[9]。成年雄性SD大鼠(体重200 g左右),来源于西安交通大学实验动物中心(动物使用合格证号:SYXK陕2021-008,动物生产许可证号:SCXK陕2021-006)。
1.2方法
1.2.1动物分组
大鼠随机分为LDHS组、假处理组和对照组,LDHS组采用自体髓核移植法造模,假处理组采用相同的手术过程而未移植髓核,对照组为空白对照,未经任何处理。
1.2.2实验设计
大鼠共计220只用于本实验。首先,对照组、假处理组和LDHS组每组各10只,共计30只用于痛觉行为学实验;然后LDHS组大鼠共计10只,在造模后15 d进行行为药理学实验,即经脊柱鞘内置管后注射不等剂量MOR拮抗剂——β-富纳曲胺(β-funaltrexamine,β-FNA)、EM2、EM1或吗啡,然后记录痛觉阈值的变化;最后,180只用于生化实验和形态学实验,LDHS组、假处理组和对照组在造模前和造模后5、10、15、20、25 d共6个时间点(每组各10只/时间点),大鼠被处死后取出脊髓组织,利用免疫荧光组织化学染色和高效液相色谱法(high performance liquid chromatography,HPLC)检测脊髓EM2表达水平的变化。
1.2.3建立动物模型
LDHS模型的建立遵照既往造模方法[10-11],即经腹腔注射2%戊巴比妥(50 mg/kg)浅麻醉大鼠,取俯卧位,以L4~L6为中心用聚维酮碘消毒皮肤3遍,取后正中纵行1.5 cm切口,逐层分离筋膜层和椎旁肌,显露L5~L6关节突关节,咬除部分关节突关节及部分L5椎板,显露L5背根神经节及神经根。距肛门1 cm处断尾并缝合伤口。依次切开尾椎髓核环,取出直径3 mm髓核3个,将取出的髓核压迫于L5神经根侧方,用无菌生理盐水及稀释聚维酮碘液反复冲洗伤口3遍,逐层缝合切口,最后外用红霉素软膏预防感染。
1.2.4行为药理学
行为药理学实验只在LDHS组进行,不在对照组和假处理组进行。鞘内置管:将2%戊巴比妥钠(50 mg/kg)注射入腹腔浅麻醉大鼠,用聚维酮碘消毒局部皮肤3遍,于L4棘突取后正中纵形切口0.5 cm,钝性分离浅筋膜及椎旁肌,显露椎骨,用咬骨钳咬除小部分黄韧带及椎板,剪开硬脊膜,将PE-10细导管置入蛛网膜下腔,导管远端直达腰膨大处,见有脑脊液不断流出即封闭导管外口,用无菌生理盐水及稀释聚维酮碘液反复冲洗伤口3遍,逐层缝合,最后外用红霉素软膏预防感染。若大鼠麻醉清醒后双下肢无运动障碍,且鞘内注入2%利多卡因后双下肢5 s内瘫软,即为鞘内置管成功[12-13]。鞘内给药:LDHS组,鞘内给予吗啡(0.3、1.0、3.0 μg)、EM1(0.3、1.0、3.0 μg)、EM2 (0.3、1.0、3.0 μg)或β-FNA(3.0、10.0 μg);溶剂对照组给予等量无菌生理盐水,然后检测痛觉阈值变化,同时计算不同剂量吗啡、EM1或EM2的最大镇痛百分比(%) =(给药后最高阈值-给药前阈值)/(造模前阈值-造模后最低阈值)×100%。
1.2.5痛觉阈值检测
von Frey纤维丝是国际公认的检测痛觉阈值的经典实验仪器,本研究所使用von Frey纤维丝购自美国Stoelting公司,将大鼠放置于铁丝网上,用有机玻璃透明罩约束其活动范围。大鼠先适应15 min,然后用von Frey纤维丝刺戳足底,刺激的力量强度由小至大,以“g”表示。若出现缩足反射,则该强度被及时记录,该强度重复测量10次,若出现5次以上缩足反射即认为阳性反应,出现阳性反应的最小强度即为痛觉阈值[14-15]。痛觉阈值单位为“g”。
1.2.6免疫荧光染色
将2%戊巴比妥钠(100 mg/kg) 注射入腹腔深麻醉大鼠,开胸显露心脏,剪破右心耳彻底放血,经左心室插管至升主动脉,先用PBS快速冲洗掉机体内残存的血液,再用4%多聚甲醛缓慢灌注固定,时长30 min。随后取出脊髓腰膨大,将组织块浸入含30%蔗糖的PBS,时长12 h。恒冷箱切片机切取25 μm厚的脊髓组织片,组织片被PBS漂洗3次后,用兔抗EM2 IgG(美国Chemicon公司,货号AB5104,浓度为1∶200)室温下孵育组织片12 h;组织片被PBS彻底漂洗后,红色荧光素Cy5标记的二抗室温孵育组织片6 h;再次被PBS彻底漂洗后利用荧光显微镜摄片观察。
1.2.7HPLC定量分析EM2表达水平
将2%戊巴比妥钠(100 mg/kg) 注射入腹腔深麻醉大鼠,迅速取出脊髓腰膨大,液氮冻存;将组织块与裂解液混合,超声裂解后超高速离心取上清液;Hypersil ODS 填料色谱柱(4.6 mm×250 mm,5 μm,美国Termo Electron公司);柱温为40 ℃;进样量为10 μL;流动相∶甲醇-0.1%三乙胺溶液(65∶35);流速为1.0 mL/min;检测波长为570 nm[16]。
1.3统计学处理
2 结 果
2.1LDHS大鼠痛觉阈值显著降低,形成了机械性异常疼痛
与对照组[(27.0±2.6)g]和假处理组[(27.1±1.5)g]比较,LDHS组在大鼠自体髓核移植后5 d痛觉阈值显著降低[(11.2±2.5)g],15 d时达到最低值[(5.0±1.8)g],即机械性异常疼痛已显著形成,并且15 d后机械性异常疼痛稳固维持(n=10,P<0.05);在造模前3组之间痛觉阈值无差异;对照组和假处理组痛觉阈值在造模后也无差异,见图1、表1。

a:P<0.05,b:P<0.01,与对照组比较。
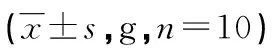
表1 各组造模前及造模后痛觉阈值比较
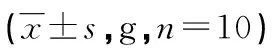
续表1 各组造模前及造模后痛觉阈值比较
2.2LDHS大鼠拮抗内源性EM2加深疼痛,给予外源性EM2镇痛作用明显
在LDHS组痛觉阈值的最低点,即造模后15 d经鞘内给予β-FNA能够明显加深疼痛(图2A);而鞘内给予EM2能剂量依赖地产生镇痛作用(图2B);EM1或吗啡经鞘内给药后均能剂量依赖性地镇痛(图2C、D);但在相同剂量情况下,EM2镇痛作用比EM1和吗啡强(图2E)。

A:鞘内给予β-FNA;B:鞘内给予EM2;C:鞘内给予EM1;D:鞘内给予吗啡;E:EM2、EM1、吗啡镇痛作用比较;a:P<0.05,b:P<0.01,与生理盐水比较;c:P<0.05,与吗啡比较;d:P<0.05,与EM1比较(E)。
2.3LDHS大鼠脊髓EM2显著减少,与痛觉阈值的降低呈正相关
与假处理组[(77.6 ± 3.8)ng/mg]和对照组[(78.8 ± 4.6)ng/mg]比较,LDHS组脊髓EM2的表达在造模后5 d显著减少[(47.8±5.3) ng/mg],15 d时减少至最低水平[(18.9±3.6) ng/mg],并在15 d一直维持此水平(n=10,P<0.05,图3A)。LDHS组EM2的表达与痛觉阈值呈显著正相关 (r=0.966,P<0.001,图3B)。与假处理组和对照组比较,LDHS组脊髓背角EM2染色密度显著减低,EM2免疫荧光阳性结构集中在脊髓背角浅层(图3C)。

A:脊髓组织EM2表达量;B:LDHS组痛觉阈值与脊髓EM2表达水平的相关性;C:脊髓背角EM2免疫荧光染色标尺=200 μm(×200);a:P<0.05,b:P<0.01,与对照组比较。
3 讨 论
随着现代社会久坐及弯腰负重工作方式的增多,腰椎间盘突出症呈年轻化态势且发病率逐年攀升。LDHS是腰椎间盘突出症最常见和棘手的并发症,其表现为单侧或双侧下肢放射痛,逐渐加重的放射痛长期折磨患者,部分患者甚至伴随有下肢肌力减退及大小便障碍[1-3]。尽管外科治疗手段日益成熟,但相当多的患者考虑到风险高及费用昂贵,仍要求保守治疗。针对LDHS的内科镇痛药为弱阿片类或非甾体类药物,这些药物长期使用极易产生成瘾性和耐受性,并且造成各种不良反应[17-18]。LDHS患者的生活质量受到了极大影响,因此进一步揭示其发病机制,研制新型镇痛药物及探寻更有效的治疗方法刻不容缓[19]。既往腰部脊髓神经根的病变是LDHS研究的焦点,而本研究从新的角度提出脊髓EM2的低表达导致了LDHS的产生,为LDHS的预防和治疗提供了新的理论意义。
既往研究表明,腰部神经根的机械性受压和炎性变是LDHS发病的根本原因,然而近期诸多学者坚信脊髓和大脑的功能异常或病理改变在LDHS的发病过程中扮演着至关重要的角色[20]。脊髓背角是痛觉信号传递的第一道闸门和初级中枢,大脑中的前扣带回皮质和岛叶也与痛觉调控密切相关。有研究在功能性核磁共振检查中发现LDHS患者脊髓背角、前扣带回皮质及岛叶处于过度激活和代谢活跃状态[21]。另有学者发现LDHS大鼠脊髓背角神经元的自发放电频率显著增加[22],表明LDHS状况下痛觉信号在脊髓背角的传递出现了强化和扩大。EM是最新发现的内源性阿片肽,包括EM2和EM1。EM作为内源性物质,与相同量的吗啡比较能产生更强的止痛效果,而极少产生不良反应[4-8]。脊髓背角富含EM2,其在神经病理性痛的诱发和维持中扮演着极为重要的角色,外周神经结扎或切断可导致脊髓EM2的表达显著下调[23],全身或脊柱鞘内注射EM2可对神经病理性痛起到显著的镇痛作用[24]。鉴于既往无LDHS与脊髓EM2关联性的文献报道,本研究从新的切入点,即脊髓水平探索LDHS的发病机制。本研究建立的LDHS大鼠模型其下肢机械性异常疼痛稳定存在,本研究发现LDHS大鼠脊髓背角EM2的免疫荧光染色强度和脊髓EM2的表达水平均显著减低。既往研究表明,在外周神经损伤性痛[23]、糖尿病性痛[16]及化疗性痛[25]等动物模型脊髓背角EM2的表达水平显著减少,本研究结果与既往研究结果具有一致性。本研究进一步分析发现LDHS大鼠脊髓EM2的表达水平与痛觉阈值呈显著正相关,而鞘内给予β-FNA可使疼痛进一步加深,这就完全印证了本研究的结论,即LDHS大鼠脊髓背角EM2的表达水平下调导致内源性镇痛作用的减小,最终强化痛觉信号的传递,导致LDHS大鼠痛觉阈值的减低。
杨代军[6]研究表明,在坐骨神经分支选择性损伤(SNI)神经病理性痛小鼠模型,经中枢侧脑室或外周脚趾给药后EM2和EM1能产生比吗啡更强的镇痛作用,但EM2和EM1的镇痛持续时间比吗啡短。本研究在LDHS大鼠经脊髓鞘内注射EM2能产生比EM1或吗啡更强的镇痛作用,同样EM2和EM1的镇痛持续时间比吗啡短。杨代军[6]研究与本研究的相似之处:均为建立动物疼痛模型,给药EM2、EM1或吗啡进行镇痛研究,并且在镇痛效能和镇痛持续时间方面分析了EM2、EM1与吗啡之间的区别。杨代军[6]研究与本研究的区别之处:(1)杨代军[6]在实验中使用各种阿片受体拮抗剂进一步分析了EM镇痛的阿片机制,其研究更加深入;而本研究未探索EM镇痛的阿片机制。(2)两种动物模型所代表的临床实际意义不同。杨代军[6]在实验中建立SNI神经病理性痛模型,该模型主要模拟急性创伤患者,这些患者由于车祸、高处坠落、战争中枪击或爆炸等原因导致下肢神经出现挫伤或离断,引起下肢剧烈疼痛,疼痛程度较重;而本研究建立了LDHS模型,该模型主要模拟中老年腰椎间盘突出症患者,这些患者由于久坐或长期弯腰负重导致腰部劳损和退变,突出之腰椎间盘压迫坐骨神经,引起下肢疼痛,疼痛程度属中等。
综上所述,本研究结果不仅对阐明LDHS的中枢机制、了解EM在病理状态下的作用具有重要的理论意义,而且对开发新一代镇痛药、造福LDHS患者均具有重要的理论意义。本研究的局限性:(1)在LDHS大鼠模型未观察EM2所起镇痛作用的具体阿片机制,需进一步利用各种阿片受体拮抗剂分析EM2作用于哪种阿片受体起到镇痛机制;(2)未探索EM2所起镇痛作用的具体胞内分子机制,需进一步利用分子生物学及神经电生理膜片钳技术分析EM2作用于阿片类受体后产生的细胞内分子机制。

